UNC-51样激酶1在食管癌组织中的表达及其意义
2018-12-28刘欣韵蒋小芹鲍晶晶窦蓉蓉刘福兴戴桂红朱晓蔚陈民于鸿
刘欣韵, 蒋小芹, 鲍晶晶, 窦蓉蓉, 刘福兴, 戴桂红,朱晓蔚, 陈民, 于鸿
(泰州市人民医院 1. 病理科, 2. 皮肤科, 江苏 泰州 225300)
细胞自噬是一种广泛存在于真核生物中的正常生理过程,一旦机体出现自噬过度或自噬不足都可以导致疾病的发生,自噬活性的改变与肿瘤的发生、发展密切相关[1]。真核生物中至少存在36种自噬相关基因[2],其中哺乳动物中的同系物有两种:UNC-51样激酶1(UNC51-like kinase 1,ULK1)和ULK2[3]。其中ULK1在细胞自噬过程中起着中心角色的作用[4]。近来研究显示,ULK1表达与乳腺癌、肝细胞癌和食管癌等肿瘤预后密切相关[5]。本研究应用组织芯片技术对94例食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)及78例癌旁组织进行了分析, 以进一步验证ULK1作为ESCC生物标志物的可能性。
1 材料与方法
1.1 对象和组织样本
94例食管癌标本均来自本院2011年1月至2016年1月间手术病例,其中,男70例,女24例;年龄41~81岁(中值65岁)。所有样本均经病理检查诊断为鳞状细胞癌。病理分级:Ⅰ级31例,Ⅱ级51例,Ⅲ级12例;TNM分期:Ⅰ期5例,Ⅱ期50例,Ⅲ期37例,Ⅳ期2例。34例有淋巴结转移(36.2%),肿瘤大小1.2~10 cm(中值4.5 cm)。所有患者在肿瘤切除前均未接受任何抗癌治疗。本项目经泰州人民医院伦理委员会批准,患者均签署了知情同意书。
1.2 组织芯片制备
食管癌组织芯片由上海芯超生物科技有限公司制备,具体制作方法参照文献[6]。首先对每一个供体蜡块进行切片和HE染色,显微镜下对所需穿取的目标组织定位,选取癌组织、癌旁组织共计172个位点(癌组织94个、癌旁组织78个)。利用组织芯片制作仪(Beecher Instruments公司),依次从供体蜡块上穿取直径为1.5 mm的组织芯,插入有172点阵的受体蜡块中,以4 μm的厚度连续切片。所得组织芯片的每个点都经过病理诊断。
1.3 免疫组织化学染色
63 ℃烤片1 h,常规脱蜡水化;使用EDTA热修复法修复抗原20 min,水池中冷却30 min;取出置于内源性过氧化物酶阻断剂中15 min; PBS缓冲液冲洗3次;滴加兔抗人多克隆抗体(1 ∶30,DAKO公司);冰箱4 ℃过夜;PBS缓冲液冲洗3次;滴加EnVisionTM+/HRP兔工作液(丹麦DAKO公司),孵育30 min; PBS冲洗3次;DAB显色,蒸馏水水洗终止显色;苏木素复染、水洗、分化后充分水洗返蓝;常规脱水、透明,中性树胶封片;PBS代替一抗作为阴性对照,同时每张切片设置自身对照。
1.4 结果判定
1.4.1 组织芯片染色结果判定 将组织芯片中研究样本充足、易于观察的位点判断为有效患者;而切片折叠、着色失败以及观察时未能找到癌细胞的位点,判断为无效或无意义患者。在研究样本中剔除无效或无意义患者。
1.4.2 免疫组织化学结果判定 染色强度结果: 无着色为0分,着色较弱为1分,着色适中为2分,着色较强为3分。ULK1阳性细胞的百分比分值:无阳性细胞为0分,小于20%为1分,20%~75%为2分,>75%为3分。染色强度和阳性细胞百分比积分两者乘积得分>4时为高表达,≤4时为低表达。
1.5 统计学处理
采用SPSS 20.0软件进行统计分析。各组间显著性检验采用四格表χ2检验。使用Kaplan-Meier法和Log-rank检验分析ULK1表达程度对食管癌患者生存期的影响。P<0.05为差异有统计学意义。
2 结果
2.1 ULK1在ESCC和癌旁组织中的表达
成功构建172个位点的组织芯片(含94个癌组织位点及78个癌旁组织位点,图1)。免疫组化结果显示,ULK1在食管癌组织及癌旁组织中均有不同程度的表达(图2)。ULK1蛋白主要定位在细胞胞质,少部分在细胞核中也有表达。在癌旁组织中,有40例不表达ULK1蛋白。根据上述结果判定标准,将表达ULK1的组织位点分为高表达组与低表达组。对食管癌组织和癌旁组织ULK1的表达进行χ2检验,结果显示ULK1在食管癌组织胞质和细胞核中的表达均明显高于癌旁组织(均P<0.01)。见表1。

图1 含172个位点的食管癌及癌旁组织芯片
2.2 ULK1表达水平与ESCC患者病理特征的关系
ULK1表达高低与淋巴结转移具有显著相关性(P<0.05)。年龄、肿瘤大小、病理分级以及TNM分期等临床病理特征与ULK1表达高低无明显关系。见表2。

图2 食管鳞状细胞癌中ULK1的表达
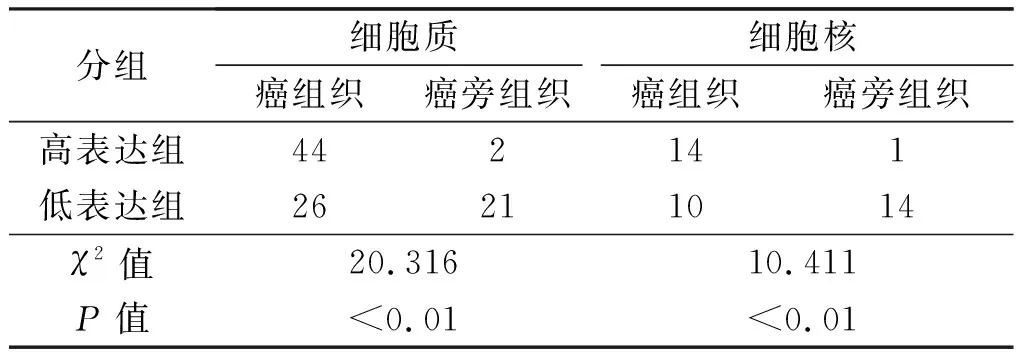
分组细胞质细胞核癌组织癌旁组织癌组织癌旁组织高表达组442141低表达组26211014χ2值20.31610.411P值<0.01<0.01
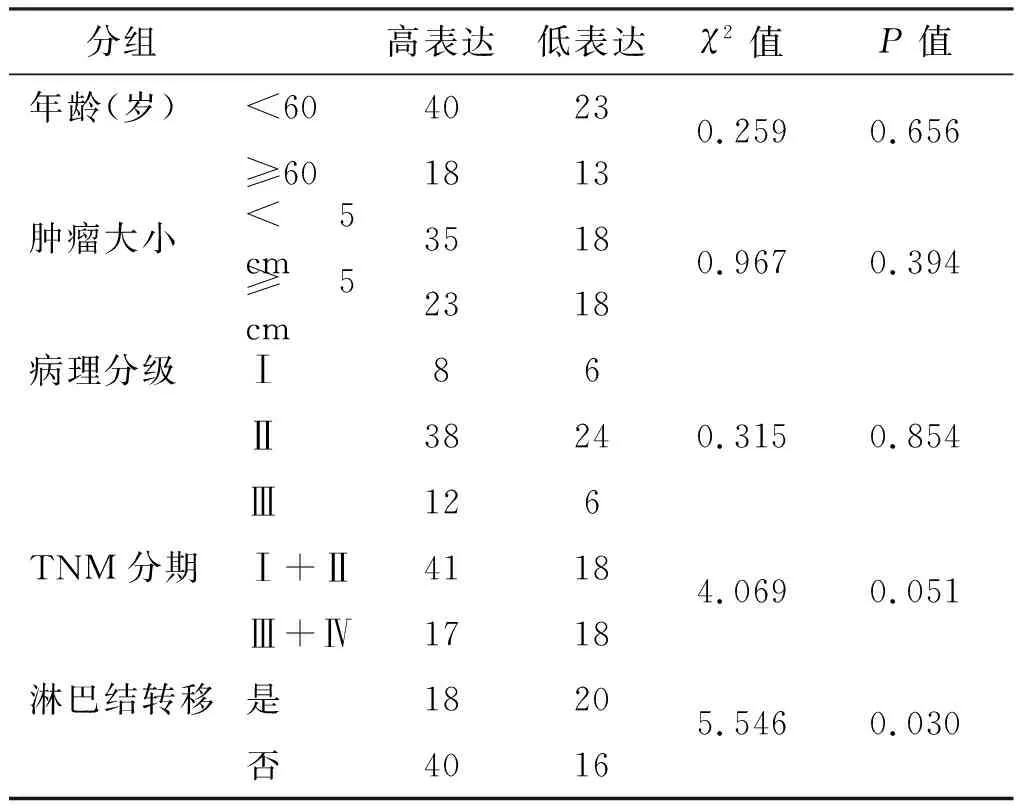
表2 ULK1的表达与患者临床病理特征的关系
2.3 生存分析
ESCC患者的随访时间为0~61个月。94例ESCC患者的中位生存时间(median survival time,MST)为30个月。ULK1胞质高表达者MST为33个月,而ULK1胞质低表达者的MST为22个月(P=0.036,图3)。ULK1低表达患者的生存率明显低于ULK1胞质高表达者(危险比=1.754,95%CI1.022~3.010,P=0.041)。
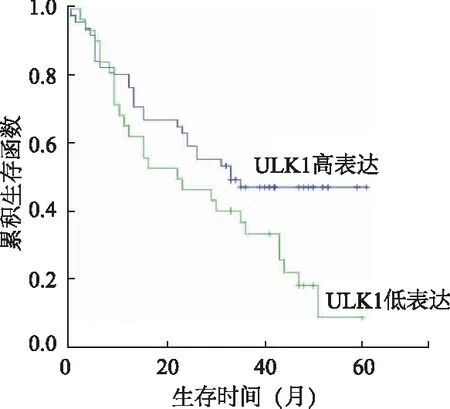
图3 ULK1不同表达水平患者的生存曲线
3 讨论
哺乳动物细胞中的自噬过程分为3类形式:大自噬,小自噬,分子伴侣介导的自噬。其中大自噬作为一种强有力的降解机制,可将胞质中的蛋白分子甚至是整个细胞器降解消除,因此大自噬在肿瘤抑制和免疫方面发挥着最为重要的作用[7-8]。作为人类高保守自我保护机制,自噬通过选择性破坏肿瘤细胞抑制肿瘤的进一步发展,而作为一种控制大自噬发生的重要激酶,ULK1 在恶性肿瘤的发生发展中扮演着极为重要的角色。Tang等[9]报道ULK1表达水平与乳腺癌患者的生存期呈正相关,高表达者生存期长,并且ULK1表达水平是乳腺癌患者的一个独立预后因素。我们的前期研究却发现肝细胞癌中ULK1高表达患者预后不良[10]。Jiang等[11]的研究显示,相比于ULK1低表达ESCC患者,ULK1高表者预后较好。本研究结果也显示,ULK1高表达的ESCC患者生存期显著高于低表达者,与Jiang等研究结果基本一致。上述研究结果表明,ULK1在不同肿瘤细胞中可能具有不同的作用机制。随着对自噬过程研究的深入,人们已经意识到自噬在肿瘤的发生发展过程中扮演着“双刃剑”的角色,在不同的肿瘤类型、阶段、微环境中,自噬既可促进肿瘤的发生发展,也可起抑制作用[12-13]。本研究结果显示,ULK1在食管癌组织中的胞质和细胞核中的表达均显著高于癌旁组织,ULK1的表达高低与淋巴结转移及患者生存期显著相关,提示ULK1在ESCC的发生、发展过程中起着重要作用。大量研究已经证实,肿瘤细胞的生长依赖血管的形成, 而ESCC是一种缺乏充足血供的实体肿瘤,但ESCC细胞的快速增殖又需要足够的营养及氧气,这就意味着ESCC细胞经常需要承受严重缺氧及代谢压力,而自噬的活跃可以为癌细胞提供能量,降解细胞内毒性成分,维持癌细胞的代谢平衡,从而阻止癌细胞的凋亡及坏死发生[14]。因此,ULK1在食管癌组织中的表达显著高于癌旁组织可能与上述机制有关。但本研究结果还显示,与无淋巴结转移患者相比,ESCC发生淋巴结转移时的ULK1表达反而是降低的,即ULK1低表达的ESCC患者生存期显著低于高表达者,我们推测可能与在ESCC不同分期阶段,自噬发挥着不同作用有关,但具体机制有待进一步的深入研究。
发现和验证各种新的用于肿瘤早期诊断、预后和个性化治疗的分子生物标志物,已成为近年来肿瘤领域的研究热点。本研究结果显示ULK1在ESCC癌组织中的表达明显高于癌旁组织,ULK1表达水平与患者淋巴转移情况和生存期相关,并且ULK1高表达的ESCC患者拥有更长的生存期,提示ULK1可能是ESCC潜在的分子标志物。但正如前述,自噬在肿瘤的发展过程中具有两种相反的作用,ULK1的高表达并不一定意味着肿瘤的进行性恶性发展,ULK1在ESCC发生发展中的确切机制仍有待于进一步的研究。
