单采后造血干细胞CD34+百分率受冻存前放置时间影响的分析
2018-12-28宋腾飞
宋腾飞
外周血造血干细胞移植是目前治疗血液病、实体瘤及自身免疫病的有效方法之一, 采集物中造血干/祖细胞的数量对移植的成功有着直接的影响, 关于外周血造血干细胞采集的时机有不同的标准。临床多以骨髓恢复期外周血白细胞数>5×109/L为开始采集标准, 也有以CD34+细胞绝对数为判断标准[1-3]。采集采用COBM Spectra型血细胞分离机, 血液流经COBM Spectra型血细胞分离机离心槽袋后, 在一定离心力的作用下, 通过设定一定的离心参数, 离心平衡后各种血细胞按一定的层次分布在离心容器内, 在不破坏这种平衡的条件下, 通过调整收集界面的位置, 相对准确的将单个核细胞层(MNCs)收集入采血袋, 采集袋采用的是ACD-A抗凝,抗凝剂 :血细胞为 1∶12[4]。
1 资料与方法
1.1 一般资料 选取2015年3月~2018年6月在本院进行外周血造血干细胞移植的33例(96次采集数据)患者作为研究对象, 由于CD34+百分率比较低, 根据患者病种不同及动员效果不同采用了13例患者(37次采集)的数据进行分析,37次采集CD34+百分率范围为0.30%~1.77%, 平均0.636%。对单采后的血细胞分别进行采集后0、24、48、72 h、>72 h的台盼蓝拒染率及CD34+百分率的检测分析。
1.2 仪器 台盼蓝染液(Beyotime的C0011系列)、BD FACS Calibur流式细胞仪、BD CD34-PE抗体、BD CD45-FITC BD Mouse IgG1-PE BD FACS Lysing solution。
1.3 方法
1.3.1 台盼蓝操作原理及方法 利用正常的健康细胞能够排斥台盼蓝, 而丧失细胞膜完整性的细胞可以被台盼蓝染色研制而成。严格来说, 台盼蓝染色检测的是细胞膜的完整性,通常认为细胞膜丧失完整性, 即可认为细胞已经死亡。吸取100 μl重悬的细胞到以塑料离心管内, 加入100 μl台盼蓝染液, 轻轻混匀, 染色3 min, 吸取少量经过染色的细胞, 用血细胞技术板计数, 计数至少500个细胞。台盼蓝拒染率=蓝色细胞数/细胞总数×100%。细胞存活率=(细胞总数-蓝色细胞数)/细胞总数×100%。
1.3.2 CD34+百分率检测 采用ISHAGH设门检测方法:利用PBS将细胞调整到2×1010/L, 准备100 ml稀释标本待测,取2个试管分别标记阴性管、试验管, 分别加入CD45/IgG CD45/CD34, 每管内加入50 μl稀释后的标本, 轻轻混匀, 4℃下避光放置30 min, 每管内加入10倍稀释的1 ml红细胞溶解液混匀避光10 min, 300 g离心5 min, 弃上清, 加入500 μl PBS, 悬浮细胞上机检测, 分析软件选用BD CELLQuestTM软件。设门方法见图1。
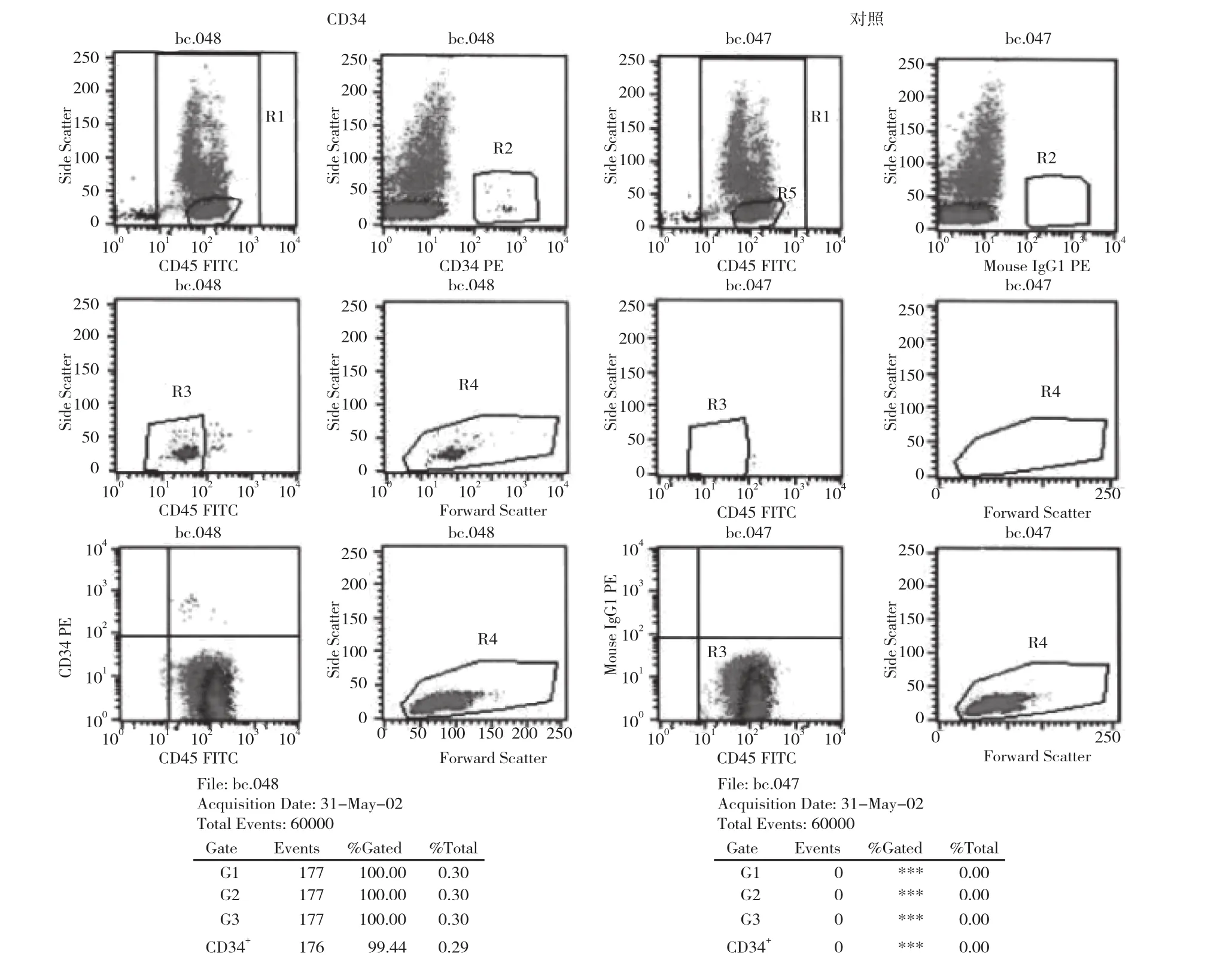
2 结果
台盼蓝拒染率随着时间的推移呈上升趋势, 在72 h内较稳定, >72 h下降明显, ISHAGH设门方法检测CD34+百分率呈逐渐下降趋势, 下降不明显, >72 h下降明显, 由此可见单采后动员的细胞尽量在24 h内冻存处理, 最长不要超过72 h。见表1。
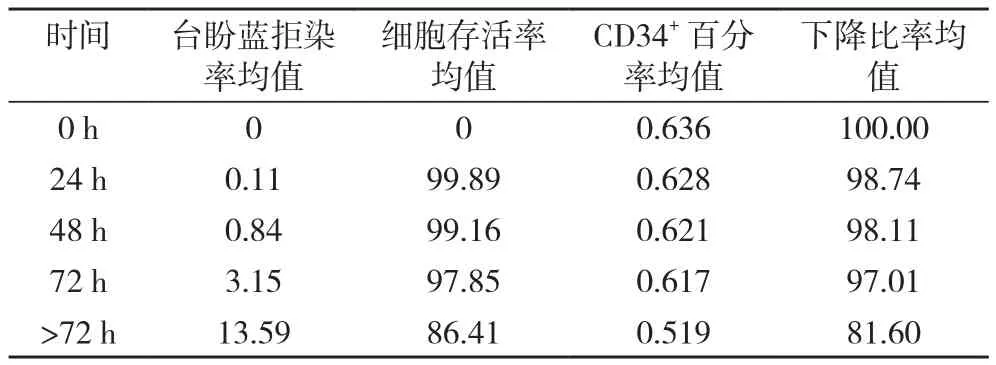
表1 不同的放置时间对CD34+率的影响(%)
3 小结
相关文献认为粒单系祖细胞(CFU-GM)和祖细胞(BFU-E)在 24、48、72 h后下降率为90.0%、72.00%、68.00%[4], 而CFU-GM产率与CD34+成正相关[5], 本次实验与造血干采集物CD34+检测相关报道相符[6], 支持4℃保存造血干细胞只适合于72 h内移植用。
