硫酸盐热化学还原生成H2S实验研究
2018-12-27罗建军马强林日亿
罗建军 马强 林日亿
1.重庆盎瑞悦科技有限公司 2.中国石油大学(华东)储运与建筑工程学院
注气热采作为一种行之有效的稠油开采方式,通过向地层注入高温高压蒸汽达到开采稠油的目的。一方面,由于热量传递加热稠油,以增强稠油的流动性,达到开采的目的[1-3];另一方面,当高温高压蒸汽注入地层,会诱发一系列化学反应,进而生成H2S和CO2等酸性气体[4-6]。H2S具有很强的毒性和化学活性,对作业人员的生命安全以及开发运输储藏器具带来很大的威胁[7]。因此,H2S的生成与预防在油气田开发过程中备受关注。
Orr[8]通过研究发现,高温条件下原油及烃类气体等有机物质可能参与硫酸盐热化学还原(thermochemical sulfate reduction,以下简称TSR)反应,生成少量 H2S、轻烃气体、硫的有机聚合物和CO2,而H2S和硫的有机聚合物会进一步参与TSR反应,成为TSR反应中主要反应部分。Manzano等[9]提出,在TSR反应过程中,参与反应的有机物类型有链烷烃、环烷烃和芳香烃等。通过分析研究发现,3类物质中最容易进行TSR反应的是链烷烃,其次是环烷烃和芳烃。
水的存在不仅是TSR进行的前提,也是反应产物,不过TSR过程中水的产量一直充满争议。Worden等[10]通过氧同位素分析法对岩层的物质研究发现,TSR反应过程生成了水。而Machel等[11]的研究发现,加拿大某酸性气田的储层流体中所含的NaCl质量分数与初始质量分数基本相同,从而推测出TSR反应过程中并没有产生太多的水。因此,还需要开展大量的研究,对TSR反应过程中是否产生大量水进行论证。
朱光有等[12]总结了中国含H2S天然气的地球化学特征、形成条件及分布特征等,认为H2S是由于TSR反应的结果,H2S的体积分数与石膏层的分布具有密切的关系。TSR反应机理最早由Orr等[13]提出,SO42-离子和气体烃类在较高的温度下发生TSR反应,生成H2S,主要反应见式(1)~式(2):
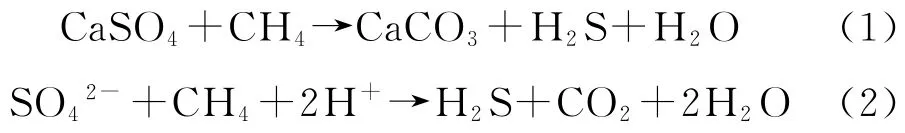
1982年,戴金星[14]认为,硫酸盐与烃类等有机物在高温高压条件下发生氧化还原反应,生成大量H2S,主要反应见式(3)~式(4):
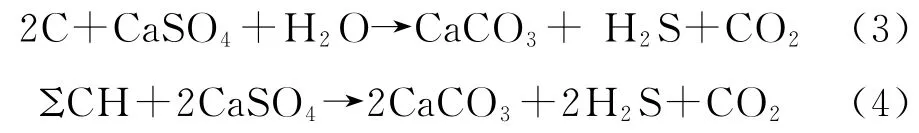
式中,C为有机物中的碳,ΣCH为碳氢化合物。
1991年,Anderson[15]根据硫酸盐含量较高的地层水与来自储层的甲烷气体的高温反应,得到式(5)和式(6)。式中,Me为二价金属离子。
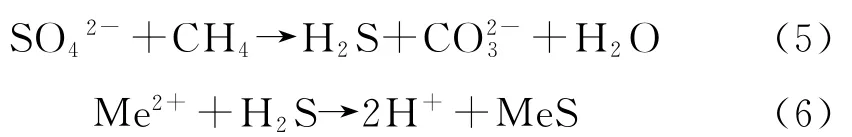
1996年,Worden和Smalley[16]通过研究碳酸盐油气藏中生成H2S的化学反应,并结合标志元素硫、碳的同位素数据,烃类与CaSO4的反应方程见式(7)~式(9):

根据以上学者提出的TSR反应方程,可以总结出TSR反应的一般形式,见式(10):硫酸盐+烃类→
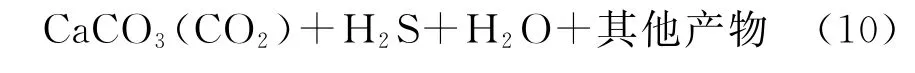
近几年来,也有相关研究者提出关于非气态烃的TSR反应方程,其合理性有待考究。
2008年,丁康乐等[17]根据正庚烷与6种硫酸盐反应体系的反应产物分析,推测TSR反应过程中包括以下步骤:

从调研文献来看,国内外目前对稠油热采过程中H2S生成领域的研究主要针对生成机理和反应物,对硫酸盐溶解度影响的研究较少。此外,水对TSR反应的作用尚不清楚。因此,本研究开展了不同硫酸盐的TSR实验研究,以了解硫酸盐对H2S产生的影响。
1 实验部分
1.1 试剂与仪器
实验药品:实验用水为去离子水,p H值为7.0,离子组成仅为H+和OH-;载气为高纯度氮气(纯度99.999%);六水合氯化铝、氯化钠、无水硫酸钙、无水硫酸镁、十八水合硫酸铝、硫酸钠等分析纯以及质量分数为38%的盐酸。
实验仪器:H2S检测仪:PN-2000在线式H2S检测仪;反应釜:江苏海安石油科技耐高温高压抗腐蚀不锈钢反应釜;p H计:上海雷磁PHBJ-260便携式p H计。
1.2 实验方法
实验系统如图1所示。实验步骤如下:
(1)将稠油、水和金属盐按预设配比装入石英管内,然后密封在耐高温、高压的反应釜中。向反应釜内反复充入1.20 MPa的高纯氮气,维持反应釜内为高压状态,并排除反应釜内的空气。同时,用外接在反应釜出口的压力表对反应釜内的压力进行在线检测,使压力保持在0.60 MPa,检查反应釜的气密性。
(2)按照预定的温度和反应时间在管式加热炉中对反应釜进行恒温加热,每隔一段时间对实验状况进行检查。
(3)反应结束后,先将反应釜冷却至室温,以保证反应釜内无蒸汽对结果和实验设备造成影响,在排气的同时,利用在线H2S检测仪测定H2S体积分数,将气袋收集的气体进行色谱分析,得到反应后气体组成。

2 结果与讨论
2.1 水对TSR反应生成H2 S的影响
目前,对于水是否是TSR反应生成H2S的必要条件存在较大的争议。本实验中采用无水硫酸钙(CaSO4,硬石膏)作为研究对象,在有水和无水参与的条件下,分别与正己烷和正辛烷反应,测定生成H2S的体积分数,明确水在TSR过程中的作用。
实验中硫酸钙用量为1.0 g,正己烷和正辛烷用量为2.0 g,反应温度280℃,载气压力0.6 MPa,实验结束后检测到的H2S体积分数如表1所示。
由表1中的实验结果可知,在没有水参与时,CaSO4、正己烷和正辛烷均不产生H2S;当水的质量为1 g时,反应72 h产生H2S体积分数小于水量为10 g时的反应生成量。因此,可以证明,水是TSR生成H2S的必要条件,也就是说,在TSR反应过程中,溶解状态的硫酸盐才具有反应性。

表1 水在TSR反应中的作用Table 1 Action of water in TSR reaction
另一方面,表1中数据显示,在相同条件下,正辛烷参与反应时生成的H2S体积分数大于正己烷参与反应时生成的H2S体积分数,表明长链烷烃稳定性低于短链烷烃,更容易发生TSR反应生成H2S。
2.2 硫酸盐溶解度对TSR反应生成H2 S的影响
由2.1节的实验结果表明,只有溶解的硫酸盐才能发生TSR反应生成H2S,故硫酸盐的溶解度势必会影响TSR反应。
降低溶液p H值或在溶液体系中加入低含量的NaCl,均能提高CaSO4在水中的溶解度,且在一定的NaCl含量范围内,加入NaCl越多,CaSO4溶解度越大[18-19]。因此,选择盐酸和NaCl调节CaSO4的溶解度,以探究硫酸盐溶解度对TSR反应生成H2S的影响。
反应条件:反应时间72 h,反应温度280℃,载气压力0.6 MPa,正辛烷2.0 g,硫酸盐1.0 g,水10.0 g,实验结果如表2所示。
实验结果表明,随着加入NaCl含量的增加和p H值的降低,亦即CaSO4的溶解度升高,TSR反应生成的H2S体积分数增大。TSR反应受到硫酸盐溶解度的影响,溶解度越高,反应速率越快。然而,虽然Na2SO4溶解度比CaSO4大得多,但Na2SO4实验组无H2S生成,也就是说未发生TSR反应。这说明虽然TSR反应受到硫酸盐溶解度的影响,但溶解度不是决定TSR反应是否发生的唯一条件,TSR反应的启动还受到硫酸盐种类(金属阳离子)的影响。

表2 溶解度对TSR反应的影响Table 2 Effect of solubility on the TSR reaction
2.3硫酸盐种类对TSR反应生成H2 S的影响
前文提到,TSR反应的启动不仅受到硫酸盐溶解度的影响,还受到硫酸盐种类的影响。因此,选择CaSO4、Na2SO4、MgSO4(泻盐)和 Al2(SO4)3这几种不同的硫酸盐,研究硫酸盐种类对TSR反应的影响。
反应条件:反应时间72 h,反应温度280℃,载气压力 0.6 MPa,正 辛 烷 2.0 g,CaSO4、Na2SO4、MgSO4、Al2(SO4)3各1.0 g,去离子水10.0 g,实验结果如表3所示。

表3 硫酸盐种类对TSR反应的影响Table 3 Effect of sulfate type on the TSR reaction
由表3可知,不同的硫酸盐发生TSR反应生成H2S的能力不同,归结起来原因有以下两点:
(1)不同硫酸盐溶解度不同,溶解度越大的硫酸盐生成的H2S越多,但Na2SO4这类不能启动TSR反应的硫酸盐除外。比如常温下易溶于水的MgSO4和Al2(SO4)3通过TSR反应生成H2S的体积分数分别为微溶于水的CaSO4的1.6倍和5.5倍。
(2)游离态的SO2-4离子结构为对称的正四面体,电荷中心位于质点中心,结构稳定,不易被破坏(O-S键不易断裂),因而难以启动TSR反应。Amrani等[20]的研究表明,离子的接触离子对(Contact ion-pair,简称CIP)相对于游离的更容易引发TSR反应。在硫酸盐接触离子对结构中,阳离子(Mg2+、Ca2+、Al3+)接近于带负电的,由于异性电荷间的静电作用离子的正四面体结构发生偏变形,电荷中心发生偏移,远离阳离子端的电子云密度降低,O-S键键能降低,更容易断裂,从而启动TSR反应。
为了验证阳离子电荷数对TSR反应生成H2S的影响,在不同的硫酸盐-正辛烷反应体系中加入一定量的AlCl3,测定其H2S生成量,如表4所示。
反应条件:反应时间72 h,反应温度280℃,载气压力0.6 MPa,正辛烷2.0 g,CaSO4、Na2SO4、MgSO4各1.0 g,去离子水10.0 g。

表4 AlCl3对TSR反应的影响Table 4 Effect of AlCl3 on the TSR reaction
表4中数据显示,在不同硫酸盐-正辛烷反应体系中加入AlCl3后,TSR反应生成的H2S体积分数均有所增加,且AlCl3质量分数越高,增加量越大。虽然在反应体系中加入AlCl3后,反应体系p H值降低也可能是促进TSR反应生成H2S体积分数升高的原因之一。但是,考察Na2SO4正辛烷反应组(第1、4、7实验组),未加入AlCl3时(第1实验组),不产生H2S,加入一定质量分数的AlCl3后(第4、7实验组),引发了TSR反应,生成了 H2S,充分说明反应体系中加入AlCl3促进TSR反应,不仅是因为AlCl3降低了反应体系的p H值,还因为Al3+的加入使与Al3+形成接触离子对,电子云偏移增大,从而降低了结构的稳定性,使得启动TSR反应的能垒降低,TSR反应速率增加,生成了更多H2S。
3 结论
(1)验证了水是TSR反应发生的必要条件,在无水条件下 ,CaSO4不能引发TSR反应生成H2S。
(2)硫酸盐的水溶性是发生TSR反应的重要影响因素,对于能够启动TSR反应的硫酸盐,其溶解度越高,TSR反应速率越快,生成H2S越多。
(3)水溶性硫酸盐金属阳离子的电荷数决定了硫酸盐溶液中是否能形成接触离子对,进而影响TSR反应的难易程度。电荷数越高,TSR反应越容易发生。因此,含有Al3+的硫酸盐溶液体系比含有Mg2+、Ca2+的硫酸盐溶液体系更容易发生TSR反应生成H2S。
