盐胁迫对彩叶草种子萌发、光合特性、叶绿素荧光及无机离子代谢的影响
2018-12-27刘真华曹灿景
刘真华,曹灿景
(1.山东农业工程学院,山东 济南 250100;2.山东工艺美术学院,山东 济南 250014)
盐胁迫对植物的生长发育有显著的抑制作用,不仅能够影响种子的发芽率、出苗率[1]、光合速率和生物膜透性,还能够引起细胞代谢紊乱、离子失调、单盐毒害[2]、破坏活性氧清除系统和植物体内脱落酸(ABA)[3]、赤霉素(GA)和细胞分裂素(CTK)等激素的一系列变化。另外,长期的盐胁迫会使非盐生植物因能量代谢失调致使组织和细胞死亡。随着我国园林绿化事业的发展和市民城市宜居观念的增强,提高城市的绿化质量并丰富其绿化景观已成为人们的共同期望。彩叶草[Coleusscutellarioides(L.) Benth.]因其色彩鲜艳、观赏期长等特点对扮靓城市景观、弥补冬季花色单调具有独特作用,在园林绿化方面具有广阔的应用前景。盐胁迫对植物生长发育有严重的影响,而目前对彩叶草的研究主要集中在无土栽培[4]、低温胁迫[5]、分子调控[6]、株型矮化[7]、重金属胁迫[8]等方面,而有关彩叶草在盐胁迫方面的研究报道则不多见。因此,本研究从彩叶草的种子萌发、光合特性、叶绿素荧光和无机离子代谢4个方面入手,探究彩叶草对NaCl胁迫的响应,旨在揭示其种子萌发、光合作用等指标与盐胁迫之间的关系,为彩叶草的耐盐机理、品种优化、栽培管理及园林绿化应用提供理论依据。
1 材料与方法
1.1 试验材料与试验设计
彩叶草的种子由山东农业工程学院园林科学与工程学院实验站提供。
1.1.1 种子萌发试验设计
2016年7月22日上午9:00,选取大小一致的饱满的种子,用0.1%的HgCl溶液表面消毒5min,蒸馏水冲洗后播种到培养皿中,培养皿内垫2层灭菌纱布,每皿50粒。用浓度分别为0mmol/L、20mmol/L、60mmol/L、100mmol/L、140mmol/L和180mmol/L的NaCl溶液浸种,每天更换1次NaCl溶液以降低水分蒸发造成的HgCl的浓度变动幅度,每水平设3次重复。浸种后放置于培养箱中催芽,温度白天22-25℃,夜间17-19℃,记录每天的发芽情况,并于2016年7月29日(第8d)测定并计算胚根长度、发芽率、发芽势、发芽指数和活力指数,取平均值。发芽率(%)=种子发芽粒数/种子播种粒数×100;发芽势(%)=8d发芽种子总数/种子播种粒数×100;发芽指数(GI)=∑Gt/Dt(Gt为t时间种子发芽数,Dt为对应的发芽天数);活力指数(VI)=GI×S(S为胚根长)。
1.1.2 水培试验设计
试验于2016年8-9月在山东农业工程学院的试验站智能温室中进行。8月2日进行穴盘播种育苗,9月8日选取长势一致、无病虫的幼苗移栽到规格为490mm×335mm×160mm的塑料箱中。其具体操作为用刀片剪切厚度2cm的泡沫板,使其恰好能够覆盖住塑料箱的开口,在泡沫板上打4个孔,其直径约1.5cm,将彩叶草的幼苗定植于泡沫板孔内,塑料箱中添加21L含NaCl浓度分别为0mmol/L、20mmol/L、60mmol/L、100mmol/L、140mmol/L和180mmol/L的Hoagland营养液,彩叶草的根系浸入营养液中进行盐胁迫处理,每处理3箱。盐胁迫10d后对彩叶草幼苗各指标进行测定。
1.2 测定指标及方法
采用CIRAS-2便携式光合仪(美国PP systems公司)测定彩叶草幼苗叶片光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),每处理重复3次。测定时CO2浓度370±10mmol/L,光照强度为800±10Lx,温度30±2℃。采用德国WALZ公司生产的PAM-2100便携式调制荧光仪测定彩叶草叶片初始荧光(Fo)、最大荧光(Fm)、光系统Ⅱ的潜在活性(Fv/Fo)和最大光化学效率(Fv/Fm),其计算公式为:Fv/Fo=(Fm-Fo)/Fo;Fv/Fm=(Fm-Fo)/Fm。采用硫酸-高氯酸消煮法处理材料,利用原子吸收光谱仪测定叶片Na+、K+和Mg2+含量。
1.3 数据处理与分析
使用Microsoft Excel 2003软件对数据图表进行处理,采用DPS 7.02软件进行单因素方差分析,并对平均数做Tukey法多重比较。
2 结果与分析
2.1 盐胁迫对彩叶草种子萌发的影响
不同浓度NaCl胁迫对彩叶草种子萌发的影响结果见表1。

表1 不同浓度NaCl胁迫对彩叶草种子萌发的影响
注:同列数据后不同小写或大写字母表示5%或1%显著水平,下同。
由表1可知,不同NaCl浓度对彩叶草种子萌发影响程度不同,不同处理间差异显著。随着NaCl浓度的升高(0-180mmol/L),彩叶草种子的发芽率、发芽势和发芽指数均呈现逐渐降低的趋势;NaCl浓度20mmol/L时上述指标与对照差异不明显,说明低浓度的盐胁迫对彩叶草种子的发芽率、发芽势和发芽指数影响较小;NaCl浓度在60-180mmol/L范围内,上述指标与对照差异显著且盐胁迫程度随NaCl浓度的增加而加剧,NaCl浓度180mmol/L时较对照分别降低56.73%(发芽率)、87.37%(发芽势)和84.81%(发芽指数)。低盐胁迫条件下(NaCl 20mmol/L),彩叶草的胚根长和活力指数高于对照,较对照分别增加11.88%和9.67%;而在NaCl浓度60-180mmol/L胁迫下,其胚根长受到明显抑制,活力指数显著降低,较对照分别降低9.90%-27.72%(胚根长)和9.67%-89.09%(活力指数)。
2.2 盐胁迫对彩叶草光合特性的影响
不同浓度NaCl盐胁迫对彩叶草光合特性影响结果见图1。由图1可知,(1)随着盐胁迫强度的增加,彩叶草净光合速率呈现逐渐降低的趋势(图1-a)。在20mmol/L NaCl胁迫下,彩叶草净光合速率虽然低于对照,但降幅较小,二者差异不显著;其他处理与对照差异显著。除20mmol/L NaCl处理与60mmol/L NaCl处理、140mmol/L NaCl与180mmol/L NaCl处理差异不显著外,其他处理间均差异显著。180mmol/L NaCl胁迫下,彩叶草净光合速率最小,较对照降低48.08%。(2)盐胁迫处理下,彩叶草气孔导度均低于对照,且随胁迫强度的增加呈现降低趋势(图1-b),较对照分别降低5.21%、20.85%、28.85%、41.77%和49.36%。除20mmol/L NaCl处理外,其他处理与对照差异显著,说明盐浓度较低时对彩叶草气孔导度限制较小,而盐浓度较高时对彩叶草气孔导度影响较大。(3)彩叶草叶片胞间CO2浓度随NaCl浓度的增加表现出先下降后上升的趋势(图1-c)。NaCl浓度20mmol/L彩叶草叶片胞间CO2浓度低于对照,较对照降低10.20%,继续增加NaCl浓度至60mmol/L时胞间CO2浓度开始高于对照,至NaCl浓度180mmol/L时胞间CO2浓度达最大值,较对照增加34.87%,与对照差异极显著。除60mmol/L NaCl处理外,各处理与对照差异显著。(4)与对照相比,各盐胁迫处理均使彩叶草蒸腾速率降低,并随盐浓度的增加呈现出逐渐降低的趋势(图1-d),且这一趋势与气孔导度呈现出正相关关系。NaCl浓度20mmol/L蒸腾速率与对照差异不明显,其他处理与之相反。
2.3 盐胁迫对彩叶草叶绿素荧光参数的影响
不同浓度NaCl盐胁迫对彩叶草叶绿素荧光参数的影响结果见图2。

图1不同浓度NaCl胁迫对彩叶草光合特性的影响
Fig.1 Effects of NaCl stress on photosynthetic characteristics ofColeusscutellarioides
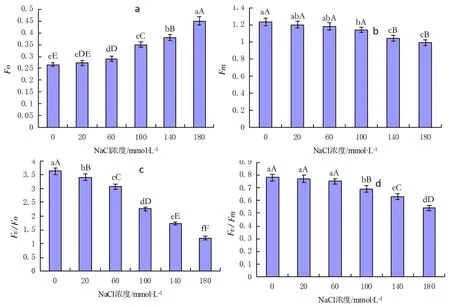
图2 不同浓度NaCl胁迫对彩叶草叶绿素荧光参数的影响
由图2可以看出,NaCl处理下Fo均高于对照,且Fo随NaCl胁迫强度的增加呈现上升趋势(图2-a)。低盐(NaCl 20mmol/L)胁迫下,Fo虽高于对照,但二者差异不显著,说明低盐胁迫对彩叶草叶绿素的影响较小;随着NaCl浓度(60-180mmol/L)的升高,Fo逐渐增大,且NaCl浓度180mmol/L时与对照差异极显著,这表明高盐胁迫对光系统Ⅱ反应中心(PSⅡ)造成伤害或不可逆失活。Fm为暗适应下最大荧光产量,能够反映PSⅡ的电子传递情况(图2-b)。由图2-b可知,NaCl处理下Fm均低于对照,Fm随NaCl胁迫强度的增加呈现下降趋势,这说明彩叶草叶片PSⅡ的电子传递能力随NaCl胁迫程度的增强逐渐降低。但在浓度为20mmol/L 、60mmol/L和100mmol/L NaCl处理下,Fm与对照差异不显著;而140mmol/L和180 mmol/LNaCl处理下,Fm与对照差异显著。另外,Fm与Fo表现出负相关关系。NaCl处理下彩叶草Fv/Fo和Fv/Fm值均低于对照(图2-c、图2-d),且随NaCl胁迫强度的增加呈现下降趋势,表明NaCl胁迫程度的加强能够降低彩叶草PSII的原初光能转化效率和PSII的反应中心的潜在活性,使彩叶草生长所需的化学能减少。另外,Fv/Fo、Fv/Fm、Fm与NaCl浓度呈现负相关关系,而Fo表现出正相关关系。
2.4 盐胁迫对彩叶草无机离子含量的影响
不同浓度NaCl盐胁迫对彩叶草叶片中无机离子含量的影响结果见表2。

表2 不同浓度NaCl胁迫对彩叶草无机离子含量的影响
由表2可知,彩叶草叶片Na+含量随NaCl浓度(0-180mmol/L)的升高呈现逐渐升高的趋势。其中,NaCl浓度20mmol/L、60mmol/L、100mmol/L、140mmol/L和180mmol/L处理其叶片Na+含量较对照分别增加44.88%、77.84%、118.18%、153.98%和175.57%,差异十分显著。彩叶草叶片K+含量、K+/Na+和Mg2+/Na+随NaCl浓度(0-180mmol/L)的升高呈现逐渐降低的趋势。除180mmol/L NaCl外,其他处理叶片K+含量与对照差异不显著;各处理K+/Na+和Mg2+/Na+较对照差异显著。彩叶草叶片Mg2+含量随NaCl浓度(0-180mmol/L)的升高呈现先升高后降低的趋势。其中,除NaCl浓度140mmol/L1和180mmol/L处理外,其他处理与对照差异不显著。另外,由表2还可以看出,彩叶草叶片Na+含量与NaCl胁迫强度呈正相关关系,而K+、K+/Na+和Mg2+/Na+与之呈负相关关系。
3 结论与讨论
通过室内培养和无土栽培试验,设置0mmol/L、20mmol/L、60mmol/L、100mmol/L、140mmol/L和180mmol/L 6个NaCl水平,研究不同胁迫强度的NaCl对彩叶草种子萌发、光合特性、叶绿素荧光和无机离子代谢的影响。结果表明,随着NaCl浓度(0-180mmol/L)的增加,彩叶草种子的发芽率、发芽势和发芽指数逐渐降低;其胚根长和活力指数呈现先上升后下降的趋势。在NaCl浓度0-180mmoL/L范围内,彩叶草叶片的净光合速率、气孔导度和蒸腾速率随NaCl胁迫强度的增加呈降低趋势,至NaCl浓度180mmol/L时较对照分别降低48.08%(Pn)、49.36%(Ci)和73.51%(Tr);而叶片胞间CO2浓度则表现出先下降后上升的趋势,NaCl浓度20mmol/L最低,较对照降低10.20%,NaCl浓度180mmol/L时达最大值,较对照增加34.87%。在NaCl浓度0-180mmol/L范围内,Fm、Fv/Fo、Fv/Fm、K+含量、K+/Na+和Mg2+/Na+随NaCl浓度的增加呈下降趋势,Fo与Na+含量趋势与之相反;Mg2+含量呈现先升高后降低的趋势;NaCl浓度20mmol/L 时,Fv/Fo、Fv/Fm、Fm与对照差异不显著。Fo、Na+含量与NaCl胁迫强度呈正相关关系,而Fv/Fo、Fv/Fm、Fm、K+含量、K+/Na+和Mg2+/Na+与之呈负相关关系。
在浓度20mmol/LNaCl处理下,彩叶草的净光合速率均低于对照,而此时气孔导度和胞间CO2浓度亦低于对照,这说明引起净光合速率下降的主要因素应该是气孔限制,因为低浓度的NaCl胁迫对植物细胞产生渗透胁迫,致使气孔关闭,增加了外界CO2气体通过气孔向细胞内扩散的阻力,造成光合作用的底物减少,最终导致光合速率的下降,这与Mlrales F等[9]在大麦(HordeumvulgareL.)上的研究结果类似。在NaCl浓度60-180mmol/L胁迫处理下,彩叶草光合速率均低于对照,此时气孔导度随胁迫强度的增加呈现降低趋势,而胞间CO2浓度表现出与之相反的趋势,且明显高于对照,这说明此时光合速率下降的主要因子应该是非气孔限制,这可能是较强的盐胁迫导致细胞中积累了大量的盐离子,对叶绿体结构造成损伤,使光合色素发生降解,叶绿体精细结构遭到破坏,叶肉细胞光合性能降低[10-11]。张芬等[12]研究认为,NaCl浓度50mmol/L时番茄(Solanumsalicina)幼苗净光合速率高于对照,而本试验结果得出20-60mmol/L范围内彩叶草叶片净光合速率呈降低趋势且低于对照,可能与不同植物耐盐性存在差异有关。
Fo为初始荧光,是光系统II反应中心(PSII)处于完全开放时的荧光水平,主要与叶绿素浓度有关。本试验条件下,彩叶草叶片的Fo随NaCl浓度增加而逐渐升高,这可能是因为天线色素(LHC)与PSII分离造成其不可逆升高或者是PSII受到破坏[13-14],因此,Fm在NaCl胁迫下逐渐降低,这可能是因为盐胁迫对彩叶草叶片产生了光抑制[15]。本试验结果表明,彩叶草Fv/Fo和Fv/Fm均随NaCl胁迫强度的增加而逐渐降低,说明彩叶草PSII反应中心的实际光能捕获效率逐渐降低,所捕获的用于光化学反应的光能逐渐减少[16]。
植物根系和茎部的耐盐力较强,但是高盐条件下的毒性效应和渗透效应改变了植株的营养平衡[17],叶片则会因盐分积累过快、过多导致毒害或死亡[18],为此本试验重点研究了叶片中矿质元素的变化情况。K+是重要的渗透调节物质,当植物遭受盐胁迫时体内的K+含量随之发生变化。本试验结果表明,彩叶草叶片中K+含量随NaCl胁迫的增强逐渐呈降低趋势,且与细胞中Na+含量呈负相关关系,这应该是细胞中较高的Na+抑制植物细胞通过低亲和系统吸收K+所致[19]。本试验中,NaCl浓度在0-60mmol/L范围内,彩叶草细胞内Mg2+含量随NaCl浓度的升高而增加,这可能是低浓度胁迫下植物细胞可通过积累Mg2+等渗透调节物质来应对渗透胁迫等次生伤害;而NaCl浓度在100-180mmol/L范围内,彩叶草细胞Mg2+呈下降趋势,这可能是因为细胞内积累的较高的Na+对Mg2+的吸收产生拮抗作用,破坏了细胞内原有的离子平衡[20]。盐胁迫对植物产生的另一类盐害是次生盐害,即由离子间的竞争导致的植物体内某种元素的缺乏,并对植物的新陈代谢造成干扰[21]。盐胁迫条件下,Na+会与其它矿物质元素竞争吸收,致使植物对某些元素的产生亏缺[22]。本试验条件下,随着盐胁迫强度的增加,K+/Na+和Mg2+/Na+逐渐降低,这表明除了NaCl产生的渗透胁迫打乱了植物体细胞内的离子动态平衡之外,还有彩叶草根系表面的K+、Mg2+被Na+置换,从而抑制了其对K+、Mg2+的吸收的原因。
