高盐对血管内皮生长因子受体-3+巨噬细胞表型及功能的影响
2018-12-27余芳芳杨国红李铭陶燕燕王秀娟牛秀珑李玉明赵季红
余芳芳,杨国红,李铭,陶燕燕,王秀娟,牛秀珑,李玉明,赵季红
血管内皮生长因子受体-3(vascular endothelial growth factor receptor-3,VEGFR-3)阳性单核巨噬细胞是一群具有潜在淋巴管内皮细胞转化功能的特殊细胞群,其在一定条件下可迁移到组织中,分泌血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C),并能转化为淋巴管内皮细胞而促进淋巴管的生成[1]。前期研究发现,长期的高盐刺激可以通过张力应答性增强子结合蛋白(tonicityresponsive enhancer binding protein,TonEBP)/VEGFC/VEGFR-3信号通路引起自发性高血压大鼠(spontaneously hypertensive rats,SHR)心肌间质淋巴管的增生,通过上调VEGF-C的表达在促进淋巴管明显增生的同时,可使SHR血压水平及左心室重塑程度得以改善[2]。而VEGFR-3+单核巨噬细胞是否参与了淋巴管生成的病理生理过程,目前尚不清楚。本研究利用流式分选技术将RAW264.7巨噬细胞中VEGFR-3+亚群分选出来,观察高盐刺激对VEGFR-3+单核巨噬细胞的表型、淋巴管内皮细胞特性及功能的影响,为进一步探讨VEGFR-3+单核巨噬细胞亚群在高盐诱导的高血压靶器官损伤中的作用提供参考。
1 资料与方法
1.1 一般资料 小鼠RAW264.7巨噬细胞株由本实验室提供;胎牛血清(FBS)、高糖培养基(DMEM)购自Gibco公司;Flt-4荧光标记的山羊抗小鼠VEGFR-3(VEGF-R3/Flt-4)抗体购自R&D Systems公司;TRIzol购自TAKARA公司;Transcriptor First Strand cDNA Synthesis Kit、SYBR Green实时定量PCR试剂购自Roche公司;CCK-8购自碧云天公司;ABI 7300荧光定量PCR仪(美国Applied Biosystems公司);流式细胞仪Cytomics FC 500和BD FACSAriaTMⅢ(Beckman Coulter公司);Transwell购自 Costar公司;EZCellTMPhagocytosis Assay Kit购自Bio Vision公司;酶标仪购自BIO-RAD公司。
1.2 方法
1.2.1 流式细胞分选VEGFR-3+巨噬细胞 将RAW264.7细胞置于含有10%FBS的高糖DMEM培养液中,5%CO2、37℃条件下,取对数生长期细胞用于实验。计数后取1.0×107个细胞离心(1 000 r/min,5 min)弃上清,加1 mL磷酸盐缓冲液(PBS)洗涤 2次;弃上清,分别加入VEGFR-3抗体75 μL,Staining Buffer 50 μL,PBS 70 μL,避光孵育 15 min,随后以1.3 mL细胞染色缓冲液重悬细胞,上机检测。根据表达的VEGFR-3的荧光强度不同可以将RAW264.7细胞分为两群,应用Flow Jo 7.6.1软件对流式数据进行分析,见图1。
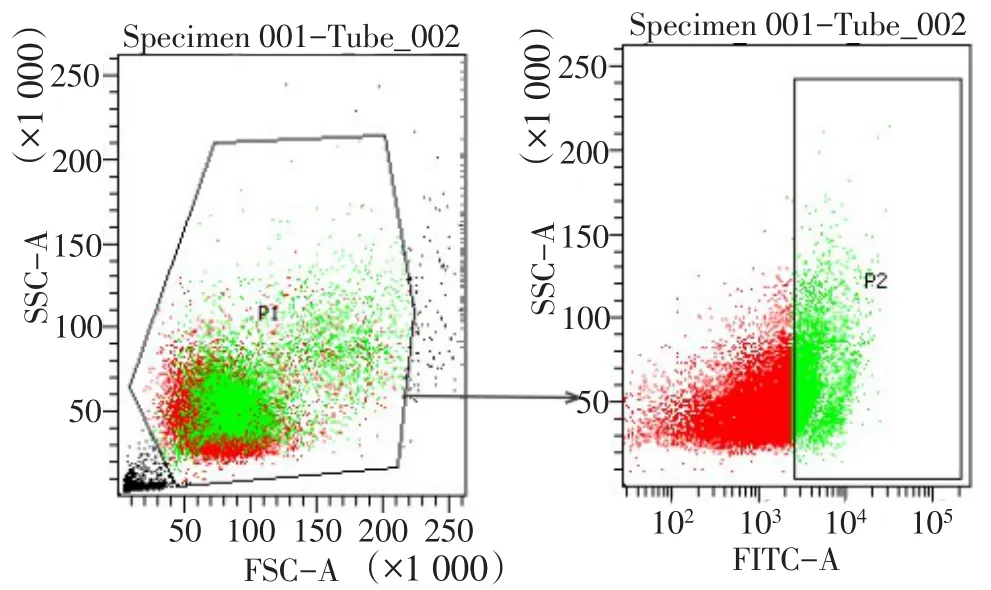
Fig.1 The gating strategy used for analysis of the VEGFR-3+macrophages图1 VEGFR-3+巨噬细胞流式细胞分选的设门方法
1.2.2 Real-time PCR 将VEGFR-3+巨噬细胞按照每皿1.0×106浓度接种于10 cm培养皿中,培养3 h待细胞贴壁。分别设溶剂对照组(Control组),高盐(high salt,HS,40 mmol NaCl)组,低盐(low salt,LS,20 mmol NaCl)组,培养24 h,收取细胞后按照TRIzol说明书提取各组细胞总RNA,用反转录试剂盒反转录为cDNA,Real-time PCR检测相关基因的mRNA表达水平。Real-time PCR反应条件:50℃2 min;95℃10 min;95 ℃ 15 s,60 ℃ 1 min,30个循环。设3复孔,重复3次。2-ΔΔCt方法计算目的基因的相对表达情况:ΔΔCt=实验组(Ct目的基因-Ct内参基因)-对照组(Ct目的基因-Ct内参基因)。检测所用引物见表1。
1.2.3 CCK-8检测细胞活性 将对数生长期的VEGFR-3+巨噬细胞接种于96孔板(100 μL/孔,约5×103个细胞)按1.2.2中分组方法,每组设5复孔,重复3次。待细胞贴壁后,继续培养24、48 h后,弃培养基,加入CCK-8溶液(10 μL/孔),孵育2~4 h后,使用酶标仪在450 nm处测定光密度(OD)值,细胞活力计算公式:细胞活力(%)=(加药细胞OD-空白OD)/(对照细胞OD-空白OD)×100%。
1.2.4 Transwell检测细胞迁移能力 选用8 μm孔径的迁移小室,下室加入含10%血清的完全培养基600 μL,上室加200 μL(1×105个)无血清重悬的对数生长期细胞,按1.2.2中分组方法,置于37℃、5%CO2培养箱中分别培养24、48 h。将小室取出,观察下室壁细胞数≥10个贴壁、伸展细胞,用蘸湿的棉签将小室上表面细胞轻轻擦拭干净后,在无水乙醇中固定10 min,0.4%台盼蓝染色30 min,1×PBS清洗。显微镜下对聚碳酸酯膜下表面的细胞进行计数。随机读取5个视野,计数每个视野细胞数目。
1.2.5 流式细胞术检测细胞吞噬能力 将对数生长期VEGFR-3+巨噬细胞接种于12孔板,按1.2.2中分组方法,待细胞干预至22 h和46 h,将细胞消化、离心,弃上清;每孔加入200 μL培养基,5 μL绿色酵母多糖(Green Zymosan)重悬,孵育2 h;再次离心、重悬,加入300 μL与干预时相同药物浓度的吞噬作用测定缓冲液清洗3次,加入缓冲液1 mL上机。实验重复3次。

Tab.1 The specific primer sequences of mononuclear macrophage in Real-time PCR表1 单核巨噬细胞Real-time PCR引物序列
1.3 统计学方法 使用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(one way ANOVA),组间多重比较使用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 高盐对VEGFR-3+巨噬细胞表型及淋巴管内皮细胞特性的影响 与Control组相比,LS组、HS组的M1型巨噬细胞标志物TNF-α、CCL2、IL-1β mRNA表达水平显著上调,代表M2型巨噬细胞标志物的Ym1、IL-10、Arg-1 mRNA表达水平减低(P<0.05);与Control组相比,HS、LS组的淋巴管标志物TonEBP、VEGF-C mRNA 表达水平上调(P<0.05),Prox-1、LYVE-1、Podoplanin mRNA表达水平下调(P<0.05)。与LS组相比,HS组的M1型巨噬细胞标志物TNF-α、IL-1β mRNA表达水平显著上调(P<0.05),HS组的淋巴管标志物 VEGF-C、TonEBP mRNA表达水平上调(P<0.05)。高盐刺激下VEGFR-3+巨噬细胞表现出促淋巴管内皮细胞生成的特性,但并未表现出淋巴管内皮细胞的特性,见表2。
2.2 高盐刺激对VEGFR-3+巨噬细胞的活性的影响 与Control组、LS组相比,干预24、48 h,HS组的VEGFR-3+巨噬细胞的活性明显降低(P<0.05),见表3。
2.3 高盐对VEGFR-3+巨噬细胞的迁移功能的影响 与Control组相比,干预24 h后,LS组、HS组VEGFR-3+巨噬细胞迁移能力均增强(P<0.05);与Control组相比,干预48 h后,HS组VEGFR-3+巨噬细胞迁移能力明显增强(P<0.05);LS组与HS组相比差异无统计学意义,见图2,表4。
Fig.2 ThemigrationabilityofdifferentgroupsbyTranswellassay(×200)图2 Transwell实验检测各干预组细胞的迁移能力(×200)
Tab.2 The comparison of 24 h mRNA expression levels between three groups表2 各组细胞24 h mRNA表达水平的比较结果 (n=3,±s)
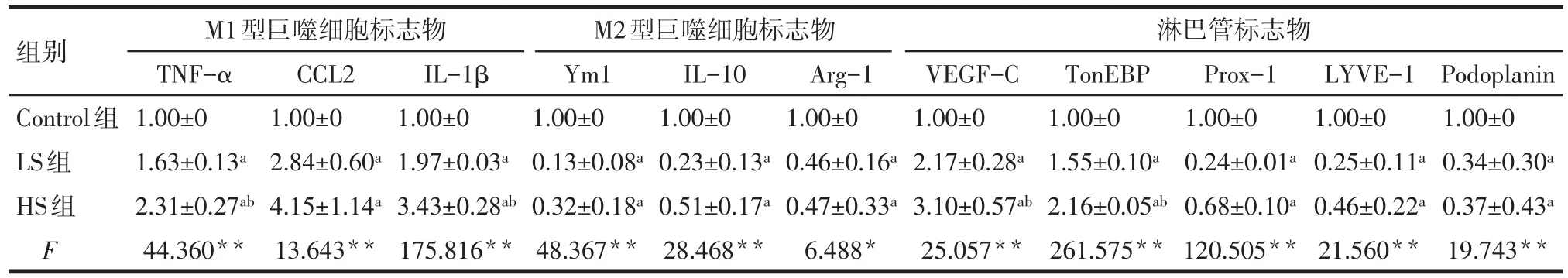
Tab.2 The comparison of 24 h mRNA expression levels between three groups表2 各组细胞24 h mRNA表达水平的比较结果 (n=3,±s)
*P<0.05,**P<0.01;a与Control组比较,b与LS组比较,P<0.05
组别Control组LS组HS组F淋巴管标志物M1型巨噬细胞标志物TNF-α 1.00±0 1.63±0.13a 2.31±0.27ab 44.360**CCL2 1.00±0 2.84±0.60a 4.15±1.14a 13.643**IL-1β 1.00±0 1.97±0.03a 3.43±0.28ab 175.816**M2型巨噬细胞标志物Ym1 1.00±0 0.13±0.08a 0.32±0.18a 48.367**IL-10 1.00±0 0.23±0.13a 0.51±0.17a 28.468**Arg-1 1.00±0 0.46±0.16a 0.47±0.33a 6.488*VEGF-C 1.00±0 2.17±0.28a 3.10±0.57ab 25.057**TonEBP 1.00±0 1.55±0.10a 2.16±0.05ab 261.575**Prox-1 1.00±0 0.24±0.01a 0.68±0.10a 120.505**LYVE-1 1.00±0 0.25±0.11a 0.46±0.22a 21.560**Podoplanin 1.00±0 0.34±0.30a 0.37±0.43a 19.743**
Tab.3 Comparison of the viability of VEGFR-3+cells between three groups表3 各组VEGFR-3+细胞的活性比较结果 (n=5,±s)

Tab.3 Comparison of the viability of VEGFR-3+cells between three groups表3 各组VEGFR-3+细胞的活性比较结果 (n=5,±s)
**P<0.01;a与Control组比较,b与LS组比较,P<0.05
组别Control组LS组HS组F 24 h 1.00±0 0.93±0.19 0.65±0.07ab 12.976**48 h 1.00±0 0.71±0.05a 0.56±0.08ab 83.838**
Tab.4 The migration ability of different groups by Transwell assay表4 Transwell检测各干预组细胞的迁移能力(n=3,±s)
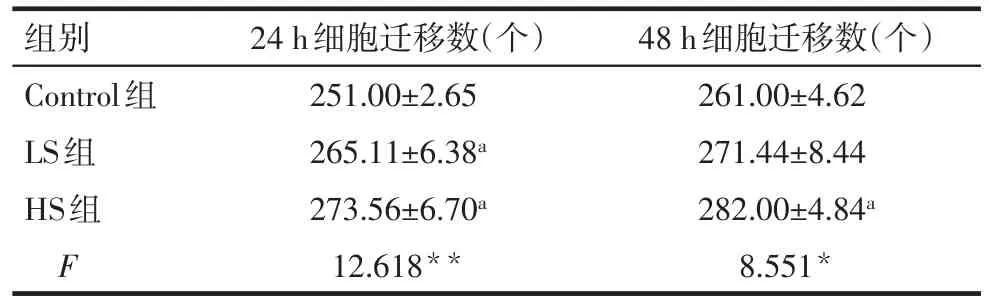
Tab.4 The migration ability of different groups by Transwell assay表4 Transwell检测各干预组细胞的迁移能力(n=3,±s)
*P<0.05,**P<0.01;a与Control组比较,P<0.05
组别Control组LS组HS组F 24 h细胞迁移数(个)251.00±2.65 265.11±6.38a 273.56±6.70a 12.618**48 h细胞迁移数(个)261.00±4.62 271.44±8.44 282.00±4.84a 8.551*
2.4 高盐刺激对VEGFR-3+巨噬细胞吞噬能力的影响 与Control组相比,干预24、48 h后,HS组细胞的吞噬能力增强(P<0.05);与LS组相比,干预24、48 h,HS组细胞的吞噬能力增强(P<0.05),见图3,表5。
Tab.5 The phagocytosis ability of different groups by flow cytometry表5 流式细胞仪检测各干预组细胞的吞噬能力(n=5,%,±s)
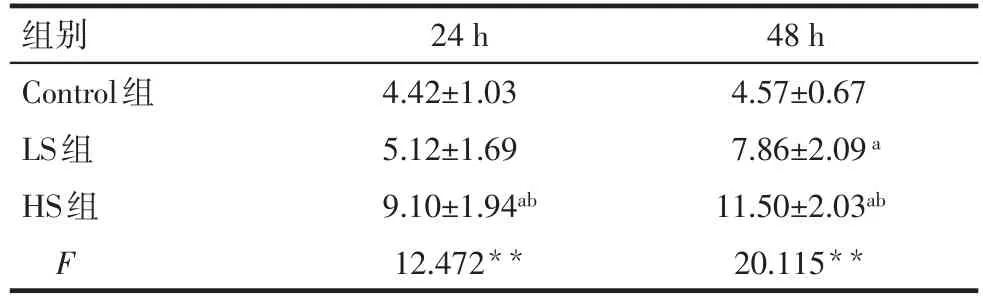
Tab.5 The phagocytosis ability of different groups by flow cytometry表5 流式细胞仪检测各干预组细胞的吞噬能力(n=5,%,±s)
**P<0.01;a与Control组比较;b与LS组比较,P<0.05
组别Control组LS组HS组F 24 h 4.42±1.03 5.12±1.69 9.10±1.94ab 12.472**48 h 4.57±0.67 7.86±2.09a 11.50±2.03ab 20.115**
3 讨论
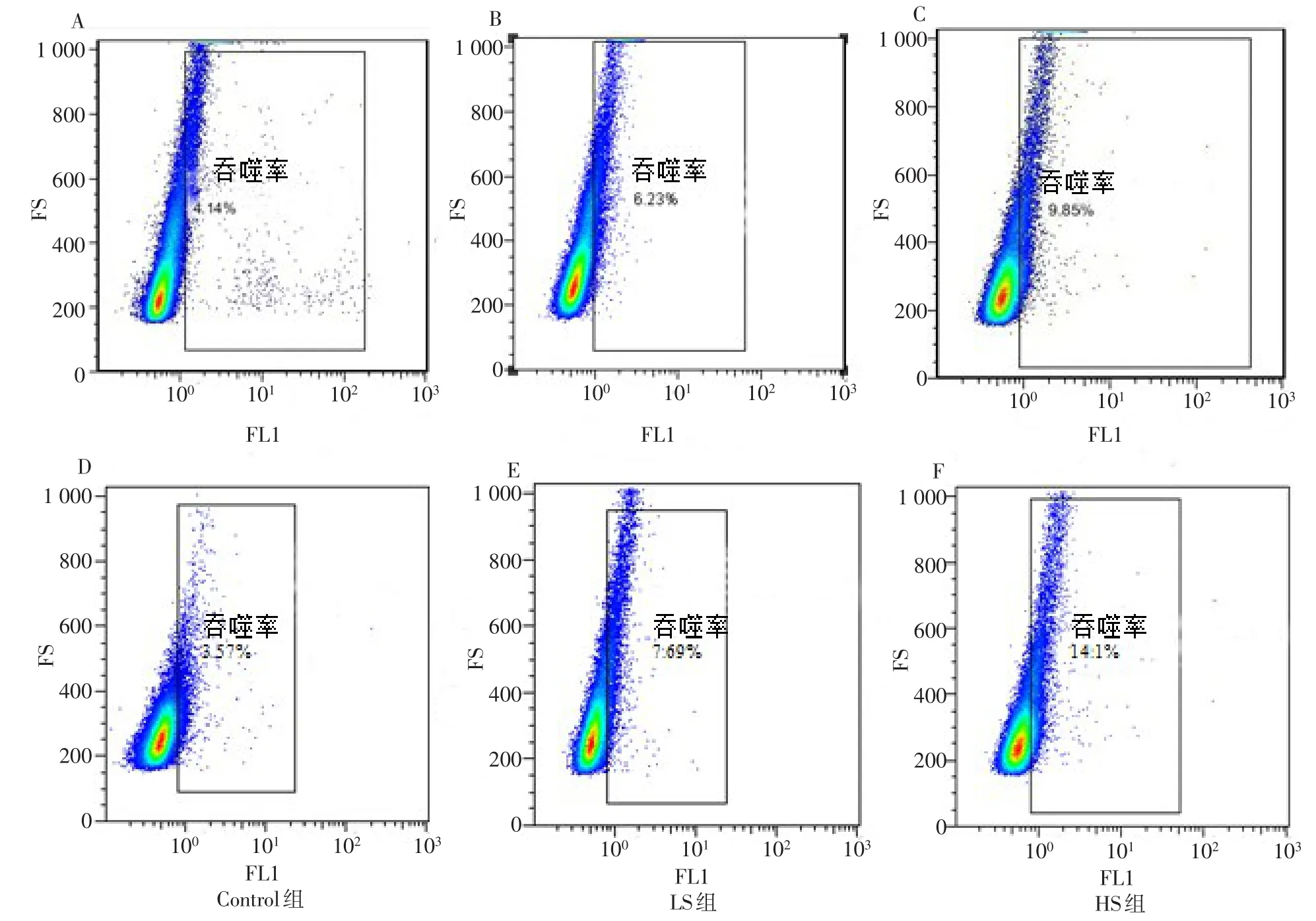
Fig.3 The phagocytosis ability of different groups by flow cytometry图3 流式细胞仪检测各干预组细胞的吞噬能力(n=5)
单核巨噬细胞主要来源于骨髓、外周血以及组织中。大量研究证实,单核巨噬细胞在表型和功能上存在异质性[3]。根据状态功能不同巨噬细胞激活后分化为经典激活的巨噬细胞(classically activated macrophage,caMφ/M1型)及替代性激活的巨噬细胞(alternatively activated macrophage,aaMφ/M2 型)[4]。M1型巨噬细胞具有极强的抗原呈递、促进炎症反应的能力并产生大量炎性因子;M2型巨噬细胞具有抑制炎症、改善组织修复进程的能力[5-6]。前期研究显示,不同的单核细胞亚群其生理功能及病理作用存在差异,其中高盐摄入能够引起人外周血中间型单核细胞CD14+CD16+亚群数量及比例增加并伴随炎症相关因子表达上调、靶器官损伤[7-8]。本研究发现,VEGFR-3+巨噬细胞在高盐刺激后向M1型巨噬细胞表型转化,M2型巨噬细胞标志物基因表达水平减低,提示短期的高盐刺激使VEGFR-3+巨噬细胞介导炎症反应的功能增强。
近年来有研究发现,单核细胞具有多向分化潜能,在不同的诱导因素作用下可分化为不同的细胞,如T淋巴细胞、血管内皮细胞等;炎症刺激下单核细胞有向淋巴管内皮细胞转分化的可能性[9]。研究表明,外周血中有一部分幼稚单核细胞构成性的表达VEGFR-3[1]。单核细胞能够在炎症刺激下分泌VEGF-C,其与VEGFR-3结合刺激淋巴管内皮细胞增殖、迁移并促进淋巴管增生;也可通过形成细胞聚集体嵌入淋巴管壁直接参与新淋巴管内皮细胞的生成,称为单核巨噬细胞的转分化作用[1,10]。本研究利用流式细胞术将VEGFR-3+巨噬细胞分选出来,给予高盐刺激后,发现其VEGF-C表达水平明显增高,提示该群单核巨噬细胞在短期高盐刺激下主要诱导淋巴管内皮细胞的增殖,与前述研究相一致,长期慢性高盐刺激是否会诱导该群细胞转分化为淋巴管内皮细胞,还需要进一步研究去证实。
由TonEBP诱导产生的VEGF-C是重要的促淋巴管生成因子。前期研究发现,长期的高盐摄入可引起小鼠心肌单核巨噬细胞浸润以及TonEBP/VEGF-C介导产生淋巴管,广泛增生的淋巴管系统能够调节高盐诱导的血压变化和水盐代谢的平衡[11-13]。本研究显示,短期的高盐刺激引起VEGFR-3+巨噬细胞TonEBP和VEGF-C表达水平的显著增加,与上述研究相一致;本研究结果提示在高盐刺激下TonEBP/VEGF-C/VEGFR-3通路的激活可能在VEGFR-3+巨噬细胞转分化作用中占有重要地位。
细胞的活性是其发挥免疫功能的基础。巨噬细胞内各种因子的表达水平或活性的改变影响细胞增殖、吞噬、迁移、分泌细胞因子和趋化因子的能力,从而调节其免疫功能[14]。高盐干预产生的高渗应激会引起细胞发生DNA断裂等损伤性改变以及渗透压保护性反应,这两条相对的细胞信号通路间的平衡决定了细胞存活或凋亡[15]。高盐产生的高渗状态下,细胞活力明显降低;盐浓度降低,细胞活力增强。
在各种组织损伤的情况下,巨噬细胞需要进行增殖并向损伤区迁移,对外来异物或死亡宿主细胞进行吞噬。活化的巨噬细胞分泌的因子能调动其他粒细胞和淋巴细胞,共同促进局部及全身的炎症反应,进而发挥抗原提呈的作用[16]。在参与机体炎症反应的过程中,巨噬细胞的迁移功能是实现其参与炎症反应的关键[17]。因此,高盐干预下,触发巨噬细胞释放大量的炎症因子,使其迁移细胞数量增多,迁移能力增强;吞噬率可直接反映其吞噬功能,高盐干预下,细胞的吞噬能力增强,而低盐状态下则减弱[18]。
总之,本研究表明高盐刺激使VEGFR-3+巨噬细胞向M1型巨噬细胞偏移,其吞噬及迁移能力明显增强,并具有促淋巴管内皮细胞增殖的特性,为进一步研究该亚群与淋巴管生成及心血管疾病的关系提供了依据。
