长期施肥对棕壤丛枝菌根真菌群落结构及其侵染的影响
2018-12-27郭静罗培宇杨劲峰李冬冬黄月玥韩晓日
郭静,罗培宇,杨劲峰,李冬冬,黄月玥,韩晓日
长期施肥对棕壤丛枝菌根真菌群落结构及其侵染的影响
郭静,罗培宇,杨劲峰,李冬冬,黄月玥,韩晓日
(沈阳农业大学土地与环境学院/土壤肥料资源高效利用国家工程实验室,沈阳 110866)
【目的】丛枝菌根(, AM)真菌有改善根际土壤环境、促进植物对养分的吸收、增强植物抗逆性和增加农作物产量等重要作用。本研究旨在探明长期施肥条件下玉米-大豆轮作棕壤丛枝菌根真菌群落结构、对玉米根系侵染的变化及其影响因素。【方法】以沈阳农业大学棕壤肥料长期定位试验(38年)耕层(0—20 cm)土壤为材料,于2016年6月选取其中6个施肥处理:(1)不施肥处理(CK);(2)单施化学氮肥(N);(3)施用化学氮磷肥(NP);(4)施用化学氮磷钾肥(NPK);(5)单施有机肥(M);(6)有机肥和化学氮磷肥配施(MNP),采用PCR-DGGE、克隆测序及台盼蓝染色法,分析土壤和玉米根系定殖的AM真菌群落结构及侵染率,并结合环境因素进行冗余分析和典型对应分析。【结果】施用有机肥处理土壤的碱解氮(AHN)、速效磷(AP)、速效钾(AK)、铵态氮(NH4+-N)、硝态氮(NO3--N)和可溶性有机碳(DOC)含量显著高于单施化肥和不施肥处理,且趋势为:有机肥处理>化肥处理>不施肥处理;与不施肥处理相比,单施化肥处理显著降低了土壤pH值,而施用有机肥处理显著提高了土壤pH值。通过PCR-DGGE及割胶测序,从土壤中得到AM真菌条带22条,根系AM真菌条带仅9条,共分离出13个OTU,从土壤样品中分离的AM真菌种群主要为球囊霉菌和巨孢囊霉属,而侵染玉米根系的AM真菌只有球囊霉菌。聚类分析表明长期不同施肥将棕壤中AM真菌分为了三大类群,分别为单施氮肥处理、施用有机肥处理和其他处理;根系AM真菌分为三大类群,第一类群NPK处理、第二类群为M处理和NP处理、第三类群为其他施肥处理。施用有机肥处理AM真菌的孢子密度显著高于单施化肥和不施肥处理,趋势为:有机肥处理﹥化肥处理﹥不施肥处理。各施肥处理AM真菌侵染率趋势为:NPK处理>施用有机肥处理>其他施肥处理。冗余分析结果表明棕壤AM真菌多样性与土壤理化性质无相关性,而孢子密度与土壤AHN、NH4+-N、AP、AK、DOC及土壤含水量呈显著正相关;侵染率与土壤NO3--N呈显著正相关;侵染率与孢子密度之间呈显著正相关;AM真菌的多样性与孢子密度和侵染率之间没有相关性。典型对应分析表明AHN、AK、DOC、 NH4+-N 对AM真菌的群落组成影响显著。【结论】长期施肥通过改变土壤理化性质,从而对棕壤AM真菌的群落结构产生了显著影响,进而对AM真菌的侵染产生影响。
丛枝菌根真菌;棕壤;长期施肥;群落结构;侵染率
0 引言
【研究意义】丛枝菌根(,AM)真菌是一类与土壤肥力和植物营养关系密切的重要微生物,它可与绝大多数植物根系形成共生关系[1−2],扩大宿主根系吸收范围和吸收表面积、促进宿主作物对土壤中矿质元素和水分的吸收[3−6]、改善植物水分代谢、增强植物抗逆性、提高作物产量和改善土壤理化性状[7]、对稳定生态系统、保持生态平衡和可持续发展,促进农、林、牧业生产具有不可替代的经济、社会和生态意义。【前人研究进展】然而,由于AM真菌物种多样性、对寄主作物的选择性和对土壤环境的适应性不同[8],利用AM 真菌促进植物在不同条件下定殖和生长需要考虑诸多因素的影响。有研究证实不同的土壤类型、植物类型、耕作制度、施肥措施等会对AM真菌多样性、孢子密度、侵染有显著的影响[9-13];但目前对AM真菌影响因素的研究结果并不一致,有研究表明长期施有机肥对AM真菌的多样性、侵染率和孢子密度有积极作用[14-15],但JONER[16]研究发现施有机肥反而会抑制AM真菌的生长,而贾锐等[17]发现AM真菌的侵染率与土壤理化性质无相关性。MUCHANE等[18]研究发现在土壤中施入可溶性磷肥能增加AM真菌的定殖,而秀彦华等[12]发现AM真菌的侵染率与土壤磷含量呈极显著负相关,以上现象可能是由于土壤类型、植物种类和施肥措施的不同引起的。【本研究切入点】鉴于AM真菌会受到多种因素的影响,而其对不同的土壤类型、农业措施的响应不尽相同。因此,探究不同条件对AM真菌的影响因素。【拟解决的关键问题】本研究在38年棕壤长期轮作施肥的基础上,分析棕壤AM真菌群落结构、根系AM真菌侵染及其影响因素,探究作物、土壤理化性质和AM真菌之间的相互作用,以期为棕壤地区合理利用AM 真菌资源提依据。
1 材料与方法
1.1 试验概况
供试土壤与植物样品采自沈阳农业大学棕壤肥料长期定位试验地(北纬40°48′,东经123°33′),该试验地始于1979年,到2016年已有38年历史,采用玉米-玉米-大豆轮作制度,2016年种植玉米。该试验地的基本概况见文献[19]。本试验选取其中6个施肥处理:(1)不施肥处理(CK);(2)单施化学氮肥(N);(3)施用化学氮磷肥(NP);(4)施用化学氮磷钾肥(NPK);(5)单施有机肥(M);(6)有机肥和化学氮磷肥配施(MNP)。所有肥料作为基肥在播前一次性施入,有机肥为猪厩肥,平均含有机质119.6 g·kg-1,全氮5.6 g·kg-1,P2O58.3 g·kg-1,K2O 10.9 g·kg-1;化学氮磷钾肥分别为尿素、过磷酸钙和硫酸钾,肥料具体施用量见文献[19]。
1.2 样品采集及处理
土壤和植物样品于2016年玉米苗期(6月6日)进行采集。各处理土壤采样选取12个点,采样深度为0—20 cm,每3个点充分混匀,剔除砾石、植物根系等杂物,过1 mm筛,一部分测定可溶性有机碳、铵态氮、硝态氮、土壤含水量及提取土壤总DNA;另一部分避光风干后保存,测定土壤pH、碱解氮、速效钾、速效磷及孢子密度。挖取4株完整的玉米根系,用大量自来水冲洗干净后再用灭菌的超纯水冲洗,将洗净的鲜根剪成1 cm长的根段,混匀提取DNA及测定侵染率。
1.3 测定方法
可溶性有机碳用K2SO4浸提法,即称取10 g鲜土加入50 mL 0.5 mol·L-1K2SO4溶液振荡1 h,然后在4 000×离心力下离心10 min,上清液用0.45 µm的滤膜过滤,滤液用Vario EL II 型TOC仪进行测定[20]。铵态氮和硝态氮的含量采用0.01 mol·L-1CaCl2浸提法,采用连续流动分析仪(AutoAnalyzer3,德国Seal公司)上机测定。pH、AP、AK、AHN、SM根据土壤农化分析所述方法测定[21]。AM真菌孢子密度采用湿筛倾析法,从20 g风干土壤中筛取孢子并进行孢子密度统计[22],侵染率采用台盼蓝染色-格子线法测定[23]。
土壤DNA采用Powersoil®DNA isolation kit试剂盒(MO BIO, Laboratories Inc,German)进行提取,植物DNA采用DNeasy®Plant Mini Kit试剂盒(Qiage,German)进行提取,提取完的DNA置于-20℃冰箱待用。
1.4 目的片段的扩增及DGGE电泳
AM真菌的目的序列扩增采用巢式PCR[24],第一轮反应体系为10×PCR Buffer(不含Mg2+)5 µL,dNTP 4 µL(2.5 mmol·L-1),MgCl23 µL(2.5 mmol·L-1),NS1(10 mmol·L-1)1.5 µL,NS41(10 mmol·L-1)1.5 µL,酶(2 U·µL-1)1 µL,DNA模板1 µL,加ddH2O至50 µL。第二轮反应体系与一轮相同。为了提高DGGE的分辨率,在第二轮PCR上游引物前加了个GC夹(CGCCCGCCGCGCCCCGCGCCCGTCCGCC GCCCCCGCCCG)。由于AM1和NS31不能扩增原囊霉科()和类球囊霉科()的AM真菌,因此添加了另一对引物ARCH1311和NS8来扩增原囊霉科和类球囊霉科。本研究中DGGE电泳所用的聚丙烯酰胺凝胶的浓度为6%,变性剂范围:30%—50%,电泳缓冲液:1×TAE,电泳电压:60 V,电泳时间:16 h。PCR具体条件如表1所示。
1.5 DGGE割胶回收测序
从DGGE图谱中切取清晰、具有代表性的条带,采用聚丙烯酰胺凝胶DNA回收试剂盒(北京康维)进行目的基因的回收。回收后的DNA用AM真菌的特异性引物NS31和AM1进行PCR扩增验证,然后交由北京鼎国昌盛生物技术有限责任公司进行克隆测序。

表1 AM真菌目的序列PCR反应条件
1.6 数据分析及处理
图表制作采用Microsoft Office Excel 2010;采用SPSS 19.00进行方差分析(最小显著差数法,LSD);冗余分析(Redundancy Analysis, RDA)及典型对应分析(Canonical Correlation Analysis, CCA)采用CANOCO 4.5软件;DGGE图谱分析采用Quantity one 4.6软件;DNA序列比对在Gen Bank 数据库的BLAST 程序中进行相似性搜索,查找与目的条带亲缘关系最近的序列,然后采用MEGA 6.0构建进化树。多样性指数采用Shannon-Wiener 指数()和均匀度指数()表示, Shannon指数()计算公式为=-∑(ln),均匀度指数()计算公式为=/ln。式中,表示第条带占所在泳道条带总光密度值的比例,表示每一条泳道AM真菌的条带数量。
2 结果
2.1 长期定位施肥对棕壤理化性质的影响
从表2可以看出,长期施肥显著改变了棕壤的理化性质,施肥处理土壤的AP、AHN、NO3--N、NH4+-N、DOC、SM均比不施肥对照显著增加,且趋势为:有机肥处理﹥化肥处理﹥CK;与其他处理相比,MNP处理土壤AHN、NO3--N、NH4+-N、AP、AK、DOC含量最高。M处理的土壤pH最高,为6.64;N处理的pH最低,为4.87;与不施肥处理相比,施用有机肥显著提高土壤pH,而化肥会使土壤pH降低,尤其是单施化学氮肥。
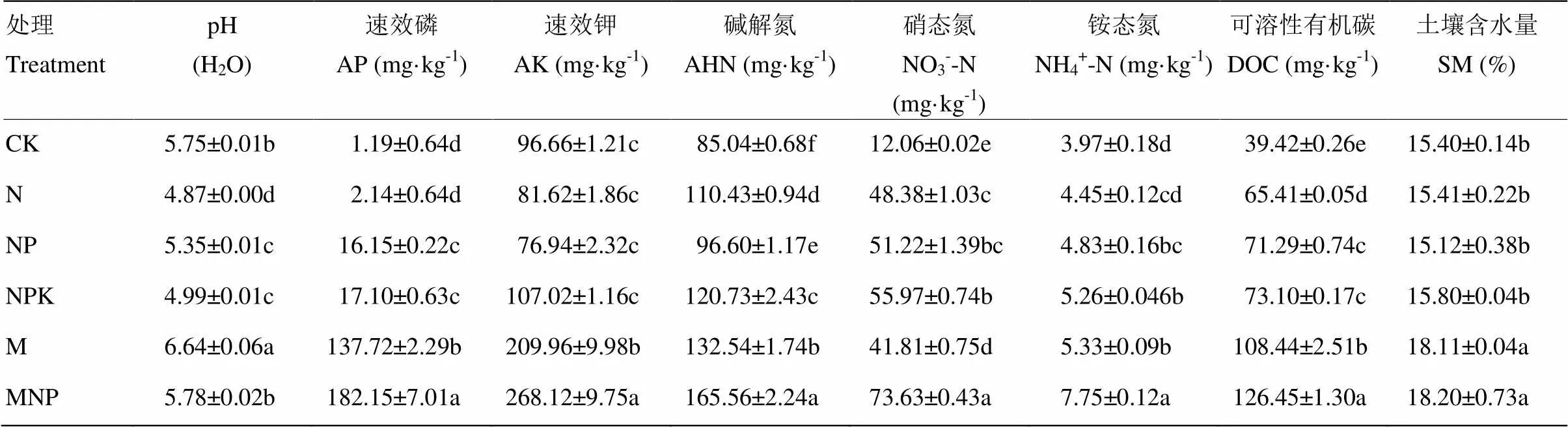
表2 供试土壤的理化性质
同一列数据后不同字母表示差异显著(LSD法,=0.05)。下同
Values followed by different letters in the same column are significantly different among the treatments ( LSD method, and= 0.05). The same as below
2.2 长期施肥对AM真菌群落结构的影响
如图1所示,NP处理的土壤AM真菌条带数最多(9条),CK、N处理和M处理条带数次之(7—8条),而NPK处理和MNP处理条带数最少(6条),说明施用化学钾肥及施用的含磷肥料不足或过多均会减少棕壤AM真菌的种类。band 16、band 17、band18、band 19和band 22是有机肥处理特有的条带,说明施用有机肥促进了这几种AM真菌的生长;band 20是所有施肥处理共有条带,说明施肥没有对此种AM真菌造成影响。
如图2所示,NP、NPK、M处理的根系AM真菌的条带数较多,而CK、N、MNP处理的条带数最少;根系band 8是所有处理共有的条带,没有受施肥的影响;根系band 5是MNP处理特有条带,说明有机肥与化学氮磷肥配施促进了该AM真菌的侵染。由图1和图2可以看出,从土壤中一共分离出来22条条带,而根际中分离出来的条带只有9条,说明只有部分AM 真菌能侵染玉米根系。
对土壤和根系AM真菌的DGGE图谱中优势条带进行割胶回收,经克隆测序后共获得31个序列,其中土壤AM真菌有22个序列,根系AM真菌有9个序列。通过GenBank数据库的BLAST 程序进行序列比对,寻找与其亲缘关系最为接近的物种构建进化树,结果如图3所示,sband 11、sband 15、sband 18、sband 19属于巨孢囊霉科(Uncultured),而其余条带均属于球囊霉,根系AM真菌均属于球囊霉,说明土壤中的AM真菌只有球囊霉侵染了玉米根系,而巨孢囊霉则未侵染玉米根系。
由表3可知,NP处理土壤中AM真菌的多样性指数显著高于其他处理,而NPK处理的多样性指数最低,说明化学磷肥的施用有利于提高土壤AM真菌的多样性,而化学钾肥的施用则降低了土壤AM真菌的多样性;另外MNP处理虽然未施入化学钾肥,但其AM真菌多样性指数与NPK处理无显著差异,而显著低于NP处理及M处理,这可能与MNP土壤磷水平过高有关。各处理间土壤AM真菌均匀度无显著差异,说明不同施肥对土壤AM真菌的均匀度没有影响。

图1 不同施肥处理土壤AM真菌的DGGE图谱

表3 不同施肥处理土壤AM真菌多样性指数
由表4可知,NP、NPK和M处理根系AM真菌多样性指数显著高于其他处理,说明不施用化学磷肥或有机肥与化学磷肥配施均可降低侵染玉米根系的AM真菌多样性;而CK、N处理根系AM真菌的均匀度均显著低于其他处理,说明土壤缺磷对侵染玉米根系的均匀度有负面影响。

图2 不同施肥处理根系AM真菌的DGGE图谱
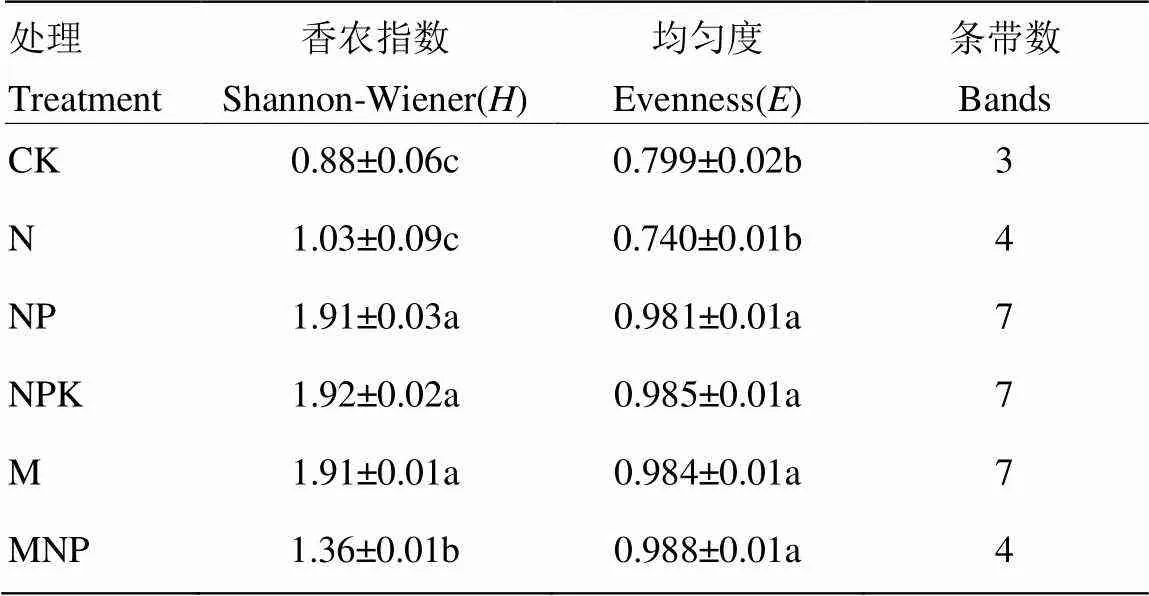
表4 不同施肥处理根系AM真菌多样性指数
2.3 长期施肥对AM真菌孢子密度及侵染率的影响
由图4可以看出,施用有机肥处理的孢子密度显著高于单施化肥处理和不施肥处理,且趋势为:有机肥处理>化肥处理>CK,其中MNP处理的孢子密度最多,为37.8个/g,而CK处理的孢子密度最少,为19.8个/g;施用化肥处理的孢子密度则介于它们两者之间,为26.2—35.6个/g。这表明施肥有利于AM真菌孢子的产生,其中有机肥的施用对土壤AM真菌产孢具有积极影响。
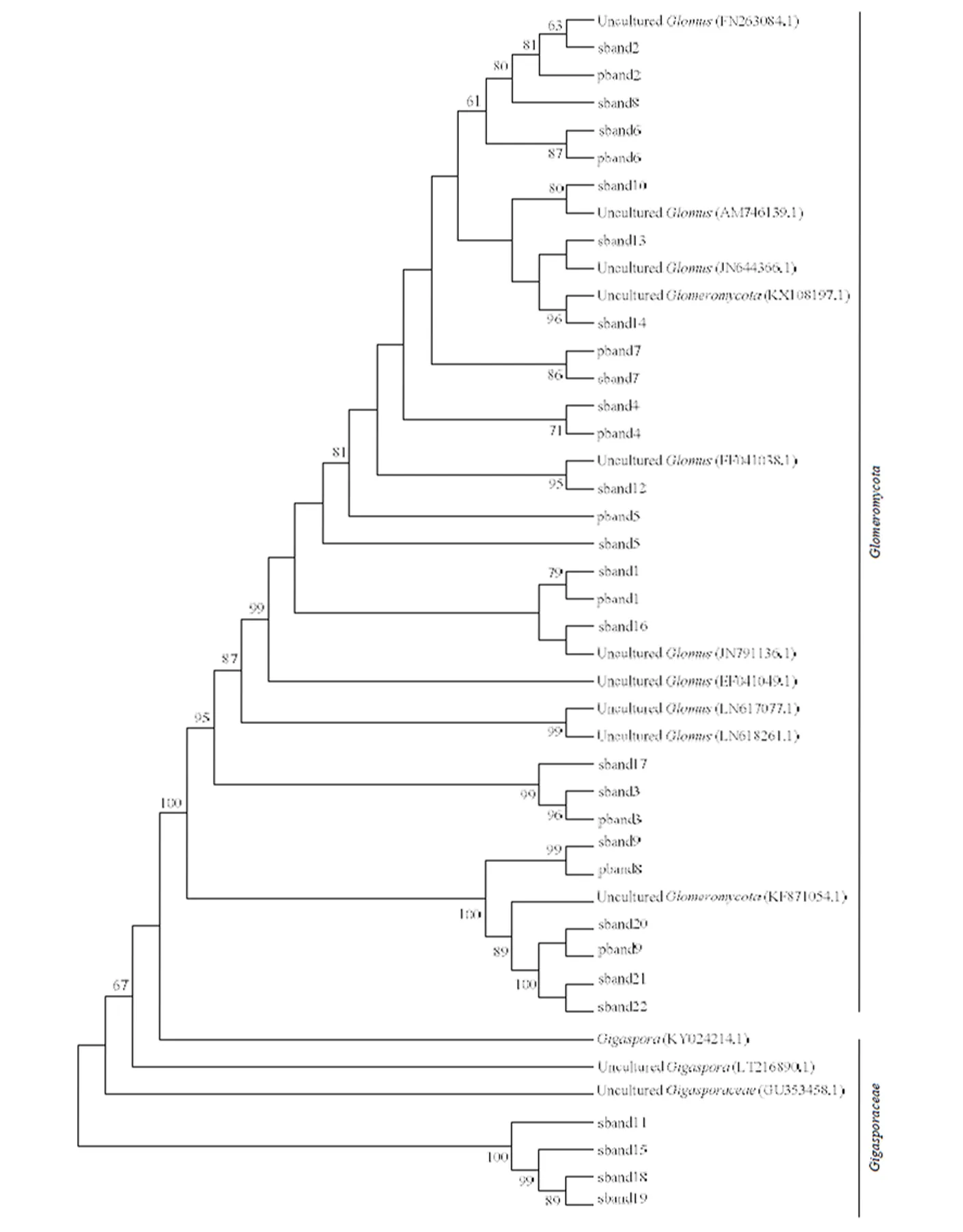
sband 和pband 分别代表土壤AM真菌条带和根系AM真菌条带,后面不同的数字表示DGGE图谱上所标条带。Sband and pband represent the bands of soil AM fungi and infected AM fungi respectively. Different numbers behind symbols represent different bands marked in figures of DGGE
由图5可以看出,施肥显著增加了AM真菌的侵染。施肥处理的AM真菌侵染率显著高于不施肥处理,其中NPK处理的侵染率最高,为25.77 %;NPK、M及MNP处理的侵染率显著高于其他施肥处理,说明施用含钾肥料能促进AM真菌对玉米根系的侵染,且化学钾肥效果优于有机肥。
2.4 长期施肥对AM真菌群落结构的影响
如图6所示,长期施肥将棕壤AM真菌分为三大类群,单施氮肥处理、施用有机肥处理和其他处理。其中,N处理和其他处理群落相似度仅为7%,说明长期单施化学氮肥极大地改变了棕壤AM真菌群落结构;施用有机肥处理与其他处理相似度为18%,说明长期施用有机肥对棕壤AM真菌群落结构也有较大影响;而CK处理与NPK、NP之间的相似度达到52%,说明化肥配施对土壤AM 真菌群落结构产生的影响较小。
由图7可知,长期施肥将根系AM真菌分为三大类群。NPK处理和其他施肥处理之间的相似度为66%,单独成为一个类群,说明施用化学钾肥对AM真菌侵染产生了较大影响;M处理与NP处理分为一个类群,而MNP处理、N处理与CK处理分为一个类群,说明土壤速效磷含量过高或过低均会对AM真菌侵染产生影响。
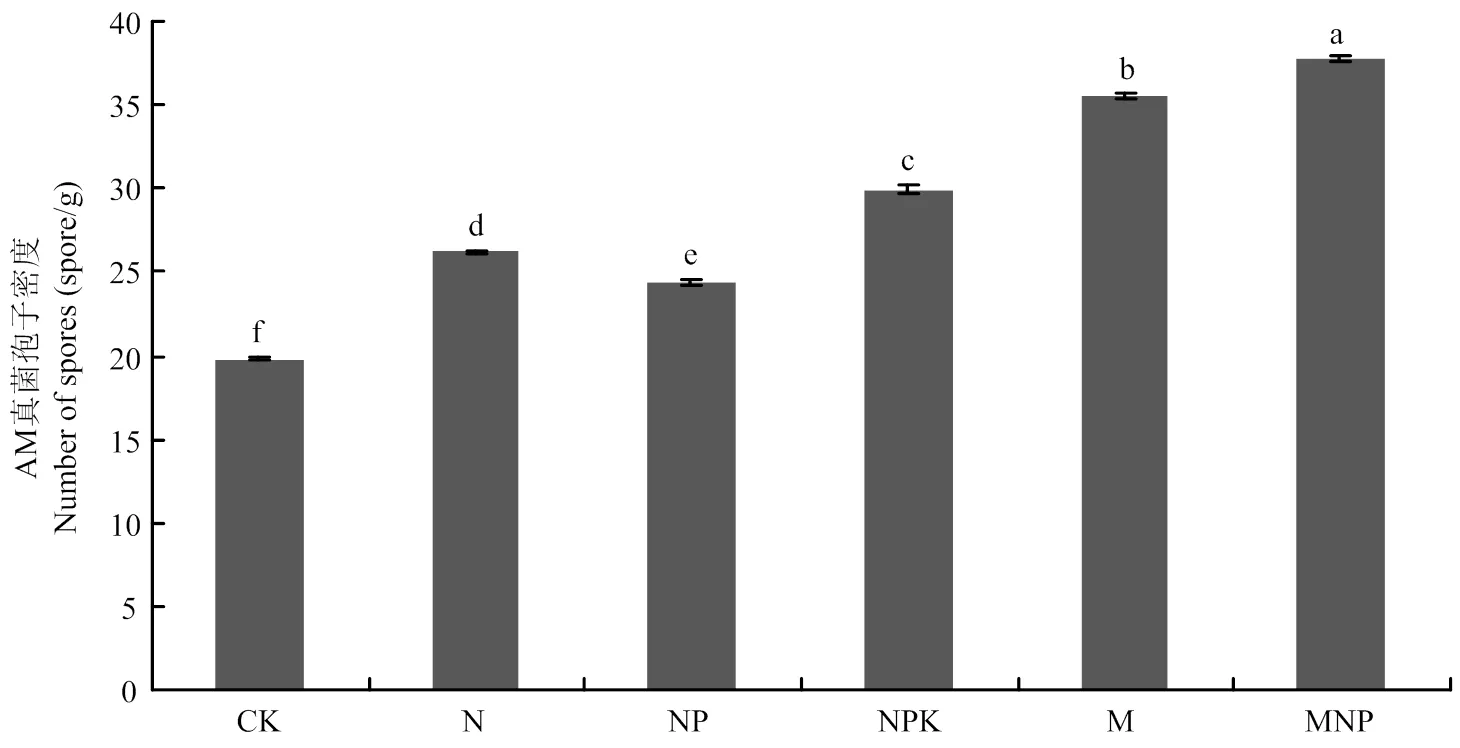
图4 不同施肥处理AM真菌的孢子密度

图5 不同施肥处理AM真菌的侵染率

图6 不同施肥处理土壤AM真菌 UPGMA聚类图谱

图7 不同施肥处理根系AM真菌 UPGMA聚类图谱
2.5 AM真菌群落结构影响因素
冗余分析结果表明(图8),长期定位施肥条件下,土壤及根系侵染的AM真菌多样性指数与土壤理化性质无相关性,而其孢子密度与AHN、NH4+-N、AP、AK、DOC、SM呈显著正相关,侵染率则与土壤中NO3--N呈显著正相关。侵染率与土壤AM真菌的孢子密度之间由典型对应分析可知,土壤中AHN、AK、DOC和NH4+-N是影响棕壤AM真菌群落结构的主要因素(图9),第一和第二排序轴解释了63.7%的变量(<0.05,通过蒙特卡罗检验)。其中band 5、band 10、band 16 、band 17、band 18、band 19和band 22所代表的AM真菌与土壤中AHN、AK、DOC和NH4+-N呈显著正相关;而band 1、band 2、band 3 、band 4、band 11、band 12、band 13、band 15和band 21所代表的AM真菌与AHN、AK、DOC和NH4+-N呈显著负相关,其余条带所代表的AM真菌则与土壤理化性质无相关性。
3 讨论
AM真菌作为自然生态系统的组成部分,能调节植物和土壤关系,在生态系统中有重要作用,因此,研究土壤及侵染的AM真菌群落结构及其影响因素具有现实意义。本研究中 AM真菌的DGGE图谱中大多数条带的迁移位置、数量和亮度在不同施肥处理间有差异,这说明长期不同施肥对棕壤AM真菌的生长产生了影响。其中施用化学钾肥及施用含磷肥料不足或过多均会降低土壤AM真菌的多样性,这与HARLEY等[25]的研究结果一致。值得注意的是,虽然NPK处理土壤AM真菌多样性指数最低,但其根系侵染的AM真菌多样性指数及侵染率均为最高,MNP、M处理次之,这可能是由于施用含钾肥料能促进AM真菌在作物根系的侵染[26],而施用化学钾肥相对于施用有机肥更有利于AM真菌的侵染。 CK、N处理和MNP处理根系AM真菌多样性指数均显著低于其他施肥处理,这可能是由于土壤磷水平过高或过低均会影响侵染玉米根系的AM真菌多样性。程俐陶等[27]研究发现AM真菌的侵染率在早春最低,随后开始上升,在夏秋季达到顶峰,本研究中各施肥处理AM真菌的侵染率均较低(4.02%—25.77%),这可能由于AM真菌在玉米苗期侵染能力还不强,会随着玉米生长逐渐升高,与程俐陶等研究结果类似。BHADALUNG等[28]对27年长期施肥处理的AM真菌多样性进行了调查,发现长期施肥会降低AM真菌的多样性,另一些研究表明AM真菌多样性与土壤速效磷呈正相关关系[29],而本研究中AM真菌多样性与土壤理化性质无相关性,这种差异可能是由于AM真菌对施肥条件、宿主植物和环境条件的选择性和适应能力不同,或进化过程中的历史原因,造成AM真菌对土壤理化性质的敏感性不同[30]。王茜等研究表明地表球囊霉、光壁无梗囊霉、单孢球囊霉、根内球囊霉以及土著AM真菌均能够成功侵染玉米根系[31],说明AM真菌对宿主作物之间没有明显的专一性。本研究土壤中分离的AM真菌主要为球囊霉菌和巨孢囊霉菌,而玉米根系侵染的AM真菌只有球囊霉菌,这可能是由于特殊的施肥管理、土壤类型、环境条件造成侵染根系的AM真菌的优势种群不同引起[32]。

图8 AM真菌与土壤理化性质的冗余分析

核糖核酸型由三角形表示,根据核酸凝胶迁移位置来命名
本研究中孢子密度与土壤AHN、NH4+-N、AP、AK、DOC、土壤含水量呈显著正相关,与邓小军等[33]研究结果一致,这可能是由于施肥提高了土壤中易利用态养分含量,从而有利于土壤微生物的生长[34]。AM真菌作为专性共生菌,其侵染率会随着外界养分状况的不同有所变化[35],有研究发现一定范围内AM真菌的侵染率与土壤中速效磷呈显著正相关[36]。本研究中发现侵染率与土壤速效磷无相关性,这可能由于施用有机肥处理的土壤速效磷含量过高反而抑制了AM真菌的侵染,而侵染率仅与土壤中NO3--N呈显著正相关,这可能是因为硝态氮含量越高,植物根系分泌作用就越旺盛[37],而植物根系分泌物对AM真菌与植物形成共生体系起着重要的作用[38]。
肖艳萍等[39]发现土壤中AM真菌的多样性和孢子密度之间有极显著正相关关系,而本研究中AM真菌的多样性与孢子密度间无相关性;也有研究表明侵染玉米能力强的AM真菌产孢能力弱,或者产孢能力强的AM真菌对玉米侵染性差[40],而本研究中AM真菌侵染率与孢子密度之间呈显著正相关,以上可能是由于土壤类型、植物种类和施肥措施的不同,导致AM真菌利用碳水化合物的能力不同,从而AM真菌在土壤中生长、侵染和产孢能力也会不同[41]。
CCA分析结果表明玉米苗期土壤中DOC、AHN和NH4+-N对AM真菌的分布有一定的影响,这可能是由于微生物的生长都离不开碳源和氮源,适宜的C/N 比能显著影响微生物的群落结构[42]。AM真菌的群落分布也受到AK的影响,钾肥的施用抑制了部分AM真菌的生长(表4和图8),但是有研究表明土壤速效钾对AM真菌的影响很可能不那么重要,而氮和磷对AM真菌的可能更重要[43- 44],由于土壤速效钾对AM真菌的影响研究也较少,因此其对AM真菌的影响有待进一步研究。
本研究使用DGGE技术来分析AM真菌的群落结构,但此技术存在自身的局限性。虽然本研究通过DGGE技术成功分离了AM真菌,但其与实际值之间可能还存在差距;另外,DGGE不能全面分析土壤中全部微生物群落,只能对微生物群落中数量大于1%的优势种群进行分析[45],本研究中6个处理土壤所获得AM真菌条带仅为22条,根系AM真菌条带仅为9条,通过割胶测序仅获得13个OUT。因此采用DGGE分析可能低估了土壤中及根系侵染的AM真菌多样性。这些都可能是由于PCR引物特异性与覆盖度不足造成[46],因此在以后的研究中应对AM真菌的引物进行优化提高其特异性,或采用Illumina Miseq、第三代测序(Pac Bio)、生物标记物等方法来最大程度保证结果的准确性。
4 结论
长期定位施肥显著改变了棕壤的理化性质,从而影响AM真菌的群落结构,进而对AM真菌的生长和侵染也产生影响。长期施肥条件下棕壤中AM真菌主要为球囊霉菌和巨孢囊霉菌,而侵染玉米根系的AM真菌只有球囊霉菌,碱解氮、速效钾、可溶性有机碳和铵态氮是引起棕壤AM真菌种群变化的主要因素。长期施肥能促进棕壤AM真菌产孢及对玉米根系的侵染,土壤AM真菌孢子密度主要受到土壤碱解氮、铵态氮、速效磷、速效钾、可溶性有机碳、土壤含水量的影响,而侵染率主要受到土壤硝态氮的影响。
[1] 杨凤铃, 赵方贵, 刘洪庆, 刘新. 不同烟草栽培地区土壤理化性质与AM真菌分布关系. 中国农学通报, 2011, 27(1): 116-120.YANG F L, ZHAO F G, LIU H Q, LIU X. Relationships between physical and chemical properties of different tobacco cultivation soils and distribution of AM Fungi.2011, 7(1): 116-120. (in Chinese)
[2] 黄京华, 曾任森, 骆世明. AM 菌根真菌诱导对提高玉米纹枯病抗性的初步研究. 中国生态农业学报, 2006, 14(3): 167-169. HUANG J H, ZENG R S, LUO S M. Studies on disease resistance of maize toward sheath blight induced by arbuscular mycorrhizal fungi.2006, 14(3): 167-169. (in Chinese)
[3] GUPTA M L, PRASAD A, RAM M, KUMAR S. Effect of the vesicular–arbuscular mycorrhizal (VAM) fungus, on the essential oil yield related characters and nutrient acquisition in the crops of different cultivars of menthol mint () under field conditions.2002, 81(1):77-79.
[4] 冯海艳, 冯固, 宋建兰, 王敬国, 李晓林. 丛枝菌根真菌根内菌丝碱性磷酸酶活性与菌根共生效应的研究. 中国生态农业学报, 2004, 12(2): 124-127.FENG H Y, FENG G, SONG J L, WANG J G, LI X L. Studies on the relationship between the activity of alkaline phosphatase in intraradical hyphae of arbuscular mycorrhizae fungi and efficiency of mycorrhizal symbiosis.2004, 12(2): 124-127. (in Chinese)
[5] 刘翠花, 陈保冬, 朱永官, 张澈. 丛枝菌根真菌对青稞生长发育及磷营养的影响研究. 土壤学报, 2006, 43(6): 1052-1055. LIU C H, CHEN B D, ZHU Y G, ZHANG C. Effects on arbuscular mycorrhizal fungi on growth and phosphorus nutrition of Highland Barley.2006, 43(6): 1052-1055. (in Chinese)
[6] 张燕, 李娟, 姚青, 陈杰忠, 胡又厘. 枇杷质膜水孔蛋白基因的克隆及AM真菌对其表达的影响. 中国农业科学, 2014, 47(7):1387-1396. ZHANG Y, LI J, YAO Q, CHEN J Z, HU Y L. Cloning of a plasma membrane aquaporin geneleaves and its expression analysis after AM fungi inoculation.2014, 47(7): 1387-1396. (in Chinese)
[7] GOSLING P, HODGE A, GOODLASS G, BENDING G D. Arbuscular mycorrhizal fungi and organic farming.2005, 113(1): 17-35.
[8] DIAZ G, ROLDAN A, ALBALADEJO J. Soil type as affecting colonization patterns and mycorrhizal symbiosis effectiveness of 6 glomus species.1992, 13(1): 47-56.
[9] 张海波, 梁月明, 冯书珍, 赵紫薇, 苏以荣, 何寻阳. 土壤类型和树种对根际土丛枝菌根真菌群落及其根系侵染率的影响. 农业现代化研究, 2016, 37(1): 187-194.ZHANG H B, LIANG Y M, FENG S Z, ZHAO Z W, SU Y R, HE X Y. The effects of soil types and plant species on arbuscular mycorrhizal fungi community and colonization in the rhizosphere.2016, 37(1): 187-194. (in Chinese)
[10] 闫飞扬, 段廷玉, 张峰. 农业管理措施对AM真菌功能影响的研究进展. 草业科学, 2014, 31(12): 2230-2241.YAN F Y, DUAN T Y, ZHANG F. Effects of agricultural managements on the function of arbuscular mycorrhizal fungi.2014, 31(12): 2230-2241. (in Chinese)
[11] 田慧, 盖京苹, 李晓林, 张俊伶. 农田土著丛枝菌根真菌群落特征和磷吸收作用研究进展. 土壤通报, 2013, 44(6): 1512-1519. TIAN H, GAI J P, LI X L, ZHANG J L. Community composition and phosphorus uptake by indigenous arbuscular mycorrhizal fungi in agroecosystems.2013, 44(6): 1512-1519. (in Chinese)
[12] 秀彦华, 刘润进, 李敏. 自然入侵条件下黄顶菊丛枝菌根定殖及发育的研究. 菌物学报, 2015, 34(1): 82-90.XIU Y H, LIU R J, LI M. Arbuscular mycorrhizal colonization and development ofunder natural invasive conditions.2015, 34(1): 82-90. (in Chinese)
[13] 高秀兵, 陈娟, 赵华富, 李珍, 郭灿, 周富裕, 王振轩, 涂逸洋, 周玉峰. 贵州地方种茶树根系丛枝菌根真菌的侵染特征. 西南农业学报, 2016, 6(29): 1328-1335.GAO X B, CHEN J, ZHAO H F, LI Z, GUO C, ZHOU F Y, WANG Z X, TU Y Y, ZHOU Y F. Colonization characteristics of arbuscular mycorrhiza fungi in rhizosphere of local tea trees in Guizhou.2016, 6(29): 1328-1335. (in Chinese)
[14] WU F, DONG M, LIU Y, MA X, AN L, YOUNG J P W.Effects of long-term fertilization on AM fungal community structure and Glomalin-related soil protein in the Loess Plateau of China.2011, 342(1/2): 233-247.
[15] 张鑫, 裴宗平, 孙干, 苏雪鹏. 紫花苜蓿根际丛枝菌根真菌与土壤理化性质的相关性研究. 北方园艺, 2016(13): 172-177.ZHANG X, PEI Z P, SUN G, Su X P. Correlation between physicochemical properties of rhizosphere soil and arbuscula mycorrhizae fungi inl.2016(13): 172-177. (in Chinese)
[16] JONER E J. The effect of long-term fertilization with organic or inorganic fertilizers on mycorrhiza-mediated phosphorus uptake in subterranean clover.2000, 32(5): 435-440.
[17] 贾锐, 杨秀丽, 闫伟. 兴安杜鹃菌根形态特征和土壤理化性质的关系研究. 内蒙古农业大学学报, 2011, 32(3): 63-66.JIA Y, YANG X L, YAN W. Study on the relationship between morphology and soil properties mycorrhizal fungi of rhododendron dauricum.2011, 32(3): 63-66. (in Chinese)
[18] MUCHANE M N, JAMA B, OTHIENO C, OKALEBO R, ODEE D, MACHUA J. Influence of improved fallow systems and phosphorus application on arbuscular mycorrhizal fungi symbiosis in maize grown in western Kenya.2010, 78(2): 139-150.
[19] 罗培宇, 樊耀, 杨劲峰, 葛银凤, 蔡芳芳, 韩晓日. 长期施肥对棕壤氨氧化细菌和古菌丰度的影响. 植物营养与肥料学报, 2017, 23(3): 678-685.LUO P Y, FAN Y, YANG J F, GE Y F, CAI F F, HAN X R. Influence of long-term fertilization on abundance of ammonia oxidizing bacteria and archaea in brown soil.2017, 23(3): 678-685. (in Chinese)
[20] TU C L, LIU C Q, LU X H, YUAN J, LANG Y C. Sources of dissolved organic carbon in forest soils: evidences from the differences of organic carbon concentration and isotope composition studies.2011, 63(4):723-730.
[21] 鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000: 39-109.BAO S D.Beijing: China Agriculture Press, 2000: 39-109. (in Chinese)
[22] HENDRIX J W, HERSHMAN D E, HENSON G T. Evaluation of the "most probable number" (MPN) and wet-sieving methods for determining soil-borne populations of endogonaceous mycorrhizal fungi.1990, 82(5): 576-581.
[23] 盛萍萍, 刘润进, 李敏. 丛枝菌根观察与侵染率测定方法的比较. 菌物学报, 2011, 30(4): 519-525. SHENG P P, LIU R J, LI M. Methodological comparison of observation and colonization measurement of arbuscular mycorrhizal fungi.2011, 30(4): 519-525. (in Chinese)
[24] RENKER C, HEINRICHS J, KALDORF M, BUSCOT F. Combining nested PCR and restriction digest of the internal transcribed spacer region to characterize arbuscular mycorrhizal fungi on roots from the field.2003, 13(4):191-198.
[25] HARLEY J L, SMITH S E. Mycorrhizal symbiosis.2008, 3(3): 273-281.
[26] 李登武, 贺学礼, 余仲东. 施钾量与AM真菌接种效应的关系. 西北植物学报, 2002, 22(4): 889-893. LI D W, HE X L, YU Z D. Amount of potassium application in relation to AM fungus inoculation efficiency.2002, 22(4): 889-893. (in Chinese)
[27] 程俐陶, 郭巧生, 刘作易. 半夏丛枝菌根真菌侵染模式及侵染率动态变化. 贵州农业科学, 2009, 37(2): 37-39. CHEN L T, GUO Q S, LIU Z Y. Infection pattern and dynamic change of arbuscular mycorrhizal fungi in.2009, 37(2): 37-39. (in Chinese)
[28] BHADALUNG N N, SUWANARIT A, DELL B, NOPAMORNBODI O, THAMCHAIPENET A. AND RUNGCHUANG J. Effects of long-term NP-fertilization on abundance and diversity of arbuscular mycorrhizal fungi under a maize cropping system .2005, 270(1): 371-382.
[29] 胡从从, 郭清华, 贺学礼,赵丽莉, 李英鹏, 曹翠兰. 蒙古沙冬青伴生植物AM真菌多样性. 西北农业学报, 2016, 25(6): 921-932.HU C C, GUO Q H, HE X L, ZAHO L L, LIN Y P, CAO C L. Diversity of arbuscular mycorrhiza fungi near to the associated plants of.2016, 25(6): 921-932. (in Chinese)
[30] 胡静, 罗充, 吴涛. 刺梨丛枝菌根真菌的侵染特征及其种类鉴定. 贵州农业科学, 2015, 43(9): 82-86.HU J, LUO C, WU T. Infection characteristics and species identification of arbuscular mycorrhizal fungi in the rhizosphere ofTratt.2015, 43(9): 82-86. (in Chinese)
[31] 王茜, 王强, 王晓娟, 熊友才, 祝英, 张亮, 金樑. 不同AM真菌对玉米生长的促生效应. 兰州大学学报, 2015, 51(4): 558-563.WANG Q, WANG Q,WANG Q J, XIONG Y C, ZHU Y, ZHANG L, JIN L. Effects of various AM fungi on the growth of corn ().
[32] SMITH S E, READ D J.New York: Academic Press, 2010: 11-188.
[34] ELLOUZE W, HAMEL C, CRUZ A F, ISHII T, GAN Y, BOUZID S. Phytochemicals and spore germination: At the root of AMF host preference?2012, 60(4): 98-104.
[33] 邓小军, 周国英, 刘君昂, 李琳, 布婷婷. 湖南油茶林丛枝菌根真菌多样性及其群落结构特征. 中国林业科技大学学报, 2011, 31(10): 38-42.DENG X J, ZHOU G Y, LIU J A, LI L, BU T T. Diversity and community structure of arbuscular mycorrhizal fungi instands in Hunan.2011, 31(10): 38-42. (in Chinese)
[34] GUAA Y, LINDSTRÖM K. Soil microbial biomass, crop yields, and bacterial community structure as affected by long-term fertilizer treatments under wheat-rice cropping.2009, 45(3): 239-246.
[35] 冯固, 杨茂秋, 白灯莎, 黄全生. VA 菌根真菌对棉花磷素吸收及生长的效应. 西北农业学报, 1994, 3(2): 75-80.FENG G, YANG M Q, BAI D S, Huang Q S. Effect of inoculating with vescular-arbuscular mycorrgizal fungi on the p nutrient and growth of cotton.1994, 3(2): 75-80. (in Chinese)
[36] 李伟, 孙龙燕, 张翠萍, 徐萌, 郭绍霞. 濒危植物崂山百合根围AM真菌分布特征. 东北农业大学学报, 2016, 47(1): 30-37.LI W, SUN L Y, ZHANG C P, XU M, GUO S X. Distribution characteristic of arbuscular mycorrhizal fungi in the rhizosphere of endangeredplants.2016, 47(1): 30-37. (in Chinese)
[37] 张俊英, 王敬国, 许永利, 李海港. 氮素对不同大豆品种根系分泌物中有机酸的影响. 植物营养与肥料学报, 2007, 13(3): 398-403.ZHANG J Y, WANG J G, XU R L, LI H G. Effect of nitrogen on the species and contents of organic acids in root exudates of different soybean cultivars.2007, 13(3): 398-403. (in Chinese)
[38] AKIYAMA K, MATSUZAKI K , HAYASHI H. Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi.2005, 435 (7043): 824-827.
[39] 肖艳萍, 李涛, 费洪运, 赵之伟. 云南金顶铅锌矿区丛枝菌根真菌多样性的研究. 菌物学报, 2008, 27(5): 652-662.XIAO Y P, LI T, FEI H T, ZHAO Z W. Species diversity of arbuscular mycorrizal fungi in Jinding Pb-Zn mining area of Lanping, Yunnan.2008, 27(5): 652-662. (in Chinese)
[40] CAMARGO-RICALDE S L, DHILLION S S. Endemic Mimosa species can serve as mycorrhizal "resource isands" within semiarid communities of the Tehuacan-Cuicatlan Valley, Mexico.2003, 13(3): 129-136.
[41] KENNEDY L J. TILLER R L, STUTZ J C. Associations between arbuscular mycorrhizal fungi andin riparian habitats in arid South- western North America.2002, 50(3): 459-475.
[42] 邬奇峰, 陆扣萍, 毛霞丽, 秦华, 王海龙. 长期不同施肥对农田土壤养分与微生物群落结构的影响. 中国农学通报, 2015, 31(5): 150-156.WU Q F, LU K P, MAO X L, QIN H, WANG H L. Responses of soil nutrients and microbial biomass and community composition to long-term fertilization in cultivated land.2015, 31(5): 150-156. (in Chinese)
[43] MATHIMARAN N, RUH R, VULLIOUD P, FROSSARD E, JANSA J. Glomus intraradices dominates arbuscular mycorrhizal communities in a heavy textured agricultural soil.2005, 16(1): 61-66.
[44] BLANKE V, RENKER C, WAGNER M, FILLNER K, HELD M, KUHN A J, BUSCOT F. Nitrogen supply affects arbuscular mycorrhizal colonization of Artemisia vulgaris in a phosphate- polluted field site.2005, 166(3): 981-992.
[45] 刘权钢, 金东淳, 刘敬爱. DGGE技术在土壤微生物多样性分析上的研究进展. 延边大学农学学报, 2012, 34(2): 170-176.LI Q G, JIN D C, LIU J A. Research progress of DGGE technique for soil microbial diversity analysis.2012, 34(2): 170-176. (in Chinese)
[46] 林先贵, 胡君利, 戴珏, 王发园, 冯有智. 丛枝菌根真菌群落结构与多样性研究方法概述及实例比较. 应用与环境生物学报, 2017,23 (2): 343-350.LI X G, HU G L, DAI Y, WANG F Y, FNG Y Z. Overview and comparison of research methods for determining the community structure and diversity of arbuscular mycorrhizal fungi.2017, 23 (2): 343-350. (in Chinese)
Influence of Long-term Fertilization on Community Structures and Colonization ofFungi in a Brown Soil
GUO Jing, LUO PeiYu, YANG JinFeng, LI DongDong, HUANG YueYue, HAN XiaoRi
(College of Land and Environment, Shenyang Agricultural University/National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources, Shenyang 110866)
【Objective】AM () fungi plays important roles like improving the rhizosphere soil environment, promoting the uptake of nutrients by plants, enhancing resistance of plant, and increasing crop yield and quality. This study aimed to explore changes of community structures and colonization rate of AM fungi and to find out the main factors which affected the changes under a corn-soybean rotation system and a long-term fertilization for 38 years in a brown soil. 【Method】Soil samples (0-20 cm) were taken from the six treatments of the long-term fertilization experiment in June 2016, including (1) no fertilizer (CK); (2) chemical N input (N); (3) chemical N and P input (NP); (4) chemical N, P and K input (NPK); (5) pig manure (M); (6) pig manure, chemical N and P (MNP). Then the soil samples were analyzed by using PCR-DGGE, gel-recovery, sequencing and trypan blue staining. Relationship between community and colonization rate of AM fungi and environmental factors were analyzed by Redundancy analysis and Canonical Correlation analysis. 【Result】The result showed that the contents of alkali-hydrolysable nitrogen (AHN), available phosphorus (AP), available potassium (AK) , ammonium nitrogen (NH4+-N), nitric nitrogen (NO3--N) and dissolved organic carbon (DOC) under organic fertilization treatments were significantly higher than them under the CK treatment and chemical fertilization treatments, and the trend was: organic fertilizer treatments > chemical fertilizer treatments > CK treatment. Compared with the CK treatment, soil pH was decreased in chemical fertilizer treatments and increased in organic fertilizer treatments. 22 bands of AM fungi from soil and 9 bands of AM fungi from root were obtained by gel-recovery, and 13 OTU were obtained by BLAST. The result of sequencing showed that AM fungi species isolated from soil samples were mainlyand, while infected AM fungi was onlyThe cluster analysis showed that community structures of soil AM fungi were divided into three groups under a long-term fertilization in a brownsoil, namely N treatment, organic fertilizer treatments and another fertilizer treatments. Community structures of infected AM fungi were also divided into three groups, namely NPK treatment, M treatment and NP treatment, and another fertilizer treatments. The spore density of AM fungi under organic fertilizer treatments was significantly higher than that under chemical fertilizer treatments and non-fertilizer treatment, and the trend was: organic fertilizer treatments > chemical fertilizer treatments > CK treatment. The trend of colonization rate of AM fungi under different fertilizer treatments was: NPK treatment > organic fertilizer treatments > another fertilizer treatments. Redundancy analysis showed that spore density was positively correlated with soil AHN, NH4+-N, AP, AK, DOC and soil moisture content, and colonization rate was positively correlated with nitric nitrogen content. The colonization rate was positively correlated with spore density, while diversity index of AM fungi was neither correlation with colonization rate nor with spore density. Canonical Correlation analysis showed AHN, AK, DOC and NH4+-N significantly influenced the ribotypes of AM fungi. 【Conclusion】The long-term fertilization changed community structures of AM fungi by changing the physicochemical properties of the soil, and then affected colonization of AM fungi.
fungi; brown soil; long-term fertilization; community structure; colonization rate
2018-04-16;
2018-07-10
国家自然科学基金(41501305)、国家重点研发计划项目(2017YFD0200707)
郭静,E-mail:m18302469630_2@163.com。
罗培宇,E-mail:ibtyoufe@163.com。通信作者韩晓日,E-mail:hanxiaori@163.com
10.3864/j.issn.0578-1752.2018.24.008
(责任编辑 李云霞)
