氨氮胁迫与恢复对罗氏沼虾幼虾非特异性免疫的影响
2018-12-27董学兴吕林兰赵卫红刘其根
董学兴,吕林兰,赵卫红,陆 妍,刘其根
(1. 上海海洋大学水产与生命学院,上海 201306; 2. 盐城工学院海洋技术系,江苏省沿海池塘养殖生态重点实验室, 江苏盐城 224051)
罗氏沼虾(Macrobrachiumrosenbergii)又称马来西亚大虾或泰国虾,具有食性广、生长快、营养丰富、抗病力强等优良养殖性能,是我国养殖的主要淡水虾品种之一。近年来随着水产养殖技术水平的提高,放养密度加大,从而导致单位水体中养殖动物排泄物及残饵等有机物积聚,分解生成大量氨氮,使得养殖环境持续恶化,对养殖动物的生存、生长、发育构成威胁,造成疾病频繁爆发,严重制约着我国对虾养殖业可持续发展。水体中的氨包括离子氨和非离子氨,对水产动物有毒性的主要为非离子氨。离子氨和非离子氨可以相互转化,其比例主要取决于水温和pH。水中非离子氨含量随温度和pH升高而增加,对水产动物的毒性随之增大。当对虾暴露于氨氮时,其体内产生大量超氧阴离子(O2-)、羟自由基(OH)、过氧化氢(H2O2)等氧自由基(ROS),而氧自由基超过机体抗氧化耐受能力时便会影响机体抗氧化酶系统,产生氧化胁迫[1-2]。研究表明,非离子氨能直接损害虾类鳃组织,并影响其渗透调节、蜕壳和免疫功能,从而抑制生长、降低存活率[3-4]。已有研究表明,罗氏沼虾在高浓度氨氮作用下抗病力明显降低,感染病原菌的几率增加[5-6]。关于氨氮对虾类抗氧化影响的研究,目前主要集中于探索氨氮持续胁迫条件下不同时间点虾类抗氧化酶的变化规律[7-10]。在实际养殖生产中,夏季水体温度、pH昼夜变化较大,池水非离子氨常处于动态变化中。因此,本文研究了非离子氨对罗氏沼虾幼虾的急性毒性,以及氨氮胁迫48 h后恢复48 h对罗氏沼虾幼虾抗氧化酶的影响,以期为罗氏沼虾健康养殖提供理论参考。
1 材料与方法
1.1 实验材料
实验幼虾购自江苏省盐城市射阳县林盛虾苗场,虾体长(2.0±0.4) cm,体质量(0.16±0.06) g。
1.2 氨氮急性毒性实验
幼虾运至实验室,暂养7 d后进行氨氮胁迫预实验,得出无效应浓度和最大效应浓度。用氯化铵(分析纯)、曝气48 h的自来水配制氨氮溶液,根据预实验结果,共设置5个急性毒性实验浓度梯度,其总氨浓度为0、22.17、32.04 、46.32、66.95 mg·L-1,对应的非离子氨浓度分别为0、1.18、1.70、2.46、3.56 mg·L-1。实验在玻璃缸中进行,每缸盛3 L实验液,放10尾虾,每24 h换实验液1/2。每个浓度设置3组平行,实验期间持续充气,不投喂饵料,水温保持在(25±1)℃,pH 保持在8.0±0.5,准确记录24、48、72、96 h死亡数目。
1.3 氨氮亚急性毒性实验
根据急性毒性实验96 hLC50结果,设置5个亚急性毒性实验浓度梯度,总氨浓度为0、8、12、16、20 mg·L-1,对应的非离子氨浓度分别为0、0.43、0.64、0.85、1.06 mg·L-1(其中浓度0为对照组)。亚急性毒性实验在玻璃缸中进行,每缸盛3 L实验液,随机挑选个体均匀的健康罗氏沼虾幼虾10尾,每个浓度设置3组平行。氨氮胁迫48 h(24 h 时换实验液1/2)后将实验液更换为清水(曝气48 h的自来水),恢复48 h。温度、pH、充气、投喂等实验条件同上。胁迫48 h、恢复48 h时分别取幼虾肌肉组织,保存在-80℃下,用于超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)测定。
1.4 抗氧化酶活性及MDA测定
抗氧化酶(SOD、CAT和GSH-Px)活性和MDA含量测定采用南京建成生物工程研究所试剂盒,具体操作步骤、计算和单位参照试剂盒说明书。
1.5 数据处理
本实验中非离子氨计算公式如下[11]:
非离子氨浓度 =总氨氮浓度/[10(pKa-pH)+1]
式中:pKa=0.090 18+2 729.92/T(T为开氏温度,T=273+t℃)。
氨氮对罗氏沼虾幼虾半致死浓度(LC50):采用SPSS 16.0 Probit分析法计算半数致死浓度和95%置信区间,并按照公式SC= 0.1 × 96 hLC50计算安全浓度。
酶活性差异性分析:采用SPSS 16.0软件进行单因素方差分析(ANOVA),若差异显著(P<0.05)则采用LSD法进行多重比较,P<0.05为差异显著。
2 结果与分析
2.1 氨氮对罗氏沼虾急性毒性实验
氨氮对罗氏沼虾幼虾急性毒性实验结果见表1。实验期间,对照组(非离子氨浓度0)罗氏沼虾无死亡现象发生。同一时间点,罗氏沼虾幼虾死亡率随氨氮浓度升高而升高。同一浓度下,幼虾死亡率随暴露时间延长而上升。氨氮对罗氏沼虾幼虾24、48、72、96 h的半致死浓度分别为4.25、2.35、1.86、1.54 mg·L-1,其安全浓度为0.154 mg·L-1(表2)。
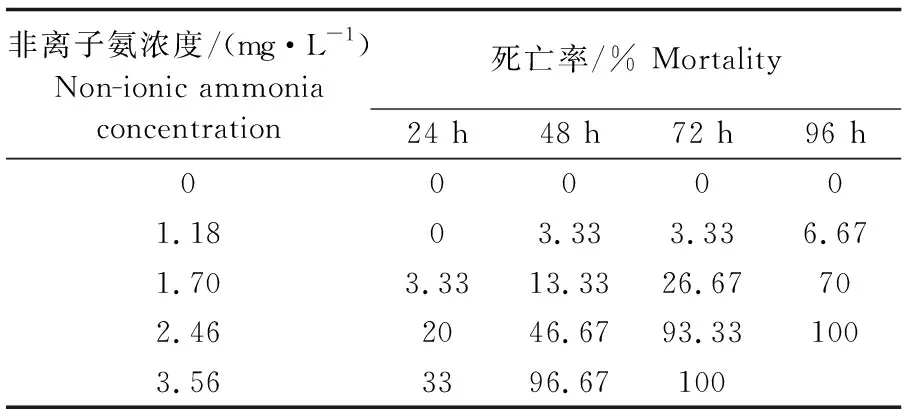
表1 氨氮对罗氏沼虾急性毒性实验结果Tab.1 Results of acute toxicity test of ammonia-N on M. rosenbergii
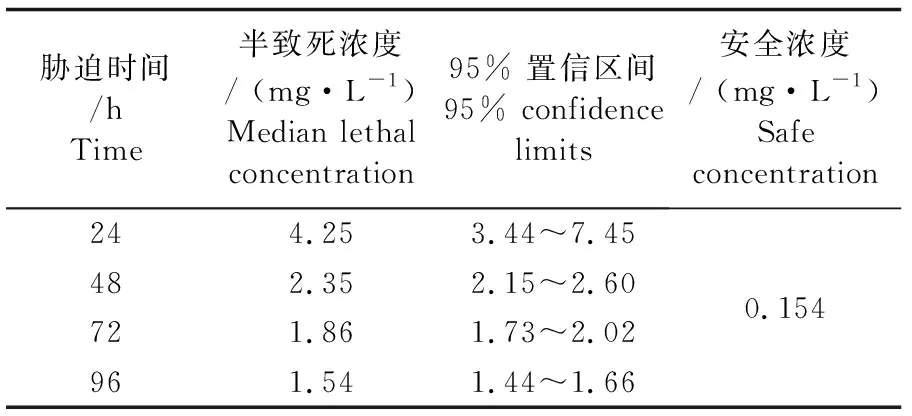
表2 氨氮对罗氏沼虾的半致死浓度和安全浓度Tab.2 LC50 and SC of ammonia-N stress on M. rosenbergii
2.2 氨氮胁迫和恢复对罗氏沼虾抗氧化酶活性的影响
实验结果表明(表3),氨氮胁迫显著影响罗氏沼虾SOD活性(P<0.05),而对CAT和GSH-Px活性影响不显著(P>0.05)。暴露48 h时,罗氏沼虾幼虾SOD活性随氨氮浓度升高而升高,各氨氮浓度组活性均显著高于对照组(P<0.05)。其中最高氨浓度(1.06 mg·L-1)组SOD活性是对照组的2.13倍,亦显著高于其余各处理组(P<0.05)。
恢复48 h时,各组SOD、CAT活性差异显著(P<0.05),而各组GSH-Px活性无显著差异(P>0.05)。同一浓度下,各试验组SOD活性均较胁迫时显著下降(P<0.05),但除0.85 mg·L-1组外,其余试验组仍显著高于对照组(P<0.05)。CAT活性则与之相反,除0.85 mg·L-1组显著低于对照组外(P<0.05),其余试验组均与对照组无显著差异(P>0.05)。与胁迫48 h时相比,0.85、1.06 mg·L-1浓度组CAT活性及0.85 mg·L-1组GSH-Px活性下降显著(P<0.05)。
2.3 氨氮胁迫和恢复对罗氏沼虾MDA含量的影响
实验结果表明(表4),氨氮对罗氏沼虾MDA含量有显著影响(P<0.05)。胁迫48 h,0.43、0.64、1.06 mg·L-1组MDA含量显著高于对照组(P<0.05)。解除胁迫后恢复48 h,上述3个浓度组MDA含量均较胁迫时下降,各组MDA含量与对照组相比无显著差异(P>0.05)。
3 讨论
3.1 氨氮对罗氏沼虾的急性毒性
王龙等[12]研究表明,正常溶氧条件下非离子氨对罗氏沼虾幼虾(全长3 cm左右)24 hLC50、48 hLC50、72 hLC50、96 hLC50分别为2.0、1.5、0.97、0.83 mg·L-1,安全浓度为0.083 mg·L-1;而在高溶氧条件下(11 mg·L-1)安全浓度为0.142 5 mg·L-1。另有研究表明,高溶氧可降低非离子氨的毒性[13-14]。本实验在持续充气条件下进行,氨氮对罗氏沼虾安全浓度为0.154 mg·L-1,与上述高溶氧条件下求得的安全浓度接近,说明罗氏沼虾幼虾对氨氮具有一定的耐受力。此外,不同规格的虾对氨的耐受力亦不同,一般而言,个体越大耐受力越强[15-16]。罗氏沼虾与规格接近的克氏原螯虾(Procambarusclarkia)幼虾(0.016 4~0.021 7 g,SC=0.19 mg·L-1)[17]和中国明对虾(Penaeuschinensis)(体长3.61 cm,SC=0.16 mg·L-1)[18]对非离子氨的耐受力接近,而小于红螯螯虾(Cheraxquadricarinatus)幼虾(体长为25~38 mm,SC=0.48 mg·L-1)[15]。本研究结果表明,罗氏沼虾幼虾对氨氮的耐受力为中等水平。

表3 氨氮对罗氏沼虾T-SOD、CAT和GSH-Px活性的影响Tab.3 Effects of ammonia-N on T-SOD, CAT and GSH-Px activity of M. rosenbergii
注:相同小写字母表示同一时间(同列)各组差异不显著,否则差异显著(P<0.05);相同大写字母表示同一浓度组胁迫48h与恢复48h之间差异不显著,否则差异显著(P<0.05)
Notes: The same lowercase mean no significant difference at the same time (the same column), otherwise significant differences(P<0.05); the same capital letter mean no significant difference under the same concentration, otherwise significant differences(P<0.05)

表4 氨氮对罗氏沼虾MDA含量的影响Tab.4 Effects of ammonia-N on MDA content of M. rosenbergii
注:上标含相同字母表示在同一时间下,各组间差异不显著,否则差异显著(P<0.05)
Notes: The same letter mean no significant difference at the same time, otherwise significant differences(P<0.05)
3.2 氨氮胁迫和恢复对罗氏沼虾抗氧化酶活性的影响
ZHANG等[19]研究表明,随着氨氮浓度升高,罗氏沼虾血细胞活性氧(ROS)含量上升。SOD和CAT是生物体内两种相互关联的抗氧化酶,可联合清除活性氧自由基,从而减轻其对机体的损伤。过多的ROS会导致机体脂质过氧化程度加剧,因此,作为脂质过氧化产物之一的MDA,其含量多寡可间接反映机体细胞受氧化损伤的程度[20]。本研究发现,氨氮胁迫48 h,罗氏沼虾幼虾SOD活性随氨氮浓度增大而升高,最高浓度组SOD活性达对照组的2.13倍。除0.85 mg·L-1浓度组外,其余各试验组MDA含量也显著升高。据此推测,氨氮胁迫可能致使罗氏沼虾肌肉组织ROS增多,进而对细胞脂膜产生氧化损伤,机体通过增强SOD活性清除多余的ROS以降低胁迫损伤。任海等[21]发现17.64、34.87 mg·L-1氨氮组脊尾白虾(Exopalaemoncarinicauda)肝胰腺SOD活性在6~48 h 均显著高于对照组(P<0.05),但72 h时SOD 活性受到显著抑制。包杰等[22]研究证实,氨氮胁迫中华小长臂虾(Palaemonetessinensis)24 h对其肝胰腺SOD酶活性具有诱导作用,而48 h时则下降。本实验设置的5个氨氮浓度均在96 hLC50以下,胁迫48 h时各试验组罗氏沼虾SOD活性均受到不同程度的诱导。由此可见,氨氮对甲壳动物SOD活性的影响与动物种类、氨氮浓度、胁迫时间等因素密切相关,当胁迫压力超过其耐受能力时,SOD活性受到抑制。
当组织中活性氧含量异常升高,生物体通常首先通过SOD催化超氧自由基的歧化反应生成H2O2,进而再被GPx、CAT和过氧化物酶(Prx)等一系列抗氧化酶催化生成无害的H2O与O2[23]。本实验中,氨氮胁迫48 h对罗氏沼虾CAT和GSH-Px影响不显著(P>0.05),与蒋琦辰等[24]发现氨氮胁迫72 h对红螯螯虾SOD影响显著(P<0.05)、而对CAT和GSH-Px影响不显著的结果一致(P>0.05)。解除胁迫后恢复48 h,各组CAT、GSH-Px、SOD与胁迫时相比均呈下降趋势,说明氨氮对CAT、GSH-Px也具有影响,但较SOD对氨氮胁迫的反应可能更为滞后。曾媛媛等[25]在对拟穴青蟹(Scyllaparamamosain)的研究中也有相似的结果,即氨氮胁迫48 h时鳃SOD活性最高,而GPX活性则是在72 h时才达到最高。
迄今,关于氨氮胁迫后恢复对水产动物抗氧化酶活性影响的研究鲜有报道。本实验研究表明,氨氮胁迫48 h后恢复48 h,虽然除0.85 mg·L-1组外的其余试验组SOD活性仍高于对照组,但均较胁迫状态显著下降(P<0.05),MDA含量亦降低到对照组水平。由此可见,在本实验设置的氨氮浓度范围内,短期胁迫对罗氏沼虾的氧化损伤在胁迫结束后可修复,但肌肉仍处于应激状态。另有研究发现,8、12、16 mg·L-1氨氮胁迫72 h后恢复7 d,红螯光壳螯虾(Cheraxquadricarinatus)总SOD活性显著上升(P<0.05),因此研究者认为7 d恢复时间不足以让红螯光壳螯虾从胁迫中完全恢复[24],这与本研究罗氏沼虾恢复48 h SOD活性仍高于对照的结果类似。张武肖等[26]研究证实,随着氨氮胁迫时间延长,团头鲂(Megalobramaamblycephala)鳃、肝和肾组织受到的损害增加,经过96 h的恢复期仍未从胁迫中完全恢复,肾组织恢复能力最差。本实验以MDA和SOD为主要指标,发现氨氮短期(48 h)胁迫造成罗氏沼虾肌肉氧化损伤,而经过一定恢复期后其氧化损伤可修复。但是,氨氮胁迫是否会造成罗氏沼虾组织损伤,以及其组织损伤是否可通过解除胁迫得以修复,还需要进一步研究。
