板栗壳棕色素的抗氧化活性及其活性成分的分离、鉴定
2018-12-26蔡峰
,, , ,蔡峰, ,,,*, ,*
(1.华东理工大学药学院,上海 200237; 2.中药保健食品质量与安全湖北省重点实验室,劲牌研究院,劲牌有限公司,湖北大治 435100; 3.上海中医药大学中药现代制剂技术教育部工程研究中心,上海 201203)
板栗(CastaneamollissimaBlume)是壳斗科(Fagaccac)栗属坚果类植物的果实,又名栗、栗子、风栗等,是我国特产植物。板栗壳是板栗在深加工过程中产生的副产物。传统中医认为板栗壳药性甘、涩、平,具有降逆、止血的功效,主治反胃、便血等症[1]。现代医学研究也表明,板栗壳具有较强的抗氧化性、抗癌、治疗糖尿病和抗病毒活性[2-5]。板栗壳中含有大量的天然棕色素,是目前世界上并不多见的性质稳定的天然色素之一[6-7],由于其使用稳定、安全性高、色泽正宗,已作为色素添加剂,应用于保健酒、可可奶等中[8-9]。
目前针对板栗壳中棕色素的研究主要集中在提取工艺优化、使用稳定性考察、着色效果评价等方面[6-7,10-13],对于其药理活性、化学成分组分及纯化制备的研究较少。板栗壳棕色素具有作为优良天然色素的开发潜能,若对其药理活性和化学成分等方面的认识不足,将无法为后续的毒理学和安全性评价提供有力依据,从而限制其作为天然食用色素的实际应用。
目前,大力开发天然色素等天然食品添加剂是食品添加剂发展的主体趋势。因此,为充分利用板栗壳棕色素这一优良的天然色素,为其安全评价和实际应用打好基础,本文开展了光谱分析、含量测定、体外抗氧化活性测定及色谱分离纯化等工作,对板栗壳棕色素的药理活性和化学组成进行深入研究。
1 材料与方法
1.1 材料与仪器
板栗 购于湖北省大治市当地市场,收集其外果皮并粉碎;没食子酸(gallic acid) 北京百灵威科技有限公司;无水碳酸钠(Na2CO3) 江苏强盛功能化学股份有限公司;福林酚(Folin-Ciocalteu)(生物试剂) 上海麦克林生化科技有限公司;苯酚(化学纯) 上海凌峰化学试剂有限公司;硫酸(分析纯) 国药集团化学试剂有限公司;牛血清白蛋白标准品、二喹啉甲酸(bicinchonininc acid,BCA)蛋白浓度测定试剂盒 上海翊圣生物科技有限公司;甲醇、乙醇(制备级) 上海星可高纯溶剂有限公司;乙腈(色谱级) 北京百灵威科技有限公司。
NICOLET 6700型傅里叶红外光谱仪 美国赛默飞世尔科技公司;UV2400PC型紫外可见分光光度计 上海舜宇恒平科学仪器有限公司;KH200B型超声波清洗器 昆山禾创仪器有限公司;ASE-12/16/24固相萃取装置 天津奥特塞恩斯仪器有限公司;BONA-GM-M22陶瓷膜中试型实验机、BONA-GM-18超滤-微滤-纳滤膜分离实验机 济南博纳生物技术有限公司;Waters Alliance型高效液相色谱仪(包括2695四元梯度泵、2489 UV-Vis检测器、自动进样器和柱温箱;数据采集与处理用Empower 3控制)、ACQUITY TQD串联四级杆液质联用仪(电喷雾离子源,包含正、负离子模式,用Masslynx 4.1工作站控制)、Waters Alliance自动纯化系统(包括2545二元梯度泵,2767馏分收集器,2489 UV-vis检测器和自动进样器,由Masslynx 4.1软件处理控制) 美国沃特世公司;AVANCE Ⅲ 500型超导傅里叶变换核磁共振波谱仪 Bruker公司。
1.2 实验方法
1.2.1 板栗壳棕色素的提取 将板栗壳用粉碎机粉碎成直径小于1 cm的碎片,加入20倍量的40%乙醇,于75 ℃下提取3次,每次2 h。经棉花粗滤后,用50 nm的陶瓷膜过滤,获得的滤液用稀盐酸调节pH至3~4,静置15 min使其充分沉淀后,于4400 r/min下离心10 min,再将获得的沉淀溶解于pH为6~7的纯水中,保持搅拌至出口温度达85 ℃,喷雾干燥后获得粉末状板栗壳棕色素,色率在7000~11000 EBC间。
1.2.2 紫外光谱分析 取少量棕色素溶于水中,在UV2400PC紫外可见分光光度计下,于200~800 nm的紫外-可见光区域进行扫描。
1.2.3 红外光谱分析 瑙乳钵将板栗壳棕色素研细,然后加入适量干燥的溴化钾并研磨均匀,压成片状,用傅里叶红外光谱仪于4000~500 cm-1的红外区扫描。
1.2.4 板栗壳棕色素中总多酚、多糖和蛋白质的含量测定
1.2.4.1 总多酚含量的测定 精密称定10.00 mg没食子酸标准品于100 mL容量瓶中,用水溶解并定容至刻度,摇匀。精确量取0.20、0.40、0.80、1.25、1.50、2.00 mL没食子酸对照品溶液于10 mL容量瓶中,加入0.50 mL Folin-Ciocalteu试剂,充分摇匀,静置2 min,加入3.00 mL 7.5% Na2CO3溶液,再加水至刻度,摇匀,在室温下反应60 min。以相应的试剂为空白,在760 nm处测定吸光值,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线[14]。板栗壳棕色素中总多酚的含量测定方法同标准曲线的绘制方法。
式中:E为多酚百分含量,C为显色液中多酚含量(μg/mL),V为样品液体积(mL),m为式样质量(g),n为稀释倍数。
1.2.4.2 多糖含量的测定 精密称取105 ℃干燥恒重的标准葡萄糖4.20 mg于50 mL容量瓶中,加水溶解并定容至刻度。精确量取葡萄糖对照品溶液0.10、0.20、0.40、0.60、0.80、1.00 mL,分置于具塞试管中,各加蒸馏水使体积为2.00 mL,再各加约5%的苯酚液1.00 mL,摇匀,迅速滴加硫酸5.00 mL,摇匀后放置5 min,置于沸水浴中加热15 min,取出冷却至室温;另加蒸馏水2.00 mL,加苯酚液和硫酸,同上操作为空白对照。于490 nm处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线[15]。板栗壳棕色素中多糖的含量测定方法同标准曲线的绘制方法。
式中:W为多糖的百分含量,ρ为显色液中葡萄糖含量(μg/mL),f为葡萄糖换算多糖的换算因素,m为试样质量(g),V为吸取待测液体积(mL)。
1.2.4.3 蛋白质含量的测定 标准曲线的测定:配制1.44 mg/mL的牛血清白蛋白标准溶液,依次精确稀释到其浓度的80%、60%、40%、20%。分别取5 μL标准品加入到微孔板中,加入200 μL BCA工作液,振荡30 s充分混匀,盖上微孔板,37 ℃孵育30 min。另取蒸馏水5 μL于微孔板中,加入200 μL BCA工作液,并按上述方法孵育,于595 nm处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线[16]。板栗壳棕色素中蛋白质的含量测定方法同标准曲线的绘制方法。
式中:W为蛋白质百分含量,C为显色液中蛋白质浓度(mg/mL),V为样品液体积(mL),m为式样质量(g),n为稀释倍数。
1.2.5 板栗壳棕色素的DPPH自由基清除能力 准确移取50、100、200、400、500 μL浓度为20 mg/mL的板栗壳棕色素50%乙醇溶液于容量瓶中,加入4 mL DPPH自由基溶液(0.25 mmol/L),再用50%乙醇定容于10 mL,振荡摇匀后,常温避光暗反应30 min后于517 nm处测定吸光值,按如下公式计算各溶液对DPPH自由基的清除率[17]。以式样的质量溶度对DPPH自由基清除率作图,得到DPPH自由基清除率为50%的所需要样品的质量浓度为IC50。
DPPH自由基清除率(%)=1-(A-A1)/A0
式中:A0为溶剂空白对照吸收度;A1为样液与溶剂混合后的吸光度;A为样液与DPPH自由基溶液混合后的吸光度。各组平行测定3次,取平均值。
1.2.6 板栗壳棕色素的色谱分离纯化 板栗壳棕色素第一次反相制备条件:色谱柱Unitary C18(250×20 mm i.d.,10 μm),以(A)0.2% FA(v/v)水-(B)0.2% FA(v/v)甲醇为流动相;梯度洗脱:0~5 min,20% B,5~40 min,20~72% B,流速为20.0 mL/min;检测波长为245 nm;进样量为800 μL。
板栗壳棕色素7个组分的第二次反相制备条件:色谱柱采用Unitary C18(250×20 mm i.d.,10 μm),流速为20.0 mL/min。流动相、梯度洗脱条件、检测波长、进样体积和样品浓度见表1。表中流动相A1为水,B1为乙腈,C1为甲醇;A2为0.01% TFA(v/v)水,B2为0.01% TFA(v/v)乙腈;A3为0.1% FA(v/v)水,B3为0.1% FA(v/v)乙腈。

表1 棕色素中7个组分的第二次反相制备液相条件Table 1 2nd Prep-RPLC conditions of 7 fractions in brown pigment
1.2.7 化合物结构鉴定 板栗壳棕色素中化合物的质谱测定采用负离子模式;化合物的核磁共振1H谱和13C谱采用超导傅里叶变换核磁共振波谱仪AVANCE Ⅲ 500完成,氘代试剂为DMSO-d6或CD3OD。
1.3 数据处理
采用Excel 2010软件(Microsoft Corporation)进行统计分析,Origin 8.6专业版(Electronic Arts Inc)软件作图。
2 结果与分析
2.1 板栗壳棕色素的光谱特性
板栗壳棕色素采用紫外可见分光光度计进行全波长扫描,发现棕色素的水溶液在276 nm处具有最大吸收峰,并随着波长增加,其吸收值下降(图1),这与张捷莉等[7]对50%乙醇提取出的板栗壳棕色素的紫外光谱特征一致。板栗壳棕色素的红外谱图具有典型的多酚类物质的特征(图2)。在3409.9 cm-1存在由v O-H对称伸缩振动产生的宽而强的特征吸收峰,1383.5 cm-1存在羟基δ O-H面内弯曲振动产生的吸收峰,说明板栗壳中的化合物存在酚羟基。2929.9 cm-1是亚甲基上v C-H反对称伸缩振动引起的吸收峰。1613.3、1521.6和1446.8 cm-1主要是苯环上v C=C骨架振动产生的吸收峰和亚甲基δ C-H上面内弯曲振动产生的吸收峰[18]。这结果与Yao等[19]对板栗壳3种不同极性提取部位的红外表征结果十分相似,说明多酚类物质为板栗壳中的主要成分。
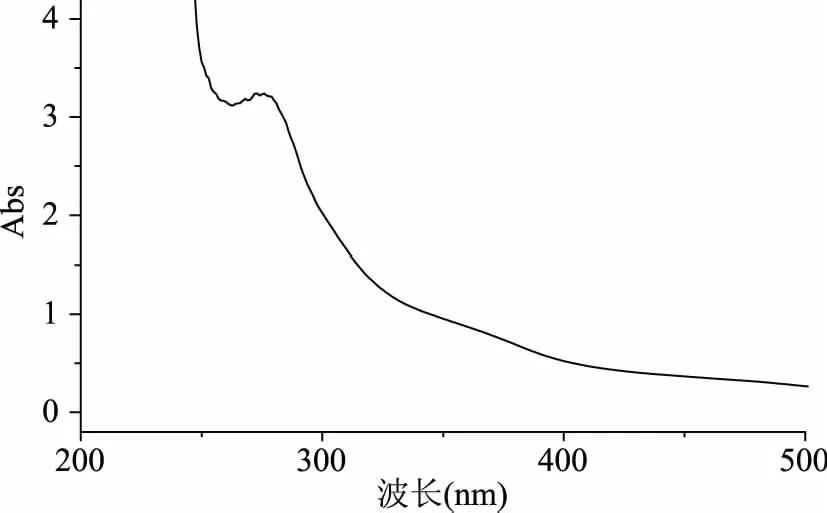
图1 板栗壳棕色素全波长扫描图谱Fig.1 Full wavelength scanning spectra of brown pigment from Castanea mollissima Blume
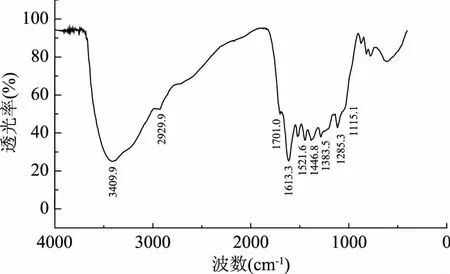
图2 板栗壳棕色素红外光谱图Fig.2 IR spectra of brown pigment from Castanea mollissima Blume
2.2 板栗壳棕色素中总多酚、多糖和蛋白质含量
板栗壳棕色素中多酚、多糖和蛋白质的含量分别采用了Folin-Ciocalteu法、苯酚-硫酸显色法和BCA法,测定得到三者含量分别为42.35%、13.75%和8.08%。所得的标准曲线、相关系数、线性范围等信息如表2。
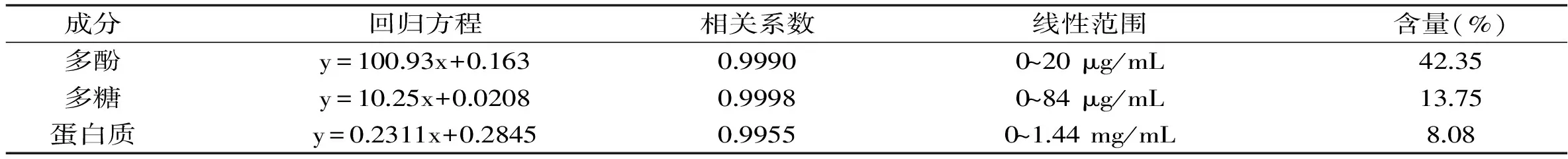
表2 板栗壳棕色素中多酚、多糖和蛋白质的含量测定结果Table 2 Results of content determination of polyphenol,polysaccharide and protein in brown pigment of Castanea mollissima Blume shell
表2中板栗壳棕色素的含量测定结果说明,多酚类物质是棕色素中的主要成分,与红外光谱分析结果一致。同时,多糖和蛋白的含量也较高,三者含量加合为64.18%,是板栗壳棕色素中的主要物质。于此同时,含量测定的结果对于板栗壳棕色素中化学成分的分离纯化也提供了指导。为消除大分子物质和糖类物质对于后续色谱分离纯化的各种不利影响,简化其分离过程,采用了专门的前处理方法进行去除。
2.3 板栗壳棕色素对DPPH自由基的清除能力
多酚类物质是植物体内的重要二次代谢产物,其酚羟基结构特别是邻位酚羟基很容易被氧化为醌类物质,从而消耗了周围环境中的氧,减少了组织中氧化反应的发生,这就使得多酚类物质具备较强的抗氧化活性和清除体内自由基的能力。经过实验研究,已经证实了多酚类物质含量较为丰富的葡萄籽、红枣等均具有较强的抗氧化活性。为测定板栗壳棕色素的抗氧化活性,本文采用DPPH自由基清除法。从图3中可以看出,板栗壳棕色素表现出较强的抗氧化活性,棕色素对DPPH自由基的清除能力随着剂量的增加而增强,存在明显的剂量-效应关系。当浓度达到1 mg/mL时,对DPPH自由基的清除率达到了91.96%。经计算,板栗壳棕色素的半抑制浓度(half maximal inhibitory concentration,IC50)为0.44 mg/mL。
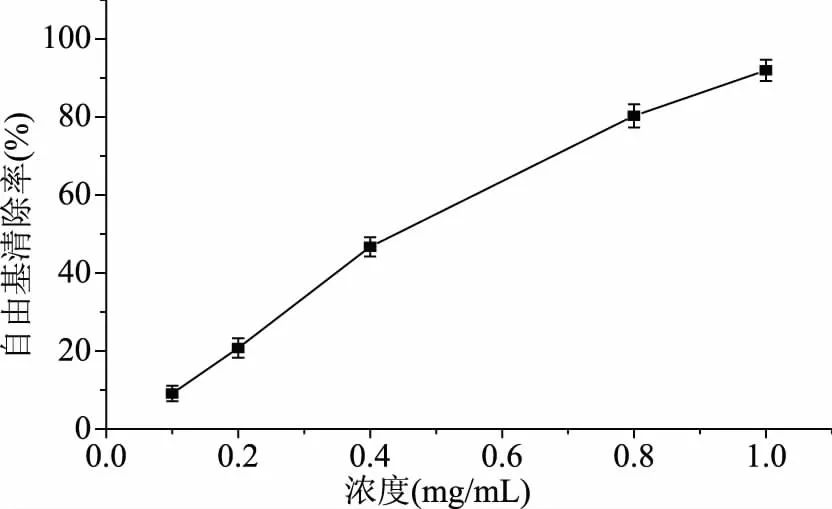
图3 板栗壳棕色素清除DPPH自由基能力Fig.3 Ability of scavenging DPPH free radical of the brown pigment
2.4 板栗壳棕色素的分离纯化
板栗壳棕色素组成复杂,为简化样品,本文以板栗壳棕色素中的小分子次级代谢产物为分离目标,建立提取和前处理方法。采用甲醇提取、超滤(5000 Da)和反相固相萃取处理,分别去除其中的大分子和强极性组分,得到以小分子为主的砖红色粉末状固体。
板栗壳色素的第一次反相制备的色谱图见图4。可以看出,棕色素中的小分子物质十分复杂,表现在不仅组成复杂,而且相对含量上差异也较大,这为分离纯化带来了困难。第一次制备将样品按照色谱峰分离为12个组分(Fr.1~Fr.12)。随后按照各个组分的质量和复杂程度,挑选Fr.2-Fr.8这7个组分进行进一步分离。如Fr.4的组成简单,仅包含两个分离度较好的色谱峰。以这两个色谱峰为分离目标,采用连续进样的方式进行色谱峰收集(图5),最终从Fr.4得到两个高纯度化合物(化合物4和5,纯度见图6)。

图4 板栗壳棕色素的第一次反相制备色谱图Fig.4 First preparative RPLC chromatograms of brown pigment from Castanea mollissima Blume shell
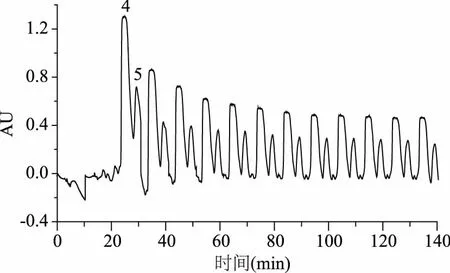
图5 4号组分的第二次制备色谱图Fig.5 Second preparative HPLC Chromatograms of Fr.4

图6 10个化合物的纯化制备过程Fig.6 Purification and preparation of 10 compounds
2.5 板栗壳棕色素的化学成分鉴定
从板栗壳棕色素中分离鉴定了10个多酚类化合物,各个化合物的编号及来源见图6所示。采用峰面积归一化法计算表明化合物的纯度均达到90%以上。采用高分辨质谱和核磁共振技术对这些化合物的结构进行表征,其化合物结构鉴定如下:
化合物1:ESI-MS m/z:109.0[M-H]-;1H-NMR(600 MHz,CD3OD)δ:6.95(1H,t,J=7.8 Hz,H-5)6.27(1H,s,H-2)6.25(2H,s,H-4,6);13C-NMR(150 MHz,CD3OD)δ:159.7(C-1,3),131.0(C-5),107.8(C-4,6),103.6(C-2)。以上波谱数据与文献[20]对照基本一致,故鉴定该化合物为Resorcinol(间苯二酚)。
化合物2:ESI-MS m/z:167.0[M-H]-;1H-NMR(600 MHz,CD3OD)δ:7.42(2H,m,H-2,6),6.85(1H,m,H-5);13C-NMR(150 MHz,CD3OD)δ:199.6(C=O),153.1(C-4),145.9(C-3),127.2(C-1),122.7(C-6),116.1(C-5),115.6(C-2),66.1(CH2)。以上波谱数据与文献[21]对照基本一致,故鉴定该化合物为2-hydroxy-3′,4′-dihydroxyacetophenone(2-羟基-3′,4′-二羟基苯乙酮)。
化合物3:ESI-MS m/z:109.3[M-H]-;1H-NMR(600 MHz,DMSO-d6)δ:6.72(2H,m,H-3,6),6.60(2H,m,H-4,5);13C-NMR(150 MHz,DMSO-d6)δ:145.4(C-1,2),119.4(C-4,5),115.8(C-3,6)。以上波谱数据与文献[22]对照基本一致,故鉴定该化合物为Catechol(邻苯二酚)。
化合物4:ESI-MS m/z:137.3[M-H]-;1H-NMR(600 MHz,DMSO-d6)δ:9.69(1H,s,CHO),7.27(1H,dd,J=2.0,10.0 Hz,H-6),7.24(1H,d,J=2.0 Hz,H-5),6.91(1H,d,J=8.0 Hz,H-2);13C-NMR(150 MHz,DMSO-d6)δ:191.0(CHO),152.3(C-4),145.9(C-3),128.7(C-1),124.5(C-6),115.5(C-5),114.2(C-2)。以上波谱数据与文献[23]对照基本一致,故鉴定该化合物为Protocatechualdehyde(原儿茶醛)。
化合物5:ESI-MS m/z:183.4[M-H]-;1H-NMR(600 MHz,DMSO-d6)δ:6.93(2H,s,H-2,6),3.73(3H,s,-CH3).13C-NMR(150 MHz,DMSO-d6)δ:166.9(C=O),145.1(C-3,5),139.2(C-4),119.7(C-1),108.9(C-2,6),52.1(-CH3)。以上波谱数据与文献[24]对照基本一致,故鉴定该化合物为3,4,4-trihydroxy-benzoic acid methyl ester(没食子酸甲酯)。
化合物6:ESI-MS m/z:151.1[M-H]-;1H-NMR(600 MHz,CD3OD)δ:2.48(3H,s,CH3),6.81(1H,d,J=7.5 Hz,H-3),7.41(1H,m,H-6).13C-NMR(150 MHz,CD3OD)δ:199.7(C=O),156.2(C-5),146.3(C-2),130.6(C-1),123.6(C-4),116.0(C-6),115.8(C-3),26.2(COCH3)。以上波谱数据与文献[25]对照基本一致,故鉴定该化合物为2,5-dihydroxyacetophenone(2,5-二羟基苯乙酮)。
化合物7:ESI-MS m/z:197.4[M-H]-;1H-NMR(600 MHz,CD3OD)δ:7.6(1H,dd,J=1.6,8.3 Hz,H-6),7.55(1H,d,J=1.6 Hz,H-2),6.87(1H,d,J=8.2 Hz,H-5),3.94(3H,t,J=6.2 Hz,OCH3),3.91(2H,s,H-3′),3.17(2H,t,J=6.2 Hz,H-2′).13C-NMR(150 MHz,CD3OD)δ:199.8(C-1′),153.5(C-4),149.2(C-3),130.8(C-1),124.9(C-6),116.9(C-5),112.0(C-2),59.1(C-3′),56.5(OCH3),41.8(C-2′)。以上波谱数据与文献[26]对照基本一致,故鉴定该化合物为β-hydroxypropiovanillone(β-羟丙基香草酮)。
化合物8:ESI-MS m/z:167.4[M-H]-;1H-NMR(600 MHz,DMSO-d6)δ:7.34(1H,d,J=2.1 Hz,H-2),7.30(1H,dd,J=2.1,8.2 Hz,H-6),6.79(1H,d,J=8.2 Hz,H-5),3.3(3H,s,H-8).13C-NMR(150 MHz,DMSO-d6)δ:166.1(-COOR),150.5(C-4),145.0(C-3),121.7(C-6),120.7(C-1),116.1(C-2),115.2(C-5),51.5(-CH3).以上波谱数据与文献[27]对照基本一致,故鉴定该化合物为protocatachuic acid methy ester(原儿茶酸甲酯)。
化合物9:ESI-MS m/z:163.1[M-H]-;1H-NMR(600 MHz,CD3OD)δ:7.59(1H,d,J=15.9 Hz,H-β),7.44(2H,d,J=8.5 Hz,H-2,6),6.77(2H,d,J=8.6 Hz,H-3,5),6.28(1H,d,J=15.9 Hz,H-α),13C-NMR(150 MHz,CD3OD)δ:171.6(-COOH),161.6(C-4),147.0(C-β),131.5(C-3,5),127.7(C-1),117.2(C-1),116.2(C-α).以上波谱数据与文献[28]对照基本一致,故鉴定该化合物为2-propenoic acid(对香豆酸)。
化合物10:ESI-MS m/z:193.1[M-H]-;1H-NMR(600 MHz,CD3OD)δ:7.58(1H,d,J=15.9 Hz,H-7),7.17(1H,s,H-2),7.05(1H,d,J=7.8 Hz,H-5),6.81(1H,d,J=8.2 Hz,H-4),6.30(1H,d,J=15.8 Hz,H-8),3.89(1H,s,-OCH3).13C-NMR(150 MHz,CD3OD)δ:171.6(C-9),150.4(C-3),149.4(C-4),145.4(C-7),127.9(C-1),123.9(C-6),116.4(C-2,5),111.6(C-8),56.4(-OCH3)。以上波谱数据与文献[29]对照基本一致,故鉴定该化合物为Ferulic Acid(阿魏酸)。
3 结论
板栗壳棕色素显示出很强的光谱特性。其紫外光谱在276 nm下有最大吸收,而红外光谱显示出明显的多酚类物质特征。采用紫外分光光度法测定发现,棕色素中总多酚、多糖和蛋白质的含量分别为42.35%、13.75%和8.08%,加合为64.18%,是棕色素中的主要成分。板栗壳棕色素也显示出较强的抗氧化活性,其抗氧化活性呈现明显的量-效关系,在1 mg/mL时,对DPPH自由基清除率可达91.96%,其IC50值为0.44 mg/mL。
为进一步探索板栗壳棕色素抗氧化活性的物质基础,同时有助于其毒理和安全评价,本研究采用色谱方法,通过两次制备,从棕色素中分离得到10个化合物,经过质谱和核磁确证均为多酚类化合物,经过文献调研,未见在关于板栗壳的文献中有过相关报道。
