经皮局灶冷冻消融治疗局限性前列腺癌17例疗效分析
2018-12-26钱苏波沈海波梁军号虞永江强上海交通大学医学院附属新华医院泌尿外科上海200092
钱苏波 齐 隽 沈海波 康 健 梁军号 虞永江 邬 喻 徐 丁 白 强上海交通大学医学院附属新华医院泌尿外科(上海 200092)
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一[1,2]。对于局限性前列腺癌,最主要的治疗方式是前列腺根治性切除术以及根治性放疗,但对于年老体弱及合并多种内科疾病的患者而言,存在无法耐受治疗及手术风险较大等问题。冷冻消融技术作为一种新兴的前列腺癌治疗手段,与传统前列腺根治性切除术相比,具有更少的并发症且治疗效果相似[3]。2017年EAU等多项指南[4]推荐,冷冻消融可用于治疗局限性前列腺癌,尤其是低危(PSA<10ng/mL,Gleason评分<7分,cT1-2a)及中危前列腺癌(PSA:10~20ng/mL或Gleason评分:7分或cT2b)。本研究采用经皮局灶冷冻消融治疗17例局限性前列腺癌患者,并分析其临床疗效。
资料与方法
一、临床资料
本研究收集2014年3月至2017年1月于上海交通大学医学院附属新华医院泌尿外科行经直肠超声引导经皮局灶冷冻消融治疗的局限性前列腺癌患者17例。所有患者均经系统性前列腺穿刺病理证实为前列腺腺癌,Gleason评分:6~8分。其中6分:4例,3+4分:4例,4+3分:7例,≥8分:2例(4+5分:1例,5+4分:1例)。患者平均年龄:(72.12±3.1)岁(范围:68~81岁),术前平均tPSA:(11.99±4.15)ng/mL(范围:6.59~21.05 ng/mL),平均前列腺体积:42.06±11.97mL(范围:25.39-75.61 mL)。患者术前cT分期如下,cT1:0例,cT2a:9例;cT2b:6例;cT2c:2例。术前其他影像学检查(盆腔MRI,肺部CT以及骨扫描等)均未见明显转移病灶。根据2017年EAU指南[4],将17例局限性前列腺癌患者分为3组,低危组((PSA<10ng/mL,Gleason评分<7分,cT1-2a)4例;中危组(PSA:10-20ng/mL或Gleason评分:7分或cT2b) 10例;高危组(PSA>20ng/mL或Gleason评分>7分或cT2c)3例(表1)。
二、入选标准
17例患者均同时满足以下条件:(1)经会阴前列腺系统穿刺病理证实为前列腺腺癌;(2)术前影像学检查无明显转移证据;(3)一般情况较差,无法耐受根治性手术但仍勉强能耐受全身麻醉,或不愿接受根治性手术或放疗;(4)治疗前充分告知患者及家属病情、其他治疗选择和冷冻消融治疗的风险与获益,经患者及家属同意并签署知情同意书; (5)不伴发其他系统恶性肿瘤;(6)不伴发感染性疾病;(7)不伴发血液系统疾病。
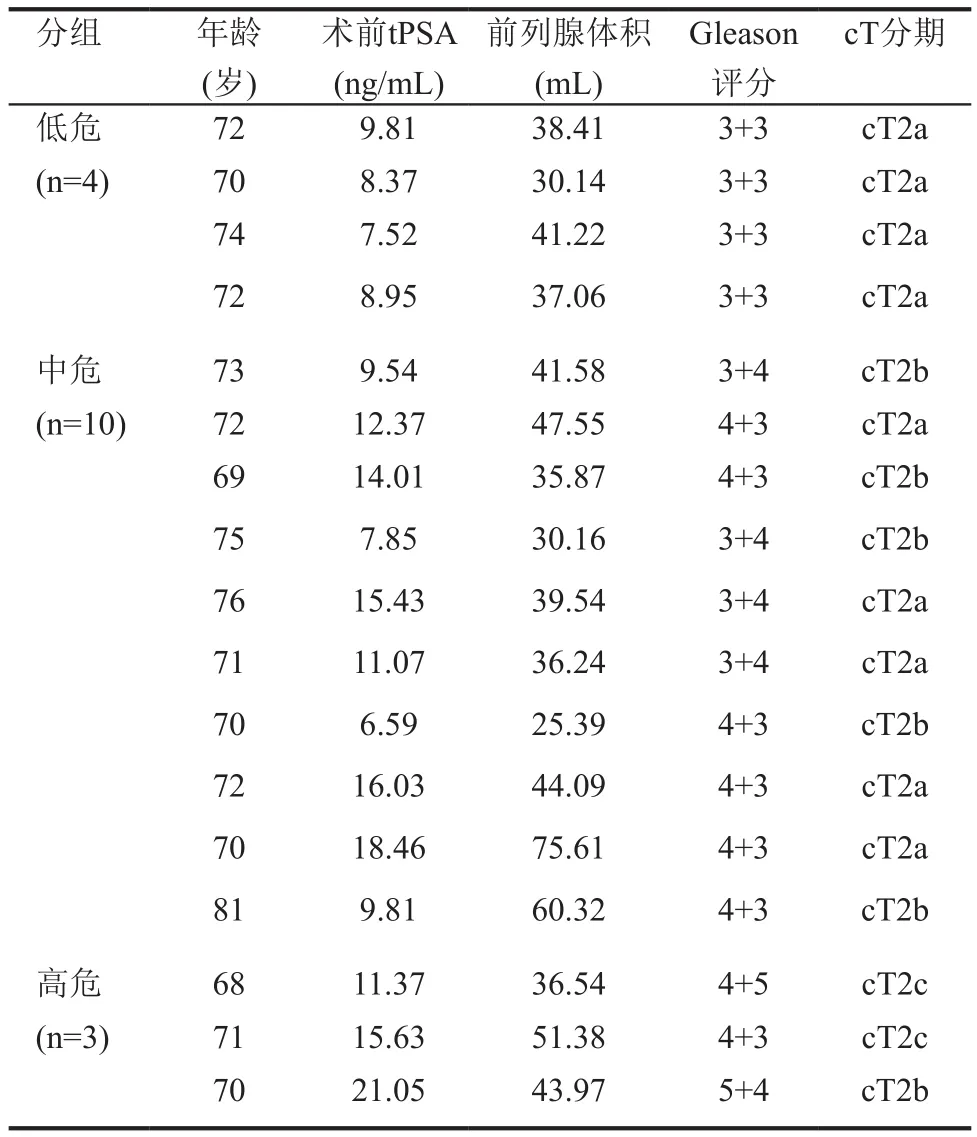
表1 17例局限性前列腺癌患者的一般资料

图1 靶向主要病灶的局灶冷冻模式图
三、手术方法
采用美国Cryo-care低温手术系统。全麻截石位,尿道内留置三腔导尿管,术中>42℃温水持续冲洗。所有患者均采用局灶冷冻的治疗模式(见图1),靶向冷冻主要病灶(index lesion,定义为:mpMRI至少两个层面可发现的病灶,且经病理证实该病灶为前列腺癌。且无论mpMRI能否发现病灶,均需满足以下要求之一:(1)若前列腺系统穿刺仅能发现Gleason评分为6分的病灶,则主要病灶指具有最长癌核长度的病灶(maximum cancer core length, CCLmax);(2)若前列腺系统穿刺发现不同Gleason评分的病灶,则主要病灶指的是Gleason评分最高的病灶)[5]。超声引导下经皮插入可变Ice Seed冷冻探针(氩氦刀)至前列腺主要病灶,接通高压氩气,10min后接通高压氦气升温至20℃左右,当前列腺复温后重复第二次冷冻消融,再次复温完成后,拔出探针。术后常规留置三腔导尿管,>42℃温水持续冲洗48h,术后7d拔除导尿管。术中采用经直肠超声实时监测冰球扩展动态,持续监测冰球距膀胱、尿道、直肠黏膜等的距离,以使冰球完全覆盖病灶并避免其冻伤周围脏器。
四、随访方法
术后1年内每3个月,以后每6个月复查PSA评估PSA变化情况。以连续3次PSA升高,且较最低值升高2ng/mL[6,7]作为生化复发的标准。术后1年复查前列腺mpMRI、胸片、腹部CT及骨扫描等影像学检查。
五、统计学分析
用SPSSl8.0软件包进行统计分析。正态分布的计量资料用平均数±标准差表示;组间比较采用t检验。非正态分布的计量资料用中位数±四分位间距表示;组间比较采用Mann-Whitney U检验。P<0.05定义为差异有统计学意义。
结 果
1 7例患者手术顺利,平均手术时间:(73.2±16.4)min,所有患者均未输血。术后7d拔除导尿管后所有患者尿控均满意,无尿潴留、尿失禁及尿道直肠瘘等并发症。术前有勃起功能的11例患者术后均保留勃起功能。患者平均住院(5.1±3.4)d。随访时间14~48个月。
17例患者tPSA由术前(11.99±4.15)ng/mL下降至最低值(1.78±1.73)ng/mL(范围:0.01~6.62ng/mL,P<0.0001)。其中,低危组由(8.66±0.96)ng/mL降至(1.23±1.01)ng/mL(P<0.0001);中危组由(12.12±3.83)ng/mL降至(1.41±1.27)ng/mL(P<0.0001);高危组由(16.02±4.85)ng/mL降至(3.72±2.84)ng/mL(P<0.0001)(表2)。

表2 经皮局灶冷冻消融治疗前后tPSA变化情况
所有患者术后1年复查前列腺mpMRI未见明显新病灶,且原可见病灶明显减小甚至消失。所有患者胸部X线、腹部CT及骨扫描均未见明显转移病灶。随访期内1例高危患者出现生化复发,PSA进展时间为26月。
讨 论
全腺体治疗一直被认为是局限性前列腺癌的标准治疗手段。但由于全腺体治疗可能会损伤包括尿道括约肌、血管神经束、直肠和膀胱等周围组织,因此,前列腺癌病灶的局灶治疗越来越引起临床医生的重视。前列腺癌局灶治疗指的是靶向治疗肿瘤病灶,同时尽可能保护正常前列腺组织以减少对周围组织的损伤[8,9]。
众所周知,前列腺癌是一种多灶性肿瘤,一个大的主要病灶通常会伴随着周围2~3个小的低级别病灶。有研究认为,前列腺癌的主要病灶通常伴有最高的Gleason评分,且与肿瘤的转移、进展等密切相关[10-12]。因此,有研究者提出,如果能精准的靶向治疗主要病灶可能获得与全腺体治疗相似的瘤控,且明显降低治疗相关的并发症。该假设目前已被普遍认可,且有较多的支持性研究报道[5,13-16],这些研究报道,靶向前列腺癌主要病灶的治疗,其无瘤率可达80%~90%,并且有非常低的治疗相关并发症。
前列腺癌局灶治疗的关键是患者的选择。关于局灶治疗的适宜人群,目前仍无明确标准。大部分研究认为,低危患者,尤其是Gleason评分<3+4以及预计生存时间≥10年的患者是合适人群[5]。本研究发现,相较于高危前列腺癌,低危及中危前列腺癌接受局灶冷冻消融治疗后可获得更明显的PSA控制。但本研究仅以PSA控制情况作为研究评价指标,缺乏长期关于总生存时间(overall survival, OS)及疾病特异性生存时间(disease speci fic survival, DSS)等长期随访数据,且本研究样本例数较少,随访时间较短,因此仍需更多多中心、大样本、随机对照临床研究以得出明确结论。
此外,冷冻治疗目前尚无普遍认可的治愈标准及生化复发标准。对于前列腺全腺体冷冻治疗,因为治疗过程中尿道被保护,可能导致部分产生PSA的前列腺组织未被破坏,因此冷冻治疗后PSA通常无法达到完全测不出的水平。连惠波等[17]推荐,在前列腺全腺体冷冻治疗中,以治疗后tPSA最低值<0.5ng/mL作为治愈标准。但是,在前列腺局灶冷冻治疗中,因有更多的腺体组织未被破坏,因此需要一个相对更高的PSA最低值作为局灶冷冻治疗的治愈标准。连惠波等[18]尝试以PSA最低值<1.0ng/mL作为前列腺局灶冷冻治疗的治愈标准,具有一定的参考意义。本研究相比较连惠波等报道的一侧叶腺体冷冻消融治疗保留了更多的前列腺组织,故以PSA最低值<1.0ng/mL作为前列腺局灶冷冻治疗的治愈标准似乎是不合理的,因此本文仅比较了冷冻治疗前后患者tPSA的变化情况。
前列腺局灶冷冻消融治疗是一项临床新技术,虽然文献报道具有安全、有效的特点,但目前在国内外尚未广泛开展。通过本研究的结果,表明针对主要病灶的局灶冷冻消融治疗有可能成为局限性前列腺癌的有效治疗手段。但仍需要更多多中心、大样本、随机对照临床研究加以评估。此外,关于冷冻消融治疗后治愈标准及生化复发标准也仍有待进一步商榷。
