靶向人MGMT的shRNA干扰载体的构建与鉴定
2018-12-26胡颖熹冯城婷梁容瑞石凤灵李大鹏
胡颖熹 冯城婷 陶 敏 梁容瑞 赵 晶 李 玮 史 悦 石凤灵 李大鹏
苏州大学附属第一医院肿瘤科,江苏苏州 215000
引言
O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)是一种存在于原核及哺乳类动物体内的独特的DNA损伤修复酶[1]。MGMT通过接受烷化损伤后DNA的O6位置上的烷基,修复损伤的鸟嘌呤的活性,保护正常细胞不受烷化剂的致癌作用影响,同时也消除烷化剂对肿瘤细胞的毒性杀伤作用[2-4]。因此,肿瘤细胞中的MGMT高表达可使肿瘤细胞对烷化剂耐药,而MGMT的低表达可增加正常细胞的致癌风险和肿瘤细胞对烷化剂的敏感性[5]。本实验拟通过RNA干扰技术构建人MGMT干扰质粒载体,为MGMT基因的功能研究提供实验工具。同时探索MGMT的DNA修复机制,为临床肿瘤个体化用药及联合用药提供思路。
1 材料与方法
1.1 细胞与试剂
人肝癌细胞株SMMC-7721购自南京凯基生物科技有限公司,内切酶(Fermentas);引物Oligo(Invitrogen合成);T4 DNA ligase(1U/µl)(EP0061, Fermentas);凝胶回收试剂盒(AP-GX_250, Axygen);GeneRuler DNA Ladder(SM0332, Fermentas);10×Oligo Annealing Buffer(46-8010,Invitrogen)。Trizol Reagent( 15596-026,Invitrogen);氯仿(AR,国药);异丙醇(AR,国药);75% 无水乙醇(AR, 国药);DEPC H2O(750024,Invitrogen);逆转录酶SuperScriptIII Reverse Transcriptase(R250-01, Invitrogen);荧光染料SYBR Green I(CS7561,Invitrogen);Rnase Inhibitor(E00381,Fermentas);oligo dT/Random primer/特异性引物(Oligo,Invitrogen);Platinum Taq DNA Polymerase(10966034,Invitrogen);100mM dNTPs(18427013,Invitrogen);pENTR-U6-shRNA-GFP载体(Invitrogen);胰酶(sigma)。
1.2 人MGMT基因shRNA干扰序列
根据hMGMT基因序列,参考既有文献[3]合成候选靶序列shMGMT1和shMGMT2,2对基因序列如表1。

表1 人MGMT基因RNA干扰序列
1.3 重组质粒载体构建
上述合成的每对寡核苷酸各取正义链和反义链各1 μL,使用T4 DNA ligase分别将退火产物与pENTR-U6-shRNA-GFP载体(图1)连接后,转化感受态细胞JM109,涂布含50 mg/L卡那霉素的LB琼脂平板筛选转化子,37℃过夜培养,挑取阳性克隆,利用Axygen质粒抽提试剂盒和方法抽提质粒,琼脂糖凝胶电泳初步鉴定大小后送测序。

图1 pENTR-U6-shRNA-GFP载体结构
1.4 MGMT干扰载体的鉴定
将连接产物转化感受态细胞,涂板过夜培养,从平板上随机挑选单菌落,通过菌落PCR鉴定。菌落PCR引物:F:ATGGACTATCATATGCTTACCGTA,R:CGTTACTATGGGAACATACGT。质粒成功插入序列后PCR产物应为259 bp左右,质粒未成功插入序列PCR产物应为200 bp左右。挑选PCR扩增鉴定正确的质粒载体进行全长测序鉴定。
1.5 细胞培养
使用DMEM完全培养基于37℃,5%CO2,95%湿度条件下恒温二氧化碳培养箱培养人肝癌SMMC-7721细胞,汇合率达 80%左右时用质量分数为0.25%的胰酶消化、传代,培养细胞呈单层贴壁生长。
1.6 细胞转染
选择细胞状态良好的SMMC-7721细胞,制成细胞悬液,接种至24孔板中。37℃培养过夜,使细胞融合至80%密度。转染前,更换为无血清Opti-MEM培养基。溶液A配制:吸取0.8μg质粒加入到50μL的Opti-MEM培养基,混匀。溶液B配制:吸取2μL lip2000加入到50μL的Opti-MEME培养基,室温静置5min。溶液A与溶液B混匀,室温静止20min。加入到细胞中。转染4~6h后,更换为完全培养基。转染后48 h荧光显微镜下观察,相同视野下计数绿色荧光细胞数与自然光下总细胞数百分比,取其平均值作为转染效率。
1.7 hMGMT shRNA干扰效率验证
1.7.1 Realtime-PCR检测hMGMT shRNA干扰效果用Trizol试剂提取转染后细胞总RNA,用逆转录酶SuperScriptIII Reverse Transcriptase(R250-01, Invitrogen)逆转录为cDNA,使用SYBR Green法用hMGMT引物和β-actin引物进行分管Realtime-PCR扩增,QPCR反应条件如下:
95 ℃ 2 min ;
(95 ℃ 10 secs,60 ℃ 30 secs,70 ℃ 45 secs)*40 循环 ;
72 ℃ 10mins。
根据数据分析肝癌细胞中MGMT的mRNA水平。所用两对引物如表2。

表2 人肝癌细胞MGMT基因及人β-actin基因引物序列
1.7.2 Western blot检测转染后MGMT蛋白的表达 将转染后的SMMC-7721肝癌细胞分别加入1 mL RIPA及1 uL蛋白酶抑制剂,4℃下15 000 g离心5 min,离心收集上清液,BCA法检测蛋白质含量。按1:4比例加上样缓冲液。样品经SDS-聚丙烯酰胺凝胶电泳后,330 mA,20 min转至PVDF膜上,50 g/L脱脂奶粉室温封闭3 h,依次加入1:1000稀释的鼠抗人MGMT、β-Actin一抗4℃孵育过夜,l:5 000稀释的HRP标记的羊抗鼠二抗室温孵育2 h,TBST洗膜3遍,TBS洗膜第四遍,加1 mL发光液,暗室曝光。
1.8 统计学分析
采集数据以均数±标准差表示,SPSS 20.0统计软件进行t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 重组质粒PCR鉴定结果
经PCR扩增,琼脂糖凝胶电泳鉴定,shRNA1和shRNA2阳性菌检产物可在200bp和300bp间见到一条特异性条带,而且无其他非特异性扩增带。根据PCR电泳结果(图2,本次选取的克隆编号分别为1-5、2-3,挑取阳性菌落,提取质粒分别命名为pENTR-U6-iMGMT1-5、pENTRU6-iMGMT2-3。
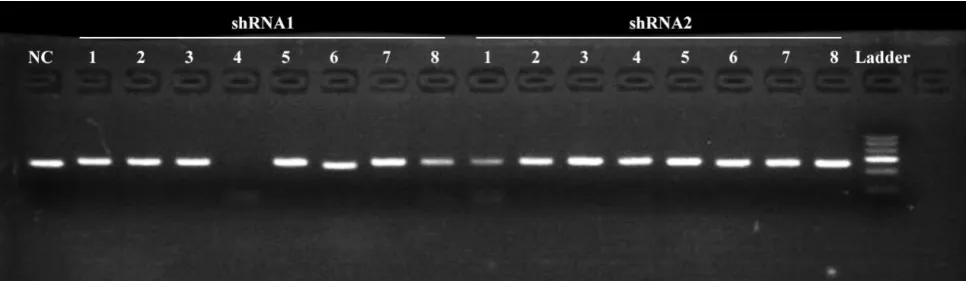
图2 PCR菌检电泳图谱
2.2 shRNA重组载体的测序鉴定
经基因测序验证,MGMT基因的RNAi质粒载体的插入序列与设计序列完全一致(见图3、图4)。

图3 pENTR-U6-iMGMT1-5测序结果
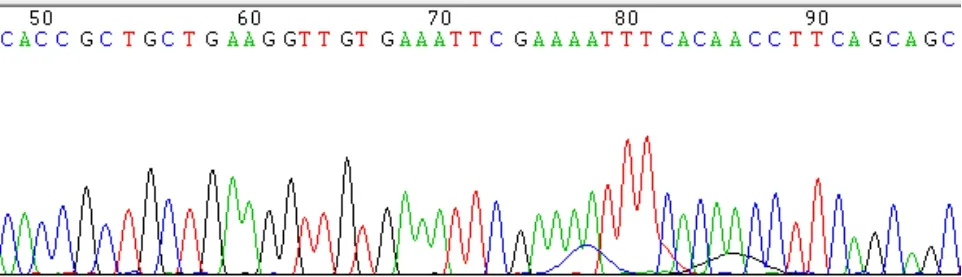
图4 pENTR-U6-iMGMT2-3测序结果
2.3 质粒转染
将重组质粒pENTR-U6-iMGMT1-5,pENTR-U6-iMGMT2-3及空白质粒分别转染SMMC-7721肝癌细胞,相应分为iMGMT1组、iMGMT2组以及NC组。转染48h后进行荧光显微观察。荧光下,iMGMT1组、iMGMT2组及NC组均出现绿色荧光,而未转染的SMMC-7721无绿色荧光,表示质粒均成功转染入SMMC-7721肝癌细胞中,如图5。

图5 各组SMMC-7721细胞48小时后的绿色荧光和光镜照片
2.4 干扰载体对肝癌细胞MGMT基因表达的影响
Realtime PCR法以β-actin为内参检测转染48小时后各组肝癌细胞中MGMT mRNA的相对表达量,计算得出shRNA1组和shRNA2组干扰效率依次为(56.4±0.75)%,(63.5±1.34)%,表明shRNA1组和shRNA2组与NC组合和KB组相比,MGMT基因mRNA量明显降低,差异有统计学意义(P <0.05),如图 6。

图6 各组肝癌细胞MGMT mRNA的相对表达量
提取转染48 h后的六孔板每孔细胞总蛋白。用抗MGMT抗体进行Western blot和化学发光显色(图7)可见,RNAi后和KB、NC组相比MGMT的蛋白表达水平明显下降, shRNA2组蛋白表达下降最明显。

图7 各组肝癌细胞MGMT 蛋白表达
3 讨论
人MGMT基因是一种特异性针对烷化剂引起的损伤进行修复的DNA修复基因,位于人常染色体10q26.3,分子量为170kd,编码含207个氨基酸的蛋白质,其第四外显子中的半胱氨酸残基为烷基受体,为蛋白酶的活化位点[6]。MGMT在肿瘤产生和肿瘤预防中都有着重要的意义,许多化疗药物攻击DNA的O6位置上的鸟嘌呤,从而达到损伤DNA的效果,MGMT将烷基从烷基化的鸟嘌呤上转移到一个半胱氨酸残基上,这个过程是发生在MGMT内的,导致了DNA结构上受损的鸟嘌呤部分恢复,并伴随产生不可逆的MGMT自身泛素化和灭活[7-11]。现已有研究证实在人类细胞系、异种移植物模型及MGMT转基因小鼠中,MGMT可对抗烷化剂的细胞毒性作用,起到保护细胞的作用[12-13]。转基因小鼠的实验数据表明,较高水平的MGMT表达显著地保护特定的靶细胞不受烷基化的N-亚硝基化合物致癌作用的影响,且转基因小鼠体内的MGMT表达具有组织特异性[14]。肝脏在所有人类肿瘤中有着最高的MGMT活性[15]。烷化剂类细胞毒药物通过与细胞内DNA共价结合发生烷化反应而诱导细胞死亡,是临床上应用较广泛的抗肿瘤药物,其治疗效果受DNA修复蛋白功能的影响。Baer等人研究发现肿瘤组织中的高水平MGMT与烷化剂耐药有关[16]。因此MGMT启动子甲基化水平的检测可以辅助烷化剂耐药患者的合理用药,同时这类患者可合并MGMT抑制剂实现合并用药,从而提高临床肿瘤化疗效果[17]。截至目前为止,MGMT与化疗的关系及其耐药机制大多是在脑胶质瘤中探讨的,且已有文献证实在缺乏MGMT表达的恶性脑肿瘤中,使用烷化剂全身化疗是有效的,并且可以改善预后[18]。但是,至今未有文献证明MGMT与肝癌的耐药是否相关及其具体机制为何。既有文献以及前期的实验结果提示较高水平的MGMT表达可能是导致肝癌细胞对很多烷化作用药物耐药的原因,但仍需更多研究对其加以验证。
本实验通过RNAi构建肝癌细胞MGMT干扰质粒载体,抑制肝癌细胞中MGMT的表达。结果显示所构建的两个质粒均十分有效地抑制了肝癌细胞中MGMT的表达,对后续研究烷化作用类药物对肝癌细胞的杀伤作用提供了一个有效的工具,为从 DNA 损伤修复途径促进化疗药物抗肝癌作用提供新的思路。
