消瘀降脂胶囊对高脂饮食诱导的高脂血症兔模型的降脂作用及相关机制研究
2018-12-25龙俊科赵水平
龙俊科 赵水平
(中南大学湘雅二医院心内科,湖南 长沙 410011)
消瘀降脂胶囊是由丹参和山楂提取物组成的复方中药,于2006年取得新药证书。由丹参水溶性总酚酸和山楂总三萜酸2个有效成分,按一定比例混合组成。丹参近千年来广泛应用于治疗心血管疾病。丹参水溶性总酚酸是从丹参中提取的各种酚酸类化合物的总和,是丹参主要的有效部位,其成分有:丹参素,迷迭香酸,紫草酸,原紫草酸、丹参酚酸A、B等,早期的药理实验充分证明了丹参的某些提取物具有明确的降低血脂作用[1]。山楂是蔷薇科山楂属的植物,为我国的特产果树。山楂干燥成熟的果实,具有消食、健胃、行气、散瘀、化浊、降脂等作用,尤其是在消化系统、心脑血管系统、血脂调节、糖代谢等方面均具有较强的药理作用[2]。前期的研究表明,消瘀降脂胶囊可显著降低高脂血症动物血脂水平,具有明显的治疗作用[3]。本研究从预防的角度出发,通过高脂血症兔模型,观察消瘀降脂胶囊预防给药对高脂血症形成的影响以及药理作用机制,包括对胆固醇吸收、胆固醇合成、甘油三脂合成、脂蛋白代谢、脂代谢调控受体等靶点的作用。
1 材料与方法
1.1 实验动物 新西兰兔,8周,雄性,40只,体质量2.0~2.5 kg,由长沙天勤生物有限公司提供,生产许可证号:SCXK(湘)-2014-0010,合格证号:43006700880329;动物自由摄食、饮水;基础饲料与高脂饲料分别由上海福贝宠物用品有限公司以及北京科澳协力有限公司提供;动物饲养温度为23~26℃,相对湿度为50%~60%。
1.2 药品与试剂 消瘀降脂胶囊(0.25 g/粒,贵阳新天药业股份有限公司生产提供,国药准字:Z20060427,批号:150502),阿托伐他汀片(20 mg/片,辉瑞制药有限公司生产,国药准字:H20051407),生理盐水配制成各使用浓度。血清甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇 (high density lipoprotein in cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein in cholesterol,LDL-c)测试盒均为日本和光纯药工业株式会社(wako) 产品。酶联免疫法(Enzyme linked immunosorbent assays,ELISA)测定兔血清、肝脏以及小肠中相关蛋白或蛋白受体含量;ELISA试剂盒由上海酶连生物科技有限公司提供;组织匀浆液使用BCA法进行蛋白定量,所用试剂盒由上海碧云天生物科技有限公司提供。
1.3 主要仪器 脱色摇床(江苏海门其林医用仪器厂),全自动酶标仪(Thermo Fisher公司),手持式匀浆机(杭州米欧仪器有限公司)等、TGL16M低温离心机(中国)、CD1200全自动生化分析仪(美国)。
1.4 动物造模、分组与给药 健康雄性新西兰兔40只,以普通饲料喂养观察1周后进入实验,记录体质量和进行基线血脂分析。随机选为5组,即正常组、模型组、阿托伐他汀组、消瘀降脂胶囊组以及联合给药组,每组8只。其中正常组每日予以120 g/d的基础饲料喂养,其余各组以高脂饲料120 g/d喂养至第12周。从第2周开始,进行药物干预,其中正常组与模型组每日予以30 mL生理盐水灌胃,阿托伐他汀组每日灌胃给予2 mg/kg阿托伐他汀,消瘀降脂胶囊组每日灌胃给予以100 mg/kg消瘀降脂胶囊,联合给药组则同时给予2 mg/kg的阿托伐他汀以及100 mg/kg的消瘀降脂胶囊,连续给药10周,采集血样,肝脏以及小肠。
1.5 检测指标与方法
1.5.1 体质量 给药前(0周)和第8周以及第12周时称取各组新西兰兔的体质量。
1.5.2 血脂水平 采血前,动物均已禁食不禁水12 h以上。第0周时耳缘静脉采血;第12周时,以戊巴比妥100 mg/kg耳缘静脉深度麻醉后,股动脉采血。血样在室温自然凝固,低温离心(4℃,3000r/min,离心10min),分离血清,采用全自动生化仪配以相应的试剂盒,检测血清TC、TG、HDL-c以及LDL-c。
1.5.3 血清相关蛋白酶活性 类似于血脂水平检测,采血前动物均已禁食不禁水12 h以上。第12周时,以戊巴比妥100 mg/kg耳缘静脉深度麻醉后,股动脉采血。血样在室温自然凝固,低温离心(4℃,3000 r/min,离心10 min),分离血清,使用ELISA法测定血清LDL-R、Apo-B100、SREBP2以及PCSK9活性。
1.5.4 肝脏相关蛋白酶活性 第12周时,以戊巴比妥100 mg/kg耳缘静脉深度麻醉后,取肝组织液氮冻存备用;临用前,按照每10 mg组织加100μL的PBS进行组织匀浆;取匀浆液上清,使用BCA法进行蛋白定量,随后使用ELISA法测定匀浆液中HMGCG、PPAR-γ、LPL以及MTP含量。
1.5.5 小肠相关蛋白酶活性 第12周时,以戊巴比妥100 mg/kg耳缘静脉深度麻醉后,取小肠组织液氮冻存备用;临用前,按照每10 mg组织加100μL的PBS进行组织匀浆;取匀浆液上清,使用BCA法进行蛋白定量,随后使用ELISA法测定NPC1L1含量。
1.6 统计学方法数据均使用SPSS 21进行统计分析,以均数±标准差表示。对数据进行正态性检验,常规方差分析后post hoc两两比较(方差齐则LSD检验,方差不齐则Dunnett’s检验)。双侧检验,P〈0.05视为差异具有统计学意义。
2 结果
2.1 一般情况 各组实验兔体质量呈生理性增长,各组体质量在开始时(0周)、第8周和第12周,组间无显著差异 (P〉0.05)。
2.2 各组血脂指标比较 给药前10周,各组各项血脂指标均无明显差异(P〉0.05),见表1、2。第12周检测结果发现,与正常组相比,各组TC、TG以及LDL-c均显著升高(P〈0.001),提示高血脂造模成功;第12周,与模型组比较,各给药组的TC和LDL-c水平均显著降低(P〈0.05),说明消瘀降脂胶囊与阿托伐他汀均可以显著性地预防高血脂形成。第12周,与阿托伐他汀组相比,消瘀降脂胶囊组TC、TG、HDL-c以及LDL-c水平均无显著性差异(P〉0.05),提示在临床剂量下,阿托伐他汀与消瘀降脂胶囊的预防降脂药效相当;同时,与阿托伐他汀组相比,第12周,联合给药组的TC以及LDL-c显著性降低(P〈0.05),见表2。实验结果提示,相比于阿托伐他汀单用,消瘀降脂胶囊联合用药可进一步加强预防新西兰兔的高血脂形成。

表1 给药前(0周)血脂基础水平 (x±s,mmol/L)

表2 给药10周后血脂水平 (x±s,mmol/L)
2.3 胆固醇吸收相关酶活性 如图1所示,与正常组(8350.7±259.1) pg/g相比,模型组动物小肠组织中胆固醇吸收相关NPC1L1蛋白含量 [(11727.8±356.5) pg/g]显著升高(P〈0.001);相比于模型组,各给药组动物小肠组织中的NPC1L1蛋白含量均有所降低,其中消瘀降脂胶囊组 [(9717.6±455.8) pg/g]以及联合给药组[(7951±668.9) pg/g] 均有显著性差异 [(9717.6±455.8) vs.(11727.8±356.5),P〈0.01;(7951±668.9)vs.(11727.8±356.5),P〈0.001]。

图1 各组新西兰大白兔小肠中NPC1L1蛋白含量
2.4 胆固醇和甘油三脂合成以及水解相关酶活性 如图2所示,与正常对照组(60.77±9.60) pg/g相比,模型组动物肝组织中胆固醇合成相关的HMGCR蛋白含量[(117.21±5.05) pg/g] 显著升高 (P〈0.001);与模型组[(117.21±5.05) pg/g] 相比,阿托伐他汀组 [(91.25±7.05) pg/g]、消瘀降脂胶囊组 [(93.56±7.99) pg/g] 以及联合给药组 [(66.82±9.40) pg/g]的动物肝脏HMGCR蛋白含量均显著性降低 (P〈0.01、P〈0.05以及P〈0.001);与正常组 [(6.87±0.47) ng/mL]相比,高脂饮食喂养的模型组 [(12.32±0.62) ng/mL]血清中LPL显著性降低(P〈0.001);与模型组 [(6.87±0.47) ng/mL] 相比,各给药组动物的血清LPL水平均有所增加,其中消瘀降脂胶囊组 [(8.83±0.55) ng/mL]以及联合给药组 (11.12±0.39) ng/mL具有显著性差异 (P〈0.05以及P〈0.001)。

图2 各组新西兰大白兔体内HMGCR以及LPL蛋白含量
2.5 脂蛋白代谢相关酶活性 如图3所示,与正常组的血清[PCSK9 (1064.02±45.81) pg/mL]、Apo-B100[(1055.37±99.94) pg/mL] 以及肝脏MTP[(1439.47±191.70) pg/g]相比,高脂饮食喂养的模型组动物血清PCSK9[(1439.47±191.70) pg/mL]、Apo-B100[(1560.89±187.73) pg/mL]以及肝脏MTP[(9870.54±457.44) pg/g] 的含量均显著性升高(P〈0.05);与模型组相比,各给药组动物肝脏中MTP含量均无显著性变化(P〉0.05)。对于血清PCSK9含量而言,与模型组 [(1439.47±191.70) pg/mL]相比,除阿托伐他汀组呈显著性升高外 [(1996.67±96.64)pg/mL],P〈0.05,其他给药组同样无显著性的变化(P〉0.05);对于血清Apo-B100,与模型组 [(1560.89±187.73)pg/mL]相比,各给药组均有所下降,其中阿托伐他汀组 [(1063.39±66.50) pg/mL]以及联合给药组 [(1113.67±54.31) pg/mL]具有显著性差异 (P〈0.05);对于血清LDLR,相比于正常组,模型组动物呈显著性降低(P〈0.001),而经过药物连续干预10周后,与模型组相比,血清LDLR水平均有所增加,其中消瘀降脂胶囊组以及联合给药组具有显著性差异(P〈0.05以及P〈0.001)。
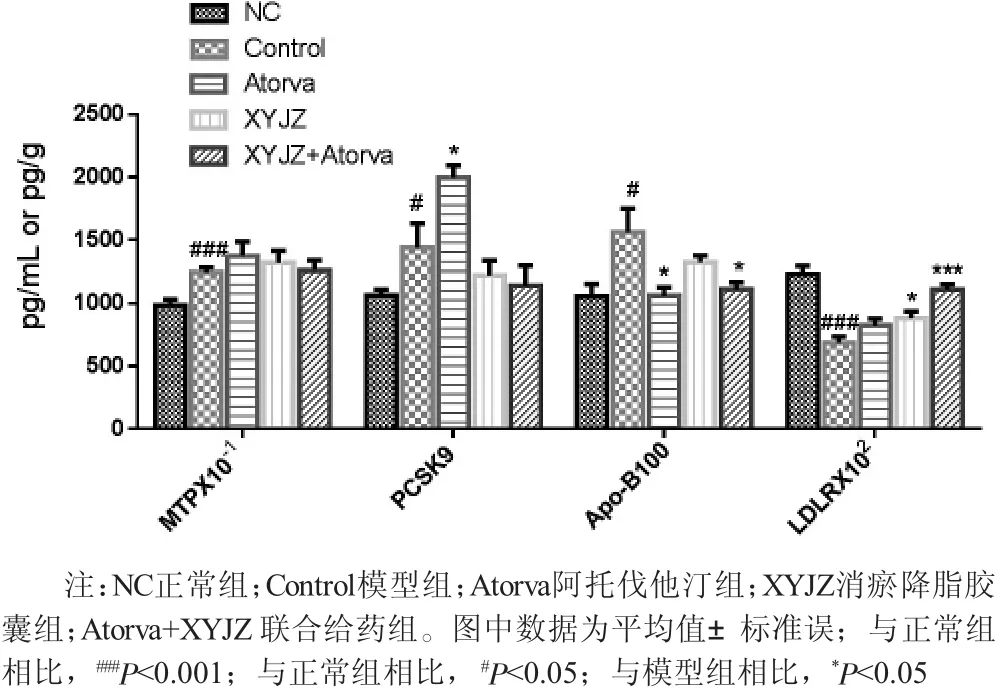
图3 各组新西兰大白兔体内MTP、PSCK9、LDLR、Apo-B100含量
2.6 脂质代谢间接或直接调控相关受体活性 如图4所示,与正常对照组的血清PPAR-γ [(43.28±2.21) ng/mL]以及肝脏相比SREBP-2[(607.86±52.89) pg/g] 模型组动物的血清PPAR-γ [(52.92±2.41) ng/mL] 以及肝脏SREBP-2[(445.18±24.72) pg/g] 分别呈现显著性升高与降低(P〈0.05)。相比于模型组,各给药组动物的血清PPAR-γ水平均呈显著性升高(P〈0.05); 相比于模型组,各给药肝脏SREBP-2水平有所增加,其中阿托伐他汀组以及联合给药组均具有显著性差异(P〈0.05)。
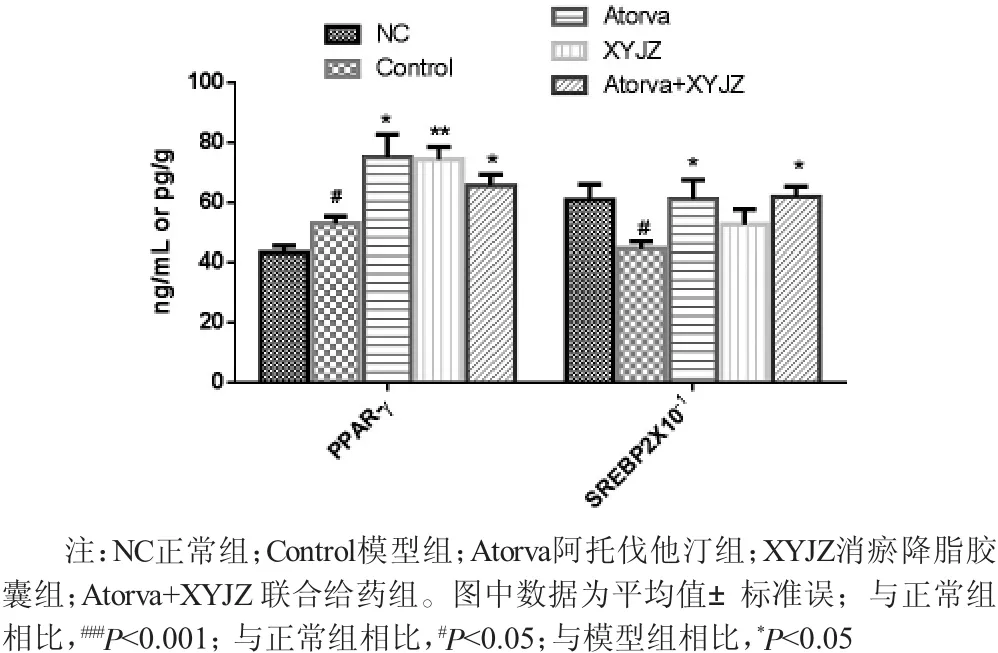
图4 各组新西兰大白兔体内PPAR-γ以及SREBP2含量
3 讨论
血脂水平检测结果说明消瘀降脂胶囊与阿托伐他汀均可以显著性的预防高血脂形成,且在临床剂量下,阿托伐他汀与消瘀降脂胶囊药效相当;同时,相比于阿托伐他汀单用,与消瘀降脂胶囊联合用药可进一步强化预防新西兰兔的高血脂形成。实验结果,提示消瘀降脂胶囊与阿托伐他汀在预防高血脂的形成上具有一定的协同作用,且可能存在不同的作用机制;人体内的脂质来源包括吸收外源性脂质以及自身合成。HMGCR、鲨烯合酶、羊毛甾醇合酶等参与了体内胆固醇合成,其中HMGCR是合成胆固醇的限速酶[4]。本研究结果表明,类似于阿托伐他汀,消瘀降脂胶囊类可以直接通过抑制HMGCR的活性,从而抑制内源性的胆固醇合成,发挥高血脂的预防作用。
LPL为TG水解酶,参与了血液循环系统以及内源性的TG代谢,在富含TG的脂蛋白如极低密度脂蛋白(very low-density lipoprotein,VLDL) 以及乳糜微粒 (Chylomicron,CM)的分解及HDL的形成中发挥关键作用。LPL活性降低或表达缺陷可导致CM及VLDL降解障碍,引起高TG及低HDL水平,最终诱发形成高脂血症[5]。本实验研究表明,不同于阿托伐他汀,消瘀降脂胶囊可以通过提高LPL的活性,降低TC及TG的含量,进而发挥降脂作用。消瘀降脂胶囊对LPL的活性影响可能与其主要成分之一山楂提取物的药理作用有关。张曼等[6]同样报道了山楂可影响高脂血症小鼠血脂的形成以及脂蛋白酯酶和肝酯酶活性,结论与本研究结果基本一致。另一方面,本实验结果也说明了LPL活性降低可能是高脂血症的发病机制之一,增强LPL活性可能是治疗高脂血症的一个有效途径;本研究结果提示消瘀降脂胶囊预防高脂血症的形成可能与提高LPL酶的活性有关。
胆固醇不仅可以自身合成,也可以来源于食物。NPC1L1是一种跨膜蛋白,主要表达在肝细胞和空肠上皮细胞上。NPC1L1参与了体内胆固醇的吸收、重吸收以及胆酸的分泌。有研究表明,小鼠的NPC1L1基因被敲除后,其血浆中TC含量减少了近86%[7]。不仅如此,NPC1L1还与参与了胆汁酸中TC的重吸收,研究发现肝细胞中的NPC1L1表达升高时,胆汁中TC含量下降而血浆中TC水平将上升[8]。NPC1L1由于其在胆固醇的吸收和重吸收中的重大药理作用,已成为降低血浆TC药物开发的重要靶点。本研究发现,动物经高脂饮食喂养后小肠NPC1L1水平显著性增加,与蒙广星等[9]的研究结果基本一致。更值得注意的是,不同于阿托伐他汀,动物经消瘀降脂胶囊预防给药后,体内的NPC1L1的活性显著性下降,提示消瘀降脂胶囊可能通过抑制NPC1L1的活性,影响胆固醇吸收、胆酸的分泌和重吸收,从而降低血浆胆固醇水平,发挥高血脂的预防与治疗作用。
参与血浆中转运、脂蛋白分泌、消除等体内代谢过程有关的酶或蛋白主要有MTP、PCSK9、ApoB100等,通过改变它们的活性或功能可调节HDL浓度[10];MTP作为脂质转运蛋白与VLDL以及载脂蛋白B(ApoB)的形成与组装密切有关,其主要分布在肝细胞内质网以及小肠细胞上。研究表明,MTP抑制剂可降低LDLR缺陷导致的高脂血症兔子血浆中VLDL和LDL含量[11]。因此,MTP被认为是调节血脂的重要靶点。本研究发现高脂饲料诱导喂养一段时间后,动物体内的MTP水平显著性升高,与文献报道基本一致,但无论阿托伐他汀、消瘀降脂胶囊还是药物联用,动物体内的MTP水平均没有显著性的变化,提示消瘀降脂胶囊的发挥降脂药效可能不是直接作用于MTP的表达。
ApoB包括Apo B48以及Apo B100是形成CM、LDL等必须条件,在维持此类脂蛋白的功能中发挥重要的理化作用。血浆中ApoB的水平与TC的含量呈正向相关性,ApoB水平的高低可间接地反映出TC的含量。有研究证明,通过抑制ApoB的活性或者表达,可显著性的降低血浆中TC水平[12]。本研究发现,高脂喂养后,动物肝组织中的ApoB100显著性的提高,而消瘀降脂胶囊药物干预后,ApoB100水平则显著性的下降,提示消瘀降脂胶囊具有调节载脂蛋白代谢的作用,这可能与消瘀降脂胶囊中的丹参提取物的药理活性有关,本文的研究与闵连秋等的临床研究结果也颇为相似[13]。
与apoB-100相似,PSCK9在脂代谢方面同样也发挥着重要的生理作用。研究表明,PCSK9基因突变或多态性可以导致动脉粥样硬化心血管疾病(arteriosclerotic cardiovascular disease,ASCVD) 风险升高。人体内LDL-c的清除与代谢依赖于LDL颗粒与LDLR的结合效率。当LDL-c被清除后,LDLR从LDL颗粒中被释放出来,会再次循环至肝细胞表面重新参与LDL-c的清除。在上述过程中,由肝细胞分泌的PCSK9会进入血液循环中,从而与LDLR结合,形成“PCSK9-LDLR”复合体。该复合体诱导LDLR进入溶酶体中被降解,使血浆中LDLR的含量或浓度降低,使得LDL-c的清除效率受限,最终导致LDL-c的水平升高。有趣的是,本文的研究结果提示:相比于模型组,阿托伐他汀组动物体内的LDLR和PCSK9的水平被同时上调,而后者则潜在地限制了阿托伐他汀降低LDL-c浓度的药理作用,这一现象被称为他汀药物的“矛盾效应”或“6%效应”其原因是由于他汀类药物抑制细胞内HMGCR的活性,抑制细胞内胆固醇的合成,当细胞内胆固醇水平降低至某一水平时,固醇调节素结合蛋白2(SREBP-2) 被激活[14]。本研究提示,相比于模型组,阿托伐他汀给药10周后,兔子肝脏中SREBP-2的水平显著性升高,被激活的SREBP-2进一步上调了LDLR,PCSK9和HMGCR的表达。同时,本研究发现,消瘀降脂胶囊不同于阿托伐他汀,尽管药物干预给药10周,组织中HMGCR的水平显著性降低,但SREBP-2以及PCSK9却未发现显著性升高,说明消瘀降脂胶囊对HMGCR的抑制作用,但尚不足以激活SREBP-2信号通路,不会进一步导致PCKS9上调,从而避免产生类似他汀药物的“矛盾效应”,这可能是消瘀降脂胶囊与阿托伐他汀在降脂药理作用上的本质区别之一。
过氧化物酶体增生激活受体(包括PPAR-α、PPAR-γ以及PPAR-β/δ三种亚型) 在脂质代谢的整体调控中具有重要作用。研究发现PPARγ被激活后,可以促进巨噬细胞的胆固醇外排,抑制泡沫细胞形成;同时,PPARγ还具有抑制炎性因子、促进巨噬细胞凋亡、抑制内皮素的释放等作用,使血管扩张、改善血管张力发挥其抗AS的作用继而减轻斑块的形成,可能对AS的防治具有重要意义[15]。本研究发现,消瘀降脂胶囊预防给药10周,可以显著性提高动物体内PPARγ的表达,提示其抗AS形成作用,与前期的研究基本一致。
4 结论
消瘀降脂胶囊与阿托伐他汀均可以显著性地预防高血脂形成,且在临床剂量下,阿托伐他汀与消瘀降脂胶囊的预防降脂药效相当;相比于阿托伐他汀单用,与消瘀降脂胶囊联合用药可进一步加强预防新西兰兔的高血脂形成;消瘀降脂胶囊的降脂作用是多靶点的,包括LDL-R、HMG-CoA还原酶、NPC1L1、PPAR-γ、LPL等,通过对相关酶或者脂质代谢受体的调控,抑制小肠中的胆固醇吸收以及肝脏细胞内胆固醇合成,并加强血液中甘油三酯水解等药理作用;消瘀降脂胶囊与阿托伐他汀的降脂药理机制既有相似之处,也有不同之处;其不同在于,消瘀降脂胶囊的细胞内胆固醇合成抑制作用不会激活SREBP2信号通路,不会因此产生类似于他汀的降脂“矛盾效应”。
