腹膜透析患者血清骨硬化蛋白水平及其影响因素分析
2018-12-21史欣辉陈建平杨晓萍
史欣辉,陈建平,杨晓萍
(1.石河子大学医学院第一附属医院 肾内科,新疆 石河子 832000;2.福建省三明市第二医院 肾内科,福建 永安 366000)
近些年有研究发现,血管钙化是终末期肾脏病患者心血管疾病的独立危险因素,严重影响其预后[1-2]。慢性炎症、钙磷代谢紊乱、25-羟维生素D[25-hydroxyvitamin D, 25(OH)D]、骨代谢异常及某些细胞因子均为血管钙化的影响因素[3]。骨硬化蛋白是骨细胞来源的主要因子,其在骨细胞活性的调节中起重要作用。申磊等[4]研究发现维持性血透患者骨硬化蛋白明显升高,其与腹主动脉钙化呈正相关。然而,在腹膜透析(peritoneal dialysis, PD)患者中类似研究较少。本研究旨在探讨PD患者血清骨硬化蛋白与腹主动脉钙化的关系。
1 资料与方法
1.1 一般资料
选取2016年1月—2017年1月于新疆石河子大学医学院第一附属医院和石河子人民医院肾内科就诊的尿毒症行PD患者(透析年龄>3个月)78例作为实验组。患者经腹部平片证实存在腹主动脉钙化的,同时选取同期于新疆石河子大学医学院第一附属医院和石河子人民医院健康体检群众78例作为对照组。实验组中男性41例,女性37例;年龄34~72岁,平均(53.05±6.76)岁。对照组中男性44例,女性34例;年龄39~68岁,平均(52.15±7.18)岁。排除标准:①PD联合血液透析患者;②持续卧床PD患者;③合并恶性肿瘤、严重感染及严重肝脏疾病;④急性心力衰竭、心肌梗死患者;⑤精神异常无法配合患者;⑥合并结缔组织疾病患者。两组患者年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。所有入组对象均签署知情同意书,并经医院医学伦理委员会批准。
1.2 方法
1.2.1 基本资料收集 患者均采用询问病史的方式,收集其年龄、性别、既往史及用药史等;采用水银柱血压计测量其左上臂血压;着单衣赤脚测量其身高、体重,并计算BMI。同时抽取空腹肘静脉血,采用全自动生化检测仪测量相关生化指标,包括肝肾功能、血脂及全段甲状旁腺激素(intact parathyroid hormone, PTH),同时根据MDRD公式计算肾小球滤过率(estimating glomerular filtration rate, eGFR)。
1.2.2 腹部平片 患者均行腹部平片检查,由2位有经验的放射科医师进行盲法阅片,根据KAUPPILA等[5]报道的半定量积分法,计算其腹主动脉钙化积分(abdominal aortic calcification score, AACS),AACS总分为0~24分。AACS分值≤4分为轻度钙化或无钙化,共有17例患者作为轻度钙化组;AACS分值5~15分为中度钙化,共有35例患者作为中度钙化组;AACS分值≥16分为重度钙化,共有26例患者作为重度钙化组。
1.2.3 酶联免疫吸附实验检测血清成纤维细胞生长因子 -23(fibroblast growth factors-23, FGF-23)、25(OH)D及骨硬化蛋白水平 所有患者均空腹>8 h,抽取空腹肘静脉血5 ml,置于含EDTA的抗凝管中,室温放置30 min,4℃下以3 000 r/min离心15 min,留取上层血清置于冻存管中,存放于-80℃冰箱,待标本收集完毕后,统一采用酶联免疫吸附实验法检测血清FGF-23、25(OH)D及骨硬化蛋白浓度,试剂盒由英国Gene公司提供,严格按照说明书进行。
1.3 统计学处理
数据分析采用SPSS 20.0统计学软件,计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,方差分析两两比较采用LSD-t检验;计数资料以率(%)表示,比较用χ2检验;相关性分析采用Pearson法,骨硬化蛋白的影响因素采用多元逐步Logistic回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较
两组患者年龄、男性占比、血糖比较,差异无统计学意义(P>0.05);两组患者SBP、DBP、CREA、BUN、尿酸(uric acid, UA)、iPTH、血磷、骨硬化蛋白及FGF-23比较,差异有统计学意义(P<0.05),实验组较对照组升高。两组患者BMI、白蛋白(Albumin,ALB)、 三 酰 甘 油(Triglycerides, TG)、 总 胆 固 醇(total cholesterol, TC)、低密度脂蛋白(low density lipoprotein, LDL)、血钾、血钙、eGFR及25(OH)D比较,差异有统计学意义(P<0.05),实验组较对照组降低。见表1。
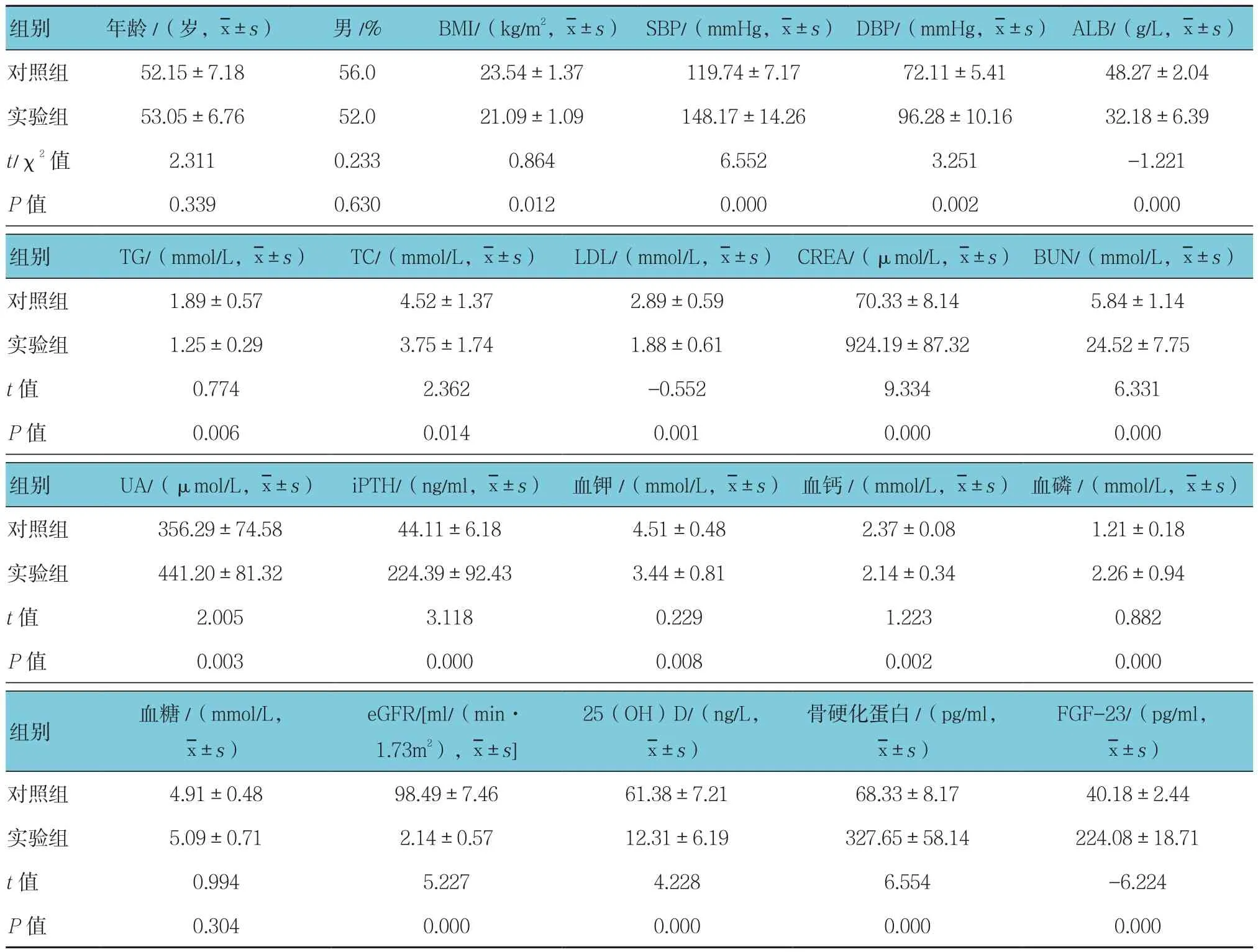
表1 两组患者一般临床资料比较 (n =78)
2.2 不同AACS组患者临床指标比较
3组患者血清骨硬化蛋白、FGF-23、iPTH、血磷、CREA、UA、SBP、DBP、25(OH)D、血钙及eGFR比较,差异有统计学意义(P<0.05)。见表2。
表2 不同AACS组患者临床指标比较 (±s)
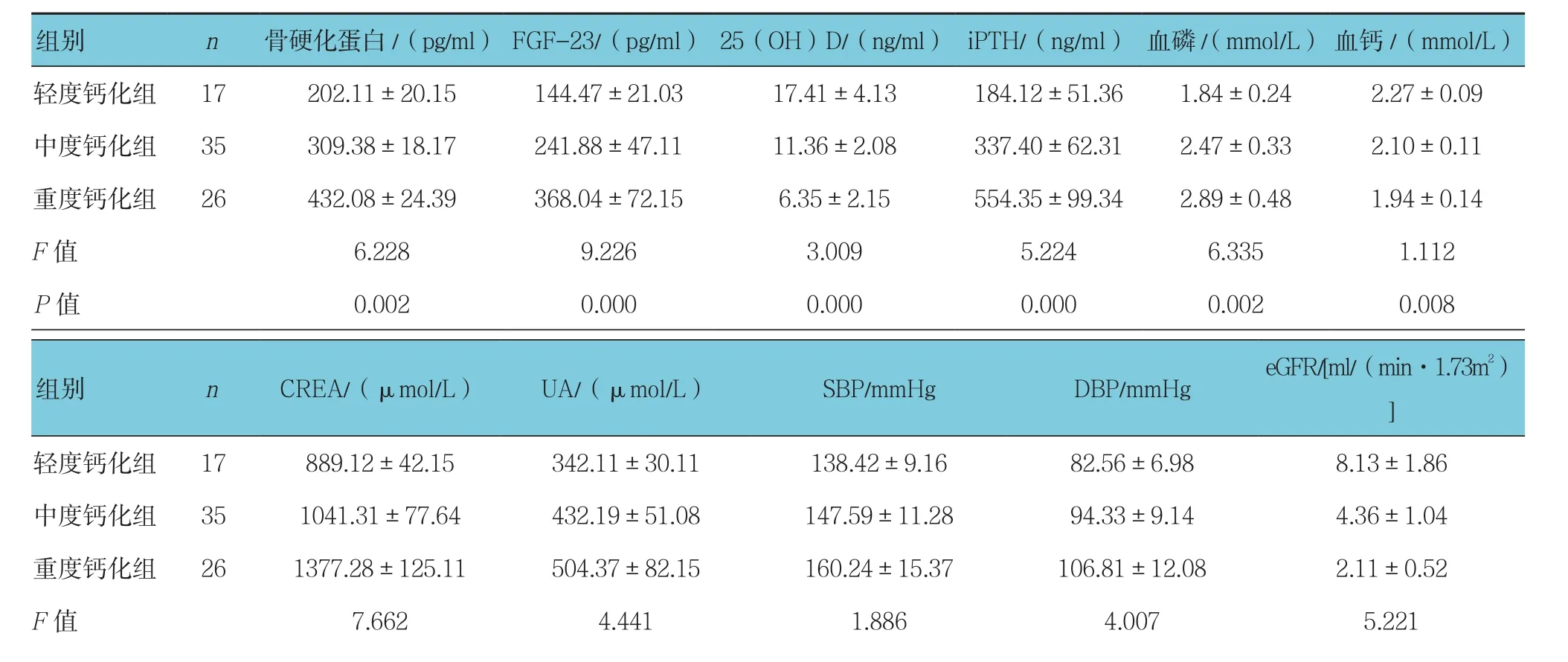
表2 不同AACS组患者临床指标比较 (±s)
轻度钙化组 17 202.11±20.15 144.47±21.03 17.41±4.13 184.12±51.36 1.84±0.24 2.27±0.09中度钙化组 35 309.38±18.17 241.88±47.11 11.36±2.08 337.40±62.31 2.47±0.33 2.10±0.11重度钙化组 26 432.08±24.39 368.04±72.15 6.35±2.15 554.35±99.34 2.89±0.48 1.94±0.14 F值 6.228 9.226 3.009 5.224 6.335 1.112轻度钙化组 17 889.12±42.15 342.11±30.11 138.42±9.16 82.56±6.98 8.13±1.86中度钙化组 35 1041.31±77.64 432.19±51.08 147.59±11.28 94.33±9.14 4.36±1.04重度钙化组 26 1377.28±125.11 504.37±82.15 160.24±15.37 106.81±12.08 2.11±0.52 F值 7.662 4.441 1.886 4.007 5.221
2.3 PD患者血清骨硬化蛋白相关因素分析
对PD患者进行Pearson直线相关分析,血清骨硬化蛋白与年龄、血磷、iPTH、FGF-23、AACS、SBP及CREA均呈正相关(P<0.05),与25(OH)D、血钙及eGFR均呈负相关(P<0.05)。见表3。
2.4 血清骨硬化蛋白的多元逐步Logistic回归分析
以骨硬化蛋白为因变量,以年龄、血磷、iPTH、25(OH)D、FGF-23、AACS、SBP、eGFR、 血 钙及CREA为自变量进行多因素逐步Logisitic回归模型(逐步回归法,α入=0.05,α出=0.10),AACS、eGFR、FGF-23、iPTH、血磷及25(OH)D是影响血清骨硬化蛋白的独立危险因素(P<0.05)。见表4。
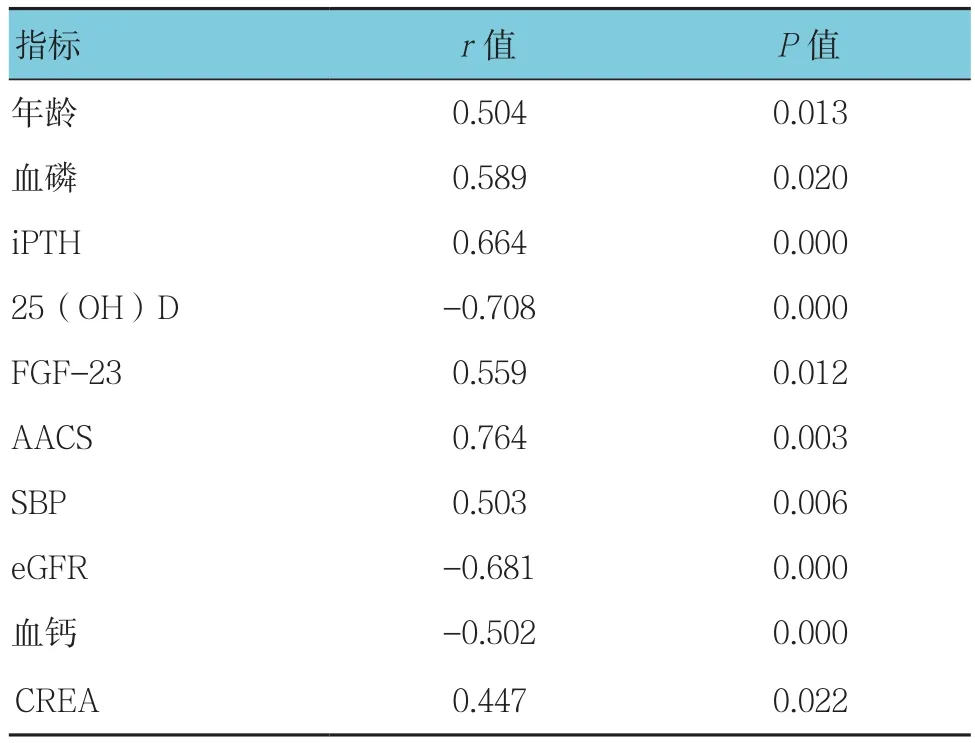
表3 PD患者血清骨硬化蛋白的相关性分析参数
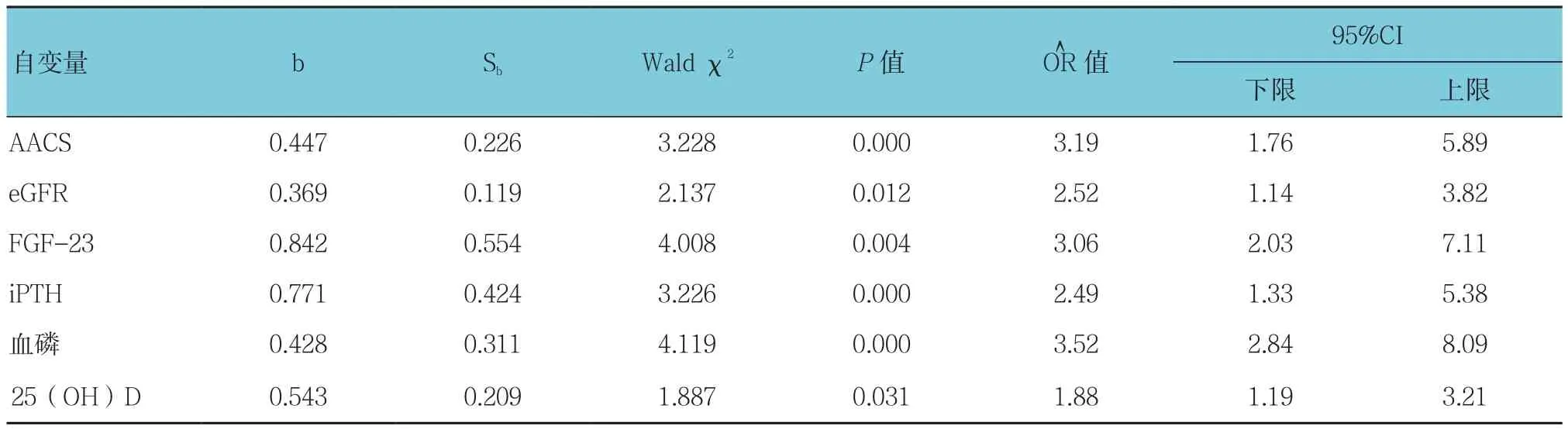
表4 血清骨硬化蛋白的Logistic回归分析参数
3 讨论
骨硬化蛋白是SOST基因编码,骨细胞分泌的一种分泌型糖蛋白,其作为WNT/β-catenin信号通路的阻滞剂,可参与骨-血管轴的调节,在血管钙化中起重要作用。近些年有研究表明,骨硬化蛋白存在于动脉硬化的斑块中,可能参与了动脉粥样硬化和血管钙化的发生、发展[6-7]。而对于尿毒症病人,国外相关研究均表明血清骨硬化蛋白与血管钙化相关[8-9]。目前对于骨硬化蛋白与血管钙化的关系仍然存在争议,且骨硬化蛋白参与血管钙化的具体机制尚不清楚。
有学者发现,循环中骨硬化蛋白水平较高者,其血管钙化的风险较低,证明了循环骨硬化蛋白可能是一种血管钙化的保护因素[10-11]。LEE等[12]研究发现血清骨硬化蛋白水平与主动脉瓣钙化严重程度呈负相关,Cox回归分析骨硬化蛋白水平与血管钙化程度呈负相关,且可独立作为血管钙化的决定因素,进一步表明了骨硬化蛋白可能是对抗血管钙化的保护性因素。REGISTER等[13]研究发现主动脉瓣膜钙化者血清骨硬化蛋白较健康群众升高,提示骨硬化蛋白可能是一种血管钙化的促进因素。本研究发现,与对照组比较,实验组骨硬化蛋白、FGF-23均明显升高,而25(OH)D水平明显降低,且随着腹主动脉钙化程度的增加,血清骨硬化蛋白水平亦增加,这与申磊、REGISTER等研究结果相一致[4,13]。表明骨硬化蛋白可能为血管钙化的促进因素,提示监测PD患者骨硬化蛋白水平可间接反映血管钙化程度。
综上所述,PD患者骨硬化蛋白较健康体检者升高,且其与AACS严重程度呈正相关,提示骨硬化蛋白可能为PD患者发生腹主动脉钙化的危险因素,其有望成为PD患者腹主动脉钙化的预测因子。笔者下一步将进行多中心、大样本的研究,并探讨骨硬化蛋白与PD患者发生血管钙化的机制。
