铅暴露时间对大脑皮质ATG5、Beclin1、LC3B表达的影响
2018-12-21卢北玲史剑飞周军
卢北玲,史剑飞,周军
(1.陕西省西安市中医医院 检验科,陕西 西安 710001;2.陕西省西安市儿童医院 检验科,陕西 西安 710003;3.中南大学湘雅医院 医学科学研究中心,湖南 长沙 410008)
铅是广泛存在于自然界的一种重金属,对中枢神经系统的损害是不可逆的[1]。铅暴露造成幼脑学习能力下降,但却鲜有文献解释成年人在铅暴露环境下的变化,以及不同时间的铅暴露对大脑功能的影响是否一致。文献报道主要集中在铅对脑海马区的损伤,很少对脑皮质功能的改变进行研究[1-3]。本实验将豚鼠在含铅环境暴露不同时间后,对皮质表达的自噬蛋白进行分析,为早期预防铅暴露危害提供理论基础。
1 材料与方法
1.1 实验动物
健康成年豚鼠,雌雄不限,体重400~500 g,SPF清洁级,由中南大学实验动物学部提供。全部实验动物在适应性饲养5~7 d后用于实验,分笼饲养,12 h昼/夜循环照明,自由饮食和饮水,室温(20±2)℃。
1.2 主要仪器与试剂
0.2%醋酸铅溶液(上海碧云天生物公司),ATG5(NB100-53818)、Beclin1(NBP1-00085)、LC3B(NB100-2220)购自美国Novus公司,多功能酶标仪(M200pro,奥地利Tecan 公司),石蜡包埋机(EG1150)、倒置显微镜(DM2000)购自德国Leica公司。
1.3 实验动物分组与处理
18只成年豚鼠随机分为4组:对照组(3只),以及铅暴露15、60和90 d组(每组5只)。对照组给予等量的生理盐水,铅暴露组用0.2%醋酸铅饮用水喂养豚鼠。喂养不同时间后对动物进行麻醉,断头取脑,立即放入4%多聚甲醛溶液中进行固定、脱水、石蜡包埋、切片。
1.4 免疫组织化学法
石蜡切片在烤箱烤干后,进行脱蜡及水化,用磷酸盐缓冲溶液(phosphate buffer saline, PBS)浸泡切片2、3次,5~10 min/次,用3% GS或10% HS封闭40 min,PBS洗3次,加入抗ATG5(1∶500)、Beclin1(1∶500)、LC3B(1∶500)4℃孵育过夜,次日用PBS洗3次,10 min/次,加入相对应的二抗(1∶400)室温孵育2 h,PBS洗3次,用DAB进行显色。在显微镜下观察,直到出现满意的颜色,脱水、封片、晾干后用普通倒置显微镜对大脑皮质区(根据海马区情况进行皮质区的视野选取,在拍照过程中选取海马周边的皮质区进行拍照,每张片子保持一样的脑皮质位置)进行拍片统计(不连续的3~5个视野)。
1.5 统计学方法
数据分析采用Graphpad prism 6.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同时间铅暴露后豚鼠脑皮质区ATG5的阳性表达比较
ATG5阳性表达在细胞质或细胞膜。对照组,以及铅暴露15、60和90 d组的ATG5阳性细胞数分别为(87.08±53.27)、(86.38±48.18)、(93.77±43.45)和(152.08±44.32)个/HP,经方差分析,差异有统计学意义(F=6.643;P=0.005)。进一步两两比较经LSD-t检验,铅暴露90 d组高于对照组(P<0.05);对照组与其余各组比较,差异无统计学意义(P>0.05)。结果表明,不同时间铅暴露后,ATG5有不同程度的升高,但铅暴露90 d组升高最明显,推测ATG5在铅暴露后早期可能起保护大脑组织的作用,而随着铅暴露时间的延长,ATG5蛋白表达更加明显,引起脑神经细胞的损伤。见图1、2。
2.2 不同时间铅暴露对豚鼠大脑皮质Beclin 1蛋白表达的影响
Beclin 1蛋白定位在神经元胞质或细胞膜。对照组,以及铅暴露15、60和90 d组的Beclin 1阳性细 胞 数 分 别 为(32.00±23.89)、(108.31±35.25)、(123.85±33.82)和(126.62±26.77)个/HP,经方差分析,差异有统计学意义(F=25.910;P=0.000)。进一步两两比较经LSD-t检验,对照组与其他组比较,差异有统计学意义(P<0.05);铅暴露15、60和90 d组组间两两比较,差异无统计学意义(P>0.05)。但是随着铅暴露时间延长,Beclin1阳性细胞数也升高,可见随着铅暴露时间延长,自噬蛋白Beclin1的表达升高。见图3、4。

图1 各组豚鼠脑皮质区ATG5的表达 (免疫组织化学法×200)

图2 各组豚鼠ATG5阳性细胞数比较 (±s)
2.3 慢性铅暴露下豚鼠大脑皮质LC3B的表达变化
脑皮质区自噬蛋白LC3B主要表达在细胞膜,阳性细胞呈现棕黄色。对照组,以及铅暴露15、60和90 d组的LC3B阳性细胞数分别为(59.38±12.18)、(103.46±33.96)、(107.38±70.27)和(118.08±38.91)个/HP,经方差分析,差异有统计学意义(F=7.575;P=0.002)。进一步两两比较经LSD-t检验,对照组与其他组比较,差异有统计学意义(P<0.05);铅暴露15、60和90 d组组间两两比较,差异无统计学意义(P>0.05),结果提示,铅饮用水可引起大脑皮质区LC3B升高。LC3B阳性表达与Beclin1的变化趋势一致。见图5、6。

图3 各组豚鼠脑皮质区Beclin1的表达 (免疫组织化学法×200)
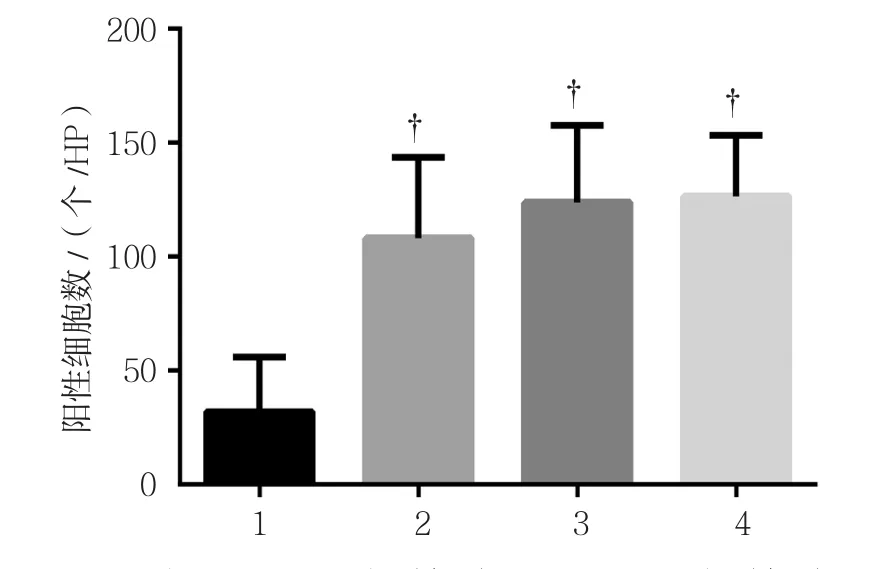
图4 各组豚鼠Beclin1阳性细胞数比较 (±s)
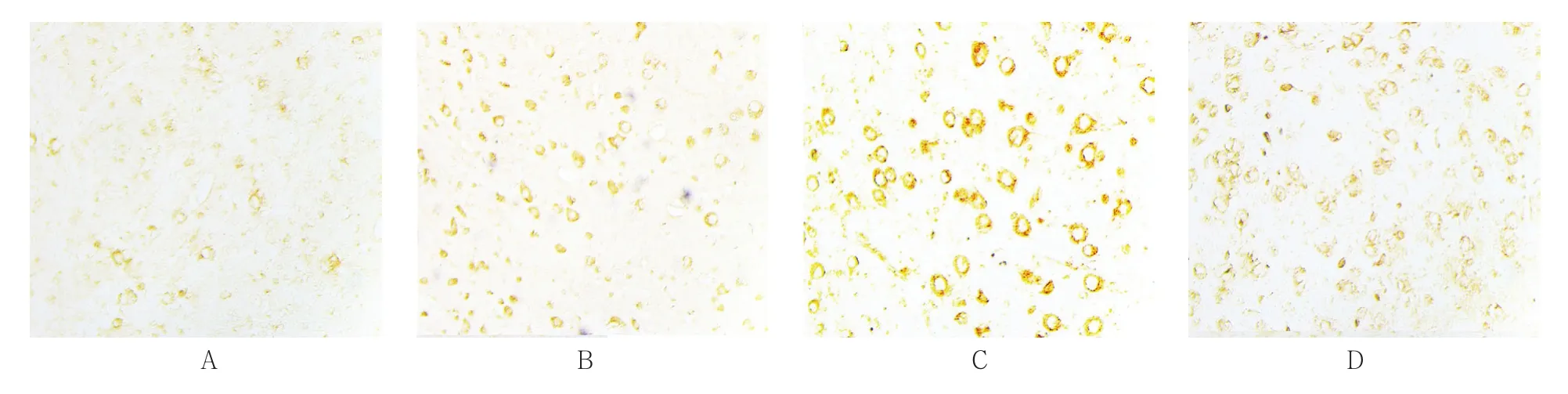
图5 各组豚鼠脑皮质区LC3B的表达 (免疫组织化学法×200)
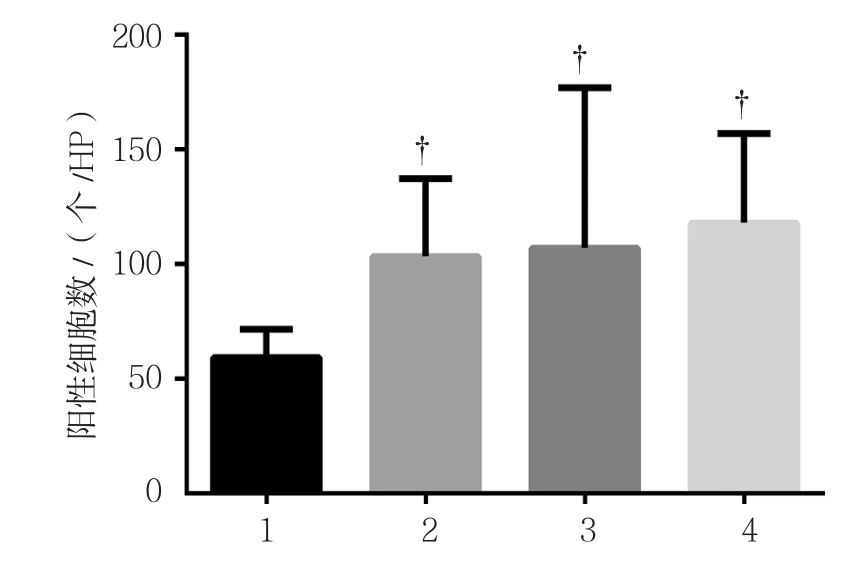
图6 各组豚鼠LC3B阳性细胞数比较 (±s)
3 讨论
人类铅暴露通常来自于水、空气及土壤污染,长期处在高铅环境中将会损害大脑发育,包括细胞增殖等,但是其具体作用机制并不清楚,仍然是亟待解决的健康问题[2]。铅具有很强的亲组织性和神经毒性,且血铅浓度升高是导致神经不可修复,以及儿童生理和行为障碍的关键原因。自噬水平升高可能是一种代偿性的保护效应,但在自噬反应超过某一阈值,表现为过度激活的情况下,会进一步损伤细胞器并促发自噬性细胞死亡[3]。自噬是真核细胞中广泛存在的降解系统,在自噬过程中,大部分胞质蛋白和损害的细胞器通过溶酶体聚集和降解,但是对应激和损伤的过度自噬反应会导致自噬性细胞死亡,说明自噬在组织细胞清除中起双刃剑的作用[4]。有研究指出,自噬是细胞死亡的诱发因素[5]。暴露于铅环境的动物与人脑组织中均可观察到老年斑和神经纤维缠结[6]。重金属铅仍是构成环境有毒物质的危险因素,但是没有研究指出铅是阿尔茨海默病或Tau蛋白形成的诱因。对年龄>65岁老人进行横向研究发现,血液中高水平铅组认知能力明显下降[7]。铅很容易通过胎盘屏障,尤其是鼠受孕期处于铅暴露环境中,会对子鼠的行为学发育造成不可逆的损害;在铅暴露停止后,这些行为学改变会继续持续很长时间,还可引起胆碱能系统的改变[8]。妊娠期或哺乳期接触铅会引起胎儿神经元氧化应激,导致大脑认知相关蛋白水平改变,且胎儿大脑发育过程中对毒性铅有易感性,导致新生的神经元增殖或神经元突触连接发生中断[9]。Beclin1可能在自噬和凋亡2种程序性细胞死亡中发挥调节作用[10]。
本实验中,豚鼠在不同时间铅暴露后ATG5、Beclin1和LC3B的表达水平较对照组升高,进一步说明大脑组织中自噬相关蛋白对神经元起调节作用。铁可降低动物血液和脑组织的铅浓度,在一定程度下对大脑具有保护性效应,可能是因为铅铁离子倾向于引起氧化性效应而不是神经中和效应[11]。在发育时期铅暴露可降低突触的可塑性,造成认知功能和行为学紊乱,这是早期生命铅暴露导致的最常见的效应,且铅暴露效应对负责空间记忆和理解的大脑海马区更易产生影响[12]。铅可促进原代大鼠近端肾小管细胞(proximal tubular, PT)中自噬溶酶体的聚集,且自噬蛋白的增多和溶酶体膜透化对肾小管细胞的凋亡抑制作用促进了铅的肾小管毒性[13]。自噬和细胞凋亡是细胞发展的2种结果,铅抑制PT细胞自噬的降解,然而自噬降解抑制剂加重铅诱导的细胞凋亡,自噬与凋亡的相互联系有助于进一步了解铅诱导的肾毒性的具体机制[14]。
在铅暴露环境中,女性更容易患阿尔茨海默症,所以需要进一步探索铅暴露对胚胎期小鼠引发的危险[15]。神经干细胞在大脑发育过程中扮演重要角色,铅可以阻断其功能,可能是铅诱导红系衍生的核转录因子2诱导依赖的转录性反应,导致分泌型磷蛋白1的上调[16]。自噬参与自噬溶酶体的形成,而且自噬溶酶体已经被广泛用于Caspase非依赖的细胞死亡通路,与大脑缺血再灌注损伤有关,而且干扰RNA介导的Beclin1表达下降减弱了大鼠的脑缺血损伤,这可能与
降低凋亡,促进神经再生有关,因此Beclin1的降低有助于改善中风患者的病情[17]。有研究证明,铅可能会损害人和动物的免疫系统,铅可诱导细胞氧化性应激,影响线粒体的动态平衡和自噬反应的发生,导致脾脏的免疫紊乱[18]。还有研究证实,在代谢应激的情况下,ATG7通过调节p53的活性来调节细胞周期和细胞活性[19]。但也有研究指出,大脑海马和皮质区的自噬标志物表达有明显区别,在氧糖剥得模型诱导后的早期,皮质区出现自噬反应但海马区无,且自噬抑制剂的使用阻断其诱发的谷氨酸释放效应[20]。本实验选取不同时间铅暴露后豚鼠的大脑皮质区,进一步探讨环境铅对成年鼠引发的自噬反应,对铅接触的早期预防提供实验依据。
