复发缓解型多发性硬化患者脑深部灰质核团铁沉积特征及与脑静脉血氧含量的相关性
2018-12-21刘铁利唐乐梅宋清伟刘宇卉苗延巍伍建林
刘铁利,唐乐梅,宋清伟,刘宇卉,苗延巍*,伍建林
(1.大连医科大学医学影像学院,辽宁 大连 116044;2.大连医科大学附属第一医院放射科,辽宁 大连 116021;3.大连大学附属中山医院放射科,辽宁 大连 116011)
多发性硬化(multiple sclerosis, MS)是一种与大脑灰白质及深部灰质核团多灶性脱髓鞘形成有关的中枢神经系统退行性自身免疫性疾病[1],临床上以复发缓解型MS(relapsing-remitting MS, RRMS)最常见。MS患者脑内病灶及灰质核团铁沉积较正常人增加[2-3],而脑血流量、脑组织氧摄取、脑静脉血流速度均下降[4-6]。本研究采用磁敏感加权成像(susceptibility weighted imaging, SWI)探讨RRMS患者脑深部灰质核团铁沉积的特点及其与脑静脉血氧含量的关系。
1 资料与方法
1.1一般资料 收集2013年3月—2015年6月于大连医科大学附属第一医院就诊的42例RRMS患者(RRMS组),男11例,女31例,年龄25~62岁,平均(37.9±14.2)岁,均为右利手。所有患者均符合2010年修订版McDonald标准[7]。同期选取年龄、性别与RRMS患者匹配的52名健康志愿者(对照组),男13例,女39例,年龄24~63岁,平均(37.4±11.7)岁,均为右利手。本研究获得大连医科大学附属第一医院医学伦理委员会批准,所有受检者均签署知情同意书。
1.2仪器与方法 采用GE Signa HDxt 3.0T超导型MR及头部8通道相控阵头线圈。以前后联合连线(AC-PC线)为扫描基线,扫描范围覆盖全脑。扫描参数:螺旋桨序列T2W,TR 5 000 ms,TE 119 ms,层厚7 mm;液体衰减反转恢复序列T2W,TR 8 600 ms,TE 125 ms,矩阵192×288,层厚6 mm,NEX 1;SWI,TR 53 ms,TE 40 ms,层厚2 mm,无层间距,FOV 240 mm×240 mm,矩阵512×512,NEX 1。总扫描时间约20 min。
1.3数据处理与测量方法 将原始数据传至GE AW 4.4工作站,应用Functool软件进行后处理获得到重建后SWI图像。应用SPIN软件(Signal Process in Neuroimaging,美国韦恩州立大学Haacke EM教授友情馈赠)处理,生成高通滤过后的相位图及SWI最小密度投影图(minimum intensity projection, MinIP)。参照人脑静脉解剖,结合SWI MinIP,在相位图上选取双侧大脑内静脉(internal cerebral vein, ICV)、大脑中深静脉(deep middle cerebral vein, DMCV)、基底静脉(basal vein, BV)及丘纹上静脉(superior thalamostriate vein, STV);于脑深部灰质核团选择双侧尾状核头(head of caudate nucleus, HCN)、苍白球(globus pallidus, GP)、壳核(putamen, PUT)、丘脑(thalamus, THA)、黑质(substantia nigra, SN)及红核(red nucleus, RN)测量相位值,避开血管结构、脑室、脑沟以及气颅交界区相位混淆伪影的影响。每个测量值重复3次,取平均值。见图1~6。
1.4统计学分析 采用SPSS 20.0统计分析软件。计量资料以±s表示,采用配对t检验比较RRMS组、对照组左侧与右侧脑静脉相位值的差异;以独立样本t检验比较RRMS组与对照组左右侧脑深部灰质核团相位值差异。采用Spearman相关验检分析脑深部灰质核团与脑静脉相位值的相关性。P<0.05为差异有统计学意义。
2 结果
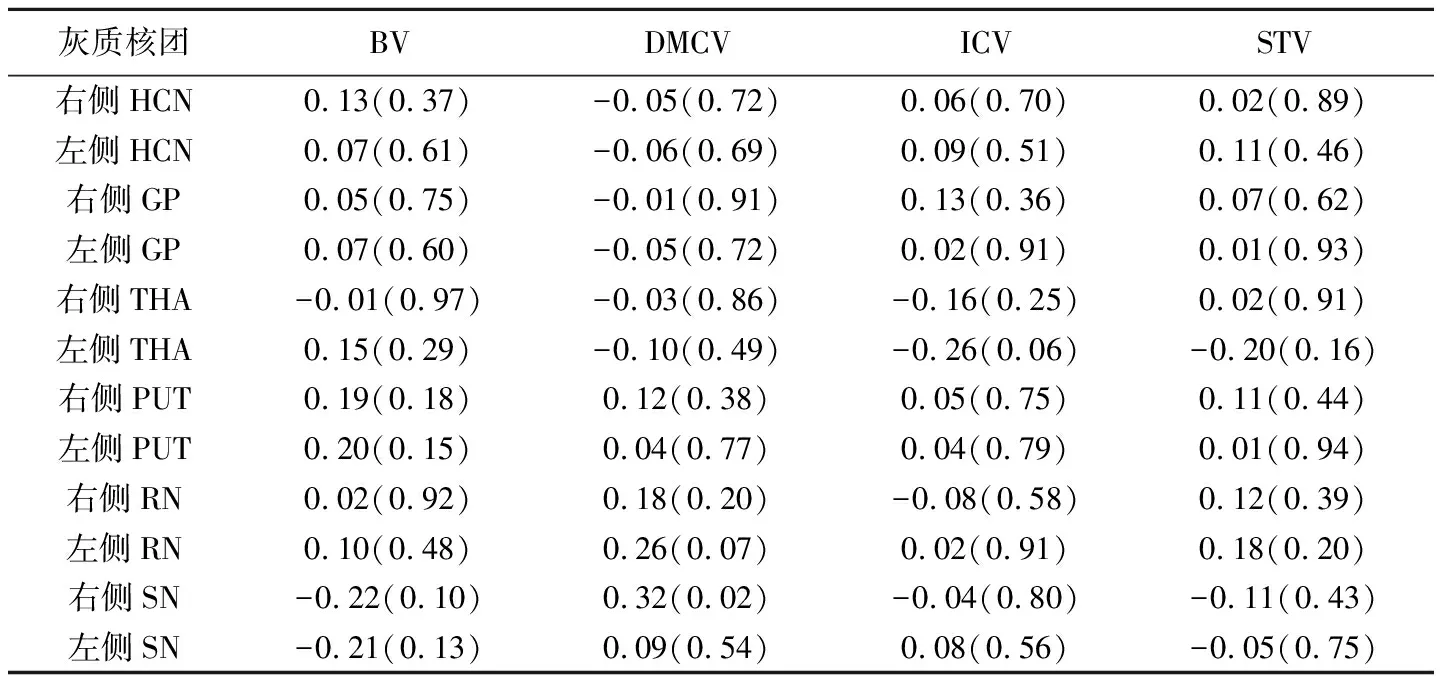
RRMS组和对照组脑静脉左、右侧相位值差异均无统计学意义(P均>0.05),故统计数据时将左、右侧数据取平均值进行整合分析。除双侧THA及右侧RN相位值外,RRMS组双侧HCN、GP、PUT、SN及左侧RN相位值均较对照组降低(P均<0.05,表1)。相关分析示对照组DMCV与右侧SN相位值呈正相关(r=0.32,P=0.02),其余脑静脉与脑深部灰质核团相位值均无相关(P均>0.05,表2);RRMS组BV、DMCV与左侧PUT(r=0.41、0.44,P均<0.05)、右侧PUT相位值呈正相关(r=0.38、0.43,P均<0.05),ICV与左侧PUT相位值呈正相关(r=0.37,P=0.01),其余脑静脉与脑深部灰质核团相位值均无相关性(P均>0.05,表3)。
3 讨论
铁是中枢神经系统内最为重要的一种过渡金属元素,参与组织形成、氧的运输、电子传递、神经递质合成及维持线粒体功能等,在髓鞘形成和少突胶质细胞发育过程及在维持脑内动态平衡中的作用至关重要[8-10]。人体内的铁以非血色素铁及血色素铁两种形式存在[11],且二者磁化率不同[12],血色素铁包括含氧血红蛋白、脱氧血红蛋白、高铁血红蛋白等。SWI技术利用含氧血红蛋白与脱氧血红蛋白间磁敏感特性的差异进行成像,而含铁血黄素和铁蛋白均为强顺磁性物质,微量铁沉积也会导致明显相位变化[13],因此在SWI上测量相位值可间接观察脑铁含量变化。本研究利用SPIN软件,在高通滤过后的相位图上测量相位值,可以敏感地检测到组织内非血色素铁的浓度变化(可精确至1 μg/g组织)[11,13-14],再通过相位值的变化较准确地推算出脑铁浓度,具体如下:
表1 RRMS组与对照组脑深部灰质核团相位值(±s)

表1 RRMS组与对照组脑深部灰质核团相位值(±s)
组别HCN左侧右侧GP左侧右侧THA左侧右侧RRMS组1 988.80±55.841 985.80±93.421 988.23±32.711 988.34±31.942 040.07±7.872 041.25±7.20对照组2 016.40±32.102 019.53±27.182 006.28±39.142 012.67±37.882 045.33±21.342 045.17±18.94t值-3.02-2.49-2.43-3.41-1.55-1.29P值<0.010.020.02<0.010.130.20组别PUT左侧右侧RN左侧右侧SN左侧右侧RRMS组2 001.35±43.052 008.80±25.561 971.70±40.721 972.57±5.721 920.01±40.571 925.41±48.25对照组2 023.78±30.282 025.97±28.081 991.36±41.771 990.48±49.371 949.08±56.591 960.00±86.22t值-2.99-3.11-2.32-2.00-2.34-2.37P值<0.01<0.010.020.050.020.02

图1 手动勾画HCN(桔黄色)、PUT(红色)测量区 图2 手动勾画SN(绿色)、RN(黄色)测量区 图3 于相位图上勾画ICV 黄线表示测量静脉血氧含量时的测量方向 图4 于相位图上勾画STV 黄线表示测量静脉血氧含量时的测量方向 图5 于相位图上勾画BV 黄线表示测量静脉血氧含量时的测量方向 图6 于相位图勾画DMCV 黄线表示测量静脉血氧含量时的测量方向
灰质核团BVDMCVICVSTV右侧HCN0.13(0.37)-0.05(0.72)0.06(0.70)0.02(0.89)左侧HCN0.07(0.61)-0.06(0.69)0.09(0.51)0.11(0.46)右侧GP0.05(0.75)-0.01(0.91)0.13(0.36)0.07(0.62)左侧GP0.07(0.60)-0.05(0.72)0.02(0.91)0.01(0.93)右侧THA-0.01(0.97)-0.03(0.86)-0.16(0.25)0.02(0.91)左侧THA0.15(0.29)-0.10(0.49)-0.26(0.06)-0.20(0.16)右侧PUT0.19(0.18)0.12(0.38)0.05(0.75)0.11(0.44)左侧PUT0.20(0.15)0.04(0.77)0.04(0.79)0.01(0.94)右侧RN0.02(0.92)0.18(0.20)-0.08(0.58)0.12(0.39)左侧RN0.10(0.48)0.26(0.07)0.02(0.91)0.18(0.20)右侧SN-0.22(0.10)0.32(0.02)-0.04(0.80)-0.11(0.43)左侧SN-0.21(0.13)0.09(0.54)0.08(0.56)-0.05(0.75)

表3 RRMS组脑深部灰质核团与脑静脉相位值的相关性[rs值(P值)]
φ=-γ·ΔB·TE
(1)
ΔB=Fe ·V·ΔX· B0
(2)
Fe=-φ/γ·V·ΔX· B0·TE
(3)
其中φ代表相位值,γ代表磁旋比,ΔB代表组织间磁场变化,TE代表回波时间,Fe代表铁浓度,V代表像素体积,ΔX代表铁存在时分子间磁化变化,B0代表主磁场场强。由此可知,当TE一致时,相位值与铁含量呈负相关,即测得的相位值越小,组织内铁沉积越高。
本研究结果显示,除双侧THA及右侧RN相位值外,RRMS患者大脑深部灰质核团相位值均低于对照组,表明MS患者脑灰质核团的铁沉积量高于健康人,RRMS患者存在病理性脑铁代谢异常,脑铁过量沉积在RRMS病理过程中扮演着重要角色,与既往研究[2-3]一致;提示脑铁含量的增加是RRMS具有特征性的病理生理学改变,可作为观测RRMS活动期和病情进展的重要生物学指标。通常情况下,与铁蛋白结合的铁对人体无危害;一旦铁蛋白被破坏,过量自由铁被释放出来,可以转化成含铁血黄素和其他过氧化氢类衍生物,而这种物质更容易与周围分子进行电子交换,激发促进自由基的产生,从而引起脂质过氧化。除直接引起细胞损害外,过量的铁还能改变细胞周围环境,使其对毒素或致病因子更加敏感[10,15]。一项自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)动物模型研究[16]发现EAE大鼠脑内有过量的铁沉积,且在缺铁动物中不能成功诱导EAE模型。
本研究关于脑深部灰质核团与脑静脉相位值的相关分析结果显示,对照组仅DMCV与右侧SN相位值呈正相关(r=0.32,P=0.02),而RRMS组BV、DMCV与双侧PUT均呈正相关(P均<0.05),ICV与左侧PUT也存在相关性(P<0.05),表明RRMS组患者脑深部灰质核团的铁沉积与脑内静脉血氧含量的下降,且其间存在某种关联。近年研究[17]报道,慢性脑脊髓静脉供血不足导致静脉狭窄及血流缓慢可能是RRMS的诱发因素。一方面,这种狭窄势必会引起脑内静脉氧含量下降,进一步导致脑耗氧减少,脑细胞利用含铁酶类也相对减少,从而导致铁沉积;另一方面,铁沉积使脑细胞氧化产生的H2O2通过细胞膜与高能量羟基发生反应,生成过氧化脂类,又可造成细胞膜对钙失控,从而导致细胞毒性,引起细胞老化,从而进一步造成脑铁沉积[18]。颅内出血、缺血或缺氧情况下,细胞外液电解质平衡被破坏及pH值下降,可能引起铁从铁蛋白或转铁蛋白中释放[11]。正常情况下,人脑内的铁代谢与分布受严密调控,随年龄增加,铁主要是以铁蛋白内铁的形式逐渐积聚;而铁进入铁蛋白内被认为具有组织保护作用,能够防止铁过量可能带来的毒性作用。在细胞外液呈酸性的条件下,铁蛋白内的铁通过与过多的超氧化物自由基和抗坏血酸盐等物质的相互作用,以Fe2+的形式释放出来[19],进而诱发神经损害。
本研究的局限性主要在于样本量相对较少,统计学结果难免产生一定偏倚;在脑深部灰质核团的勾画、测量过程中,虽经多次测量取均值,但难免也会存在一定误差。
综上所述,RRMS患者脑深部灰质核团铁沉积与脑内静脉血氧含量存在一定相关性,对其相互影响的机制尚需进一步深入研究。
