基于核心素养的结构化教学单元整体教学设计
2018-12-20洪冬梅
洪冬梅


[摘 要] 以高中化学选修“物质在水溶液中的行为”为例,提出了以发展学生核心素养为导向,凸显知识进阶、素养进阶的有效整合,体现结构化教学的单元整体教学设计思路和实践操作案例。
[关键词] 核心素养;素养进阶;物质在水溶液中的行为;结构化教学
课堂是学生核心素养发展的主场,如何在化学课堂教学中发挥学生的主场优势,是我们教师要不断思考和研究的问题。建构主义认为,学习不是教师简单地把知识传递给学生,而是由学生自己建构知识的过程。如何在化学教学中引导学生建构知识的同时,发展核心素养呢?本文將浅谈自己的体会,与大家共同探讨。
一、教学内容的思考
化学核心素养的发展是一个自我建构、持续进步的过程,教师应根据化学核心素养的内涵及其进阶性,立足于学生已有经验,对教学内容进行结构化设计,使得教学过程合乎学生素养的发展和认知规律的发展。
从核心素养培养的角度看,学生学过的具体知识可能遗忘很快,但其中思维方式潜移默化地影响,却让学生终生受益。奥苏伯尔的有意义学习理论告诉我们,任何有意义的学习都是在原有知识基础上进行的,不受原有认知结构影响的学习活动是不存在的。为了提高学生化学核心素养,我们必须教给学生课程知识的基本结构,实施单元结构化教学。
在复习过程中我们主观上想引导学生建立大平衡观下的化学平衡,而学生很难整理出网络结构,原因在于我们日常的教学中呈现给学生的是散装的知识是单个的平衡,而不是一个一个的知识结构,如果我们教学时重视结构化知识的整体呈现,比如在上每种平衡时都建构思维模型,最后在课堂小结都是以化学平衡归纳对比,这样当我们上完第三章,大平衡观也建立起来了,遇到新的物质,也懂得研究的方法程序,从而突破新情境下的新物质的知识迁移。
第三章物质在水溶液中的行为,安排在学生学习完化学平衡之后,是想引导学生利用第二章平衡的知识解决具体的平衡问题。引导学生从化学平衡的建立、平衡常数、平衡移动的影响因素,特别是Q与K大小比较定量判断等原理出发,经过问题探究、实验论证等多方面思维活动实现了物质在水溶液中行为的学习,由浅入深地帮助学生构建有关水溶液体系整体知识结构,降低学生思维的难度,提高他们对水溶液的整体意识。学生在收获知识的同时,思维能力也得到了提升。
综上,单元整体教学设计应将知识进阶、知识要求、素养进阶统筹考虑,促进学生的学科知识向学科素养转化。笔者设计了物质在水溶液中行为结构化思维模型如图1。
研究物质按弱电解质(水、弱酸、弱碱)、盐类(正盐、酸式盐)、沉淀(可溶、难溶),其中弱酸、弱碱除大家熟悉的醋酸和一水合氨外,应加入硼酸、二联氨这两类由水电离出H+、 OH-的弱酸和弱碱,盐类水解除正盐的水解,补充酸式盐的电离、水解,而沉淀溶解平衡除了难溶电解质的溶解平衡,应加入可溶物质的溶解平衡,完善学生物质在水溶液的知识体系。
二、课例:沉淀溶解平衡
(一)教学与评价目标
1.教学目标
(1)实验探究证明平衡的存在;
(2)通过体验难溶电解质的溶解平衡建立过程,初步建立沉淀溶解平衡的认识模型;
(3)通过钡餐,重金属中毒洗胃,废水处理是否达标的设计活动,感受沉淀溶解平衡的价值,增强社会责任感。
2.评价目标
(1)通过对“Ag+与Cl-反应能否进行完全?”的探究实验设计方案的交流和点评,诊断并发展学生实验探究的水平(定性水平、定量水平);
(2)通过对具体生活情境学科情境中沉淀溶解平衡的判断和分析,诊断并发展学生对溶解平衡移动的认识;
(3)通过对废水排放是否合格的讨论,诊断并发展学生“科学态度与社会责任”维度的核心素养水平。
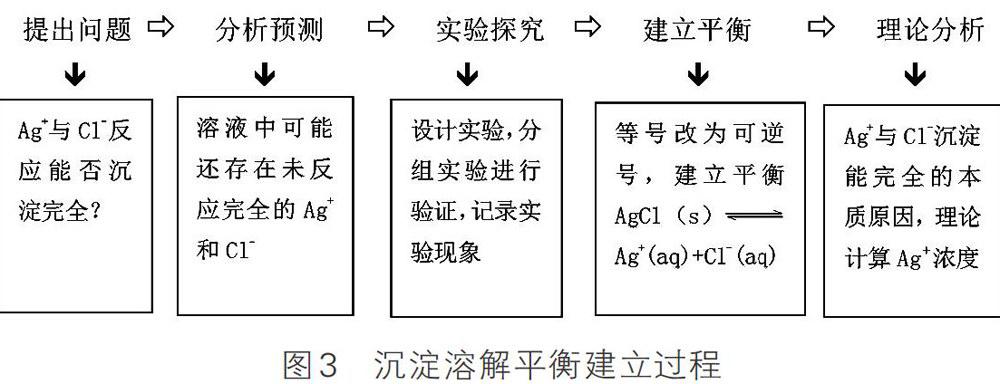
(二)教学流程简图见图2,沉淀溶解平衡建立过程见图3
(三)教学过程
1.复习旧知,为溶解度正名
[问题展示]
1.1难溶电解质的定义?列举一些你熟悉的难溶电解质。
1.2难溶物的溶解度是否为0?你如何理解溶解性表中“溶”与“不溶”?
[投影]溶解度定义(某温度下100克溶剂某物质溶解的最大克数叫溶解度,符号S)、易溶、可溶、微溶、难溶定义
[学生]溶解度不是指100克水某物质溶解的最大克数?
[教师]提出了问题,我们需要解决问题,化学是一门以实验为基础的学科,我们通过实验来解决这个问题。
[分组实验1]取少量饱和NaCl溶液于试管中滴加浓盐酸
现象:有大量白色沉淀产生。
[思考]白色沉淀是什么物质?加入盐酸后的溶液还是饱和的吗?溶解的NaCl的量怎么变?为什么?(这过程热效应微乎其微,忽略温度变化)
[学生分组分析讨论]白色沉淀是NaCl。仍然是饱和溶液,溶解的NaCl减少,温度不变,应该是溶剂改变,导致溶解度变。
[教师]很严谨,所以溶解度的定义应该是某温度下100克溶剂某物质溶解的最大克数更为科学。
[设计意图]初三溶解度定义的教学由于溶剂一般是水,某温度下100克水某物质溶解的最大克数成为溶解度定义的“定义”,然而随着知识学习的不断深入,却成为一种潜意识定势,必须先破后立。
[追问]产生白色沉淀的原因是什么?
[学生]NaCl饱和溶液中存在平衡:
加入浓盐酸,c(Cl-)增大,平衡向逆方向移动,有NaCl固体生成。
[教师]正如同学们所说,可溶电解质溶液这种行为称为溶解平衡,那么难溶的电解质在水中是否也存在溶解平衡呢?
[设计意图]通过宏观实验现象分析思考溶液中离子行为,有利于学生“宏观意识与微观探析”维度发展化学核心素养。同时完善沉淀溶解平衡理论,证明溶解平衡在易溶电解质中的广泛存在,避免学生把沉淀等同于难溶电解质,形成定势思维。
2.物质迁移,探究物质在水溶液中的行为建立沉淀溶解平衡
[分组实验2]
①向盛有1 mL 0.1mol·L-1AgNO3溶液的试管加入2 mL 0.1mol·L-1 NaCl 溶液。
实验现象:有白色沉淀產生。
②取上层清液,滴加 KI 溶液,有何现象?
实验现象:有黄色沉淀产生。
[分组讨论] Ag++Cl- = AgCl(s)滴加KI溶液产生黄色沉淀,说明
[教师]分析很到位。在水分子的作用下,AgCl会溶解出极少量的Ag+(aq)和Cl- (aq),同时,溶液中的Ag+(aq)和Cl- (aq)受AgCl表面阴阳离子的吸引,回到AgCl的表面,结合形成AgCl沉淀,像这样在一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,达到一种平衡状态,我们把这种平衡称为沉淀溶解平衡。
[视频]难溶电解质溶解与沉淀过程
[深度思考] Ag+与Cl-反应能否进行完全?(通常认为残留在溶液中的离子浓度小1×10-5mol·L-1时,沉淀完全)
[查阅资料]室温下,AgCl溶解度1.5×10-4 g
[学生] 100g水中含Ag+物质的量为(1.5×10-4 g/143.5 g·mol -1)
Ag+浓度约为(1.5×10-4/143.5)/0.1≈10-5mol·L-1
可以认为Ag+与Cl- 生成AgCl的反应能进行完全。
[设计意图]学生在完成实验探究的过程中有助于从“科学探究与创新意识”维度发展化学核心素养,在建立沉淀溶解平衡观后,引导学生从定量的角度探究沉淀完全的本质,发展了学生“证据推理”的核心素养,同时完善了学生对化学平衡的认识。
[练习]写出氢氧化镁溶解平衡表达式。
[学生总结]写表达式需要注意之处。
3.立足平衡,引入定量分析工具——溶度积
[教师]难溶电解质在水中的沉淀溶解平衡也是一种化学平衡,符合平衡的规律。根据化学平衡常数表达式写出氢氧化镁溶解平衡的平衡常数。
[学生]写出氢氧化镁溶解平衡的平衡常数。
[教师]难溶电解质在溶液中达到沉淀溶解平衡状态时,离子浓度不再改变。其离子浓度的次方的乘积为一个常数,这个常数称为溶度积常数简称为溶度积,用Ksp表示。
[问题探究]溶度积和溶解度都可以表示物质的溶解能力,根据表1数据分析溶度积和溶解度什么关系?
[学生]通过比较我们不难发现相同类型(如AB型:AgCl、AgBr、AgI)的难溶电解质的Ksp越小,溶解度也越小,表明越难溶。
不同类型的难溶电解质(如AB型与AB2型),要注意Ksp表达式中指数的问题,不能直接比较,要进行相关计算。
Ksp决定于难溶电解质的本性,与温度有关,与溶液浓度无关。
[设计意图]引导学生在建立了溶解平衡的同时,立足于化学平衡常数,建构溶度积的知识,水到渠成。
4.理论辨析,探讨溶解平衡移动的因素
[交流研讨]根据化学平衡移动的知识,我们知道影响难溶电解质溶解平衡的因素有哪些呢?首先是温度:升温,多数溶解平衡向溶解方向移动(即正方向),少数物质如氢氧化钙会向沉淀方向移动。其次是浓度:加水,Ag+(aq)和Cl-(aq)浓度均减少,Q减小,Q<K,平衡向溶解方向移动,(即正方向);增大相同离子浓度,抑制溶解即逆向移动;加入消耗离子的物质,促进溶解即正向移动。
[教师]今天我们所学习的难溶电解质的溶解平衡也是一种化学平衡体系,所以遵从平衡移动原理。
[设计意图]引导学生从定量的角度(Q、K大小比较)判断加水平衡正向移动代替越稀越溶解的规律记忆,学生收获的不仅有知识,更有思维提升。立足平衡移动原理,分析移动因素的影响,有利于学生的知识建构。
5.创设情境,反馈评价
[情境素材1]根据沉淀溶解平衡及溶度积规则,分析回答下列问题:
(1)BaCO3和BaSO4都难溶于水,在医学上常用BaSO4作钡餐透视,而不能用BaCO3的原因是什么?
资料:
①25。C, Ksp(BaSO4)=1.1×10-10mol2·L-2; Ksp(BaCO3)=5.1×10-9mol2·L-2
②胃酸的酸性很强,pH约为0.9~1.5;
③游离的Ba2+有剧毒,会造成重金属中毒
[情境素材2]人如果误服AgNO3溶液会导致重金属中毒,送医后,医院常用2%的NaCl溶液(即0.34mol·L-1)洗胃,为什么?
资料:
①25℃, KSP(AgCl)= 1.8×10-10mol2·L-2
②标准:c(Ag+<10-5mol·L-1)
[情境素材3] pH=7的废水中c(Cu2+ )达到排放标准吗?怎样定量分析这个问题?
资料:
①依照国家GB8978-2003《污水综合排放标准》制定 c(Cu2+)≤ 1×10-7mol/L才符合标准。
②25。C, Ksp[Cu(OH)2]=2.2×10-20mol2·L-2
[设计意图]陌生情境知识的迁移与应用能力,是学生素养形成的反馈评价,也是知识建构情况的直观反映。
6.小结提升,构建知识结构
(四)教学反思
本节“沉淀溶解平衡”的教学设计,立足于建立分析水溶液的思维模型这样的单元知识结构的建构,教学目标从三维目标向化学核心素养目标转化,教学过程层层推进,将新知识的建立与旧知识的巩固升华相结合,螺旋上升培养学生学科素养,很好达成了预设的教学目标。
1.注重知识的结构化设计,实现核心概念的迁移
本节课深入挖掘教材的教学资源,从学生熟悉的NaCl和AgCl入手,立足于物质在水溶液中的行为结构化的思维模型,从化学平衡的建立、平衡常数、平衡移动的影响因素,特别是Q与K大小比较定量判断等原理出发,感悟体验沉淀溶解平衡也是一种化学平衡,实现核心概念的迁移。
2.注重学生的知识进阶,促进核心概念的建构
学生的前认知与所要达成的教学目标之间的思维发展是依次进阶的。本节课针对学生初中已有的溶解度知识、第二章已学习的平衡理论,准确找到学生的知识盲点,以此为抓手,结合问题探究,实验探究,理论辨析,定性、定量分析,层层推进,促进沉淀溶解平衡思维模式的构建,在平衡移动的影响因素中加水平衡移动Q与K定量比较,陌生情境中Ksp的应用,实现知识结构的巩固提升,最后的课堂小结把化学平衡与沉淀溶解平衡进行对比归纳,完成大平衡观的一个知识结构建构。
3.注重“教、学、评”的一致性,促进核心素养的发展
核心素养不是先天遗传,是经过后天教育习得的,即强调经过后天的学习可获得,是可教可学的。在本节教学过程中,注重教学评价和教与学活动有机融合,首先通过对“Ag+与Cl-反应能否进行完全?”的探究实验设计方案的交流和点评,诊断并发展学生实验探究的水平(定性水平、定量水平);接着通过对具体生活情境学科情境中沉淀溶解平衡的判断和分析,诊断并发展学生对溶解平衡移动的认识;最后通过对废水排放是否合格的讨论,诊断并发展学生“科学态度与社会责任”维度的核心素养水平。学生在教师有计划、有目的的引导下,运用化学思维和方法,在陌生情境中完成知识建构的同时逐步发展了化学核心素养。
教学过程中应注意各教学环节应与学生的认知进阶、素养进阶、认知结构相适应,精心设计教学环节,努力帮助学生解决相关的思维转化,形成沉淀溶解平衡知识结构的同时,逐步建立水溶液中的大平衡观。
[参 考 文 献]
[1]中华人民共和国教育部制定.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018.
[2]郑军,潘虹.“難溶电解质的溶解平衡”教学设计、实施与反思[J].化学教学,2018(2).
[3]林崇德.21世纪学生发展核心素养研究[M].北京:北京师范大学出版社,2006.
