SHOX2基因甲基化水平对肺癌和良性肺部疾病的鉴别诊断研究
2018-12-19夏冬平史小武
夏冬平,史小武,周 颖,朱 珊
本文意义:目前,低剂量CT代替传统的胸部X线片作为肺癌高危人群的早期筛查,可以明显降低周围型肺癌的病死率。但其对早期中央型肺癌和癌前病变,尤其是小细胞肺癌和早期鳞状细胞肺癌的检出率并不理想。本研究分析了肺癌及良性肺部疾病患者中SHOX2基因甲基化水平的差异,进一步探索了SHOX2基因甲基化水平对早期肺癌患者的诊断效能,发现其诊断早期小细胞肺癌和鳞状细胞癌的能力较高,联合血清胃泌素释放肽前体的诊断效能更胜一筹,有望成为肺癌早期非侵入性检查的方案之一,进一步提高肺癌的检出率,并降低病死率。
目前诊断肺癌最常用的支气管镜、经支气管镜肺活检等内镜检查技术虽特异度及灵敏度较高,但均为有创操作,给患者带来额外痛苦[1]。2015年原发性肺癌诊疗规范推荐,常用的血清胃泌素释放肽前体(ProGRP)、鳞状上皮细胞癌抗原(SCC-Ag)、细胞角蛋白21片段抗原(Cyfra21-1)及癌胚抗原(CEA)等肿瘤标志物的检测对肺癌诊断具有一定的临床价值[2]。但倪军等[3]研究表明肿瘤标志物单独使用的灵敏度均低于60%,而联合使用则降低其特异度。KNEIP等[4]研究表明,通过检测血浆SHOX2基因甲基化诊断肺癌的灵敏度为60%,特异度为90%,但并未对良性肺部疾病患者和健康人群SHOX2基因甲基化水平进行均衡性检验。此外,目前关于血浆SHOX2基因甲基化诊断肺癌的相关临床研究仍较少。因此,本研究通过比较肺癌患者和良性肺部疾病患者的血浆SHOX2基因甲基化水平以及进一步探索SHOX2基因甲基化水平与肺癌类型、TNM分期的关系,旨在为临床肺癌的诊治提供参考。
1 对象与方法
1.1 研究对象 纳入标准:根据《2007中国肺癌临床指南》[5]诊断为肺癌的患者,根据《中国肺部结节分类、诊断与治疗指南(2016年版)》[6]确诊为结节、结核、炎症等与早期肺癌临床症状相似的良性肺部疾病者。排除标准:(1)既往行肺部手术治疗或行肺癌相关化疗、免疫治疗、靶向治疗的肺癌患者;(2)其他部位原发性肿瘤的肺癌患者;(3)肺部结节未行病理检查排除肺癌的良性肺部疾病患者;(4)合并有其他恶性肿瘤的良性肺部疾病患者。选取2014年3月—2016年6月武汉市中心医院胸外科、呼吸科住院的肺癌患者和良性肺部疾病患者为研究对象。肺癌患者173例作为肺癌组,其中腺癌72例,鳞状细胞癌68例,小细胞癌15例,大细胞癌8例,其他未知病理类型10例;TNM分期:Ⅰ期22例,Ⅱ期28例,Ⅲ期76例,Ⅳ期47例。良性肺部疾病患者194例作为良性肺病组,其中肺部感染73例,慢性阻塞性肺疾病(COPD)32例,哮喘24例,支气管扩张23例,肺栓塞15例,纤维组织增生性小结节、错构瘤等其他肺部疾病27例。患者及家属均签署知情同意书,本研究获武汉市中心医院药物临床试验伦理委员会批准。
1.2 研究方法
1.2.1 常规血清学检查 入院第2天抽取晨起空腹静脉血5 ml,其中2 ml置入乙二胺四乙酸二钾抗凝的真空采血管,检测白细胞计数(WBC)、血红蛋白(Hb)、血小板计数。取3 ml置入无抗凝剂的真空采血管,离心半径为13.5 cm,以3 000 r/min离心10 min后,分离血清,-70 ℃保存,24 h内采用BS-220全自动生化分析仪(迈瑞生物医疗电子股份有限公司)检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、清蛋白(ALB)、总胆红素(TBiL)、直接胆红素(DBiL)、尿素氮(BUN)、肌酐(Cr)。
1.2.2 肿瘤标志物检测 入院第2天抽取晨起空腹静脉血5 ml,置入无抗凝剂的真空采血管中,静置30 min后,离心半径为8 cm,以2 500 r/min离心20 min后留取上清液,置于4 ℃条件下保存待检,采用罗氏Elecsys 2010电化学发光全自动免疫分析仪及配套试剂检测血清ProGRP、SCC-Ag、Cyfra21-1及CEA。所有过程由经验丰富的医师按照说明书操作完成。
1.2.3 血浆SHOX2基因甲基化检测 抽取患者空腹静脉血5 ml,置入枸橼酸钠抗凝管中,离心半径为10 cm,以2 000 r/min离心20 min后分离血浆,并在4 ℃条件下保存待检。主要试剂:DNA提纯试剂盒(上海欧孚生物医药科技有限公司,型号:DM6150P);DNA亚硫酸氢盐转化试剂盒(艾美捷科技有限公司,型号:ENZ-45001-0050);甲基化阳性对照试剂盒(QIAGEN公司,型号:59655);引物及探针由生工生物工程(上海)股份有限公司合成;2×TAG PCR MIX(北京欧比特科技有限公司产品);实时荧光定量聚合酶链式反应(PCR)仪器(美国RioRad公司)。方法:(1)采用DNA提取试剂盒提取血浆DNA,并采用v-1200分光光度计测定DNA浓度及纯度;(2)将提纯的DNA进行亚硫酸氢盐化;(3)采用实时荧光定量PCR法扩增,PCR反应条件为90 ℃预变性20 min,55个循环;95 ℃变性15 s,56 ℃退火30 s;每个样本重复2次(引物及探针序列见表1);(4)采用Sanger测序法检测SHOX2基因甲基化,PCR产物由威斯腾生物医药科技有限责任公司测序;(5)采用ΔΔCT法计算SHOX2基因甲基化水平,ΔΔCT值越低,表示SHOX2基因甲基化水平越高。
1.3 统计学方法 采用SPSS 20.0软件进行统计学分析。计量资料以(s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料的分析采用χ2检验;采用多因素Logistic回归分析肺癌的影响因素;采用受试者工作特征(ROC)曲线分析各指标鉴别肺癌的价值;ROC曲线下面积(AUC)比较采用Z检验。以P<0.05为差异有统计学意义。

表1 实时荧光定量PCR的引物序列Table1 Prime sequence of real time fluorescent quantitative PCR
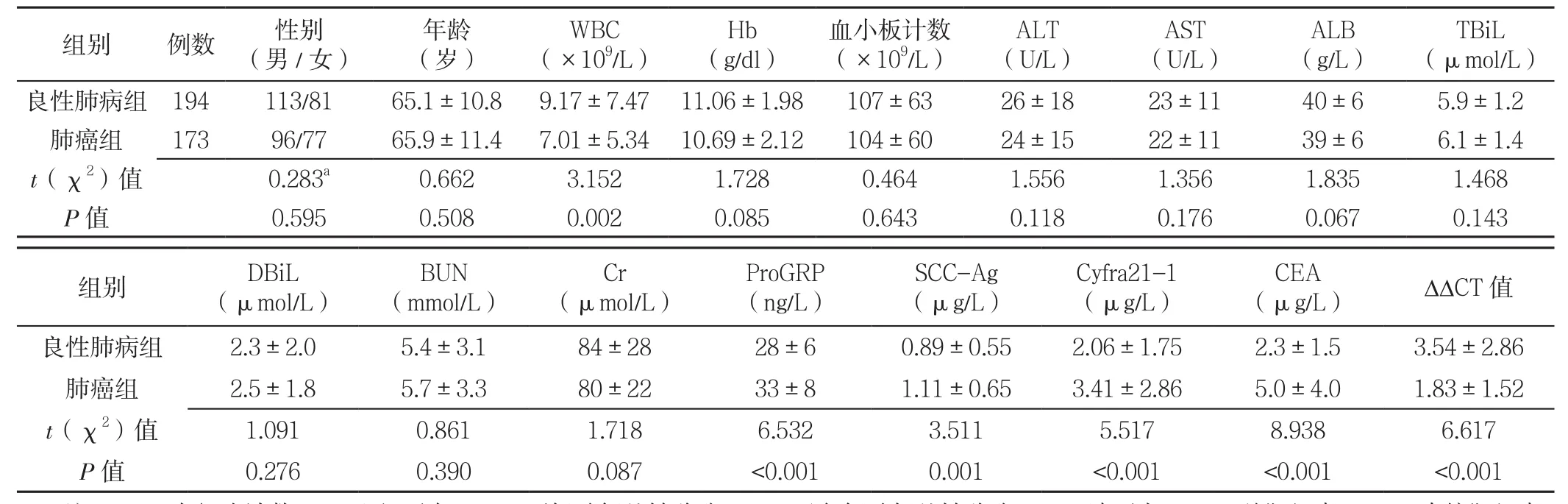
表2 两组患者基线资料比较Table2 Comparison of baseline data between the two groups
2 结果
2.1 两组患者基线资料比较 两组患者性别、年龄、Hb、血小板计数、ALT、AST、ALB、TBiL、DBiL、BUN、Cr比较,差异均无统计学意义(P>0.05);肺癌组患者WBC、ΔΔCT值均低于良性肺病组,ProGRP、SCC-Ag、Cyfra21-1、CEA均高于良性肺病组,差异有统计学意义(P<0.05,见表2)。
2.2 良性肺病组不同疾病患者ΔΔCT值比较 良性肺病组不同疾病患者ΔΔCT值比较,差异无统计学意义(P>0.05,见表3)。
2.3 肺癌影响因素的多因素Logistic回归分析 以是否患有肺癌(赋值:否=0,是=1)为因变量,以WBC、ProGRP、SCC-Ag、Cyfra21-1、CEA、ΔΔCT值为自变量进行多因素Logistic回归分析,结果显示,ProGRP、Cyfra21-1、ΔΔCT值是肺癌的影响因素(P<0.05,见表4)。
2.4 不同指标诊断肺癌的ROC曲线及指标 以ΔΔCT值、血清ProGRP、血清Cyfra21-1为检验变量,以肺癌发生情况为分类变量绘制ROC曲线,结果显示ΔΔCT值诊断肺癌的AUC为0.843,最佳临界值为2.69时,灵敏度为58.2%,特异度为93.1%;血清ProGRP诊断肺癌的AUC为0.711,最佳临界值为32 ng/L时,灵敏度为63.5%,特异度为77.4%;血清Cyfra21-1诊断肺癌的AUC为0.677,最佳临界值为2.92 μg/L时,灵敏度为56.1%,特异度为72.3%。血清ProGRP诊断肺癌的AUC大于血清Cyfra21-1,差异有统计学意义(Z=3.569,P=0.038)。以ΔΔCT值联合血清ProGRP为检验变量,以肺癌发生情况为分类变量绘制ROC曲线,结果显示AUC为0.860。ΔΔCT值联合血清ProGRP诊断肺癌的AUC均大于ΔΔCT值、血清ProGRP、血清Cyfra21-1,差异有统计学意义(Z=4.046、5.607、8.215,P<0.05,见图1)。
2.5 肺癌组不同病理类型患者ΔΔCT值比较 肺癌组不同病理类型患者ΔΔCT值比较,差异有统计学意义(P<0.05);其中,鳞状细胞癌、小细胞癌患者ΔΔCT值均低于腺癌、大细胞癌、其他未知病理类型,差异有统计学意义(P<0.05,见表5)。
2.6 肺癌组不同TNM分期患者ΔΔCT值比较 肺癌组不同TNM分期患者ΔΔCT值比较,差异有统计学意义(P<0.05);其中,Ⅲ期患者ΔΔCT值低于Ⅰ期、Ⅱ期,差异均有统计学意义(P<0.05);Ⅳ期患者ΔΔCT值低于Ⅰ期、Ⅱ期、Ⅲ期,差异均有统计学意义(P<0.05,见表6)。
表3 良性肺病组不同疾病患者ΔΔCT值比较(s)Table3 Comparison of ΔΔCT value level in patients with different diseases in the benign lung disease group
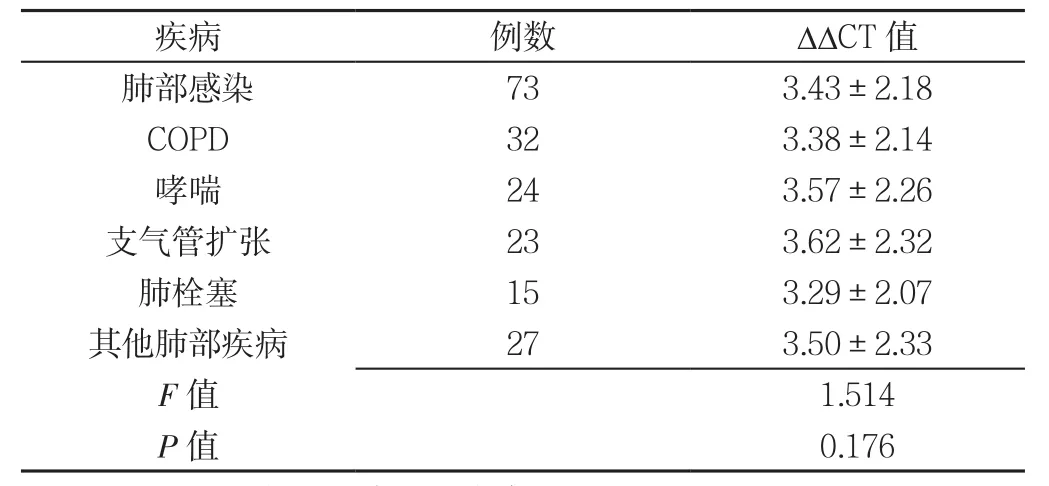
表3 良性肺病组不同疾病患者ΔΔCT值比较(s)Table3 Comparison of ΔΔCT value level in patients with different diseases in the benign lung disease group
注:COPD=慢性阻塞性肺疾病
?
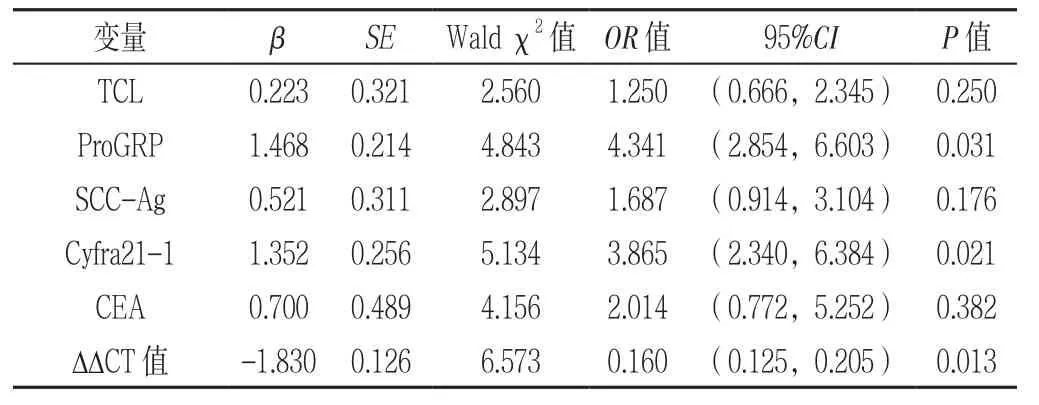
表4 肺癌的影响因素的多因素Logistic回归分析Table4 Multivariate Logistic regression analysis on influencing factors for lung cancer
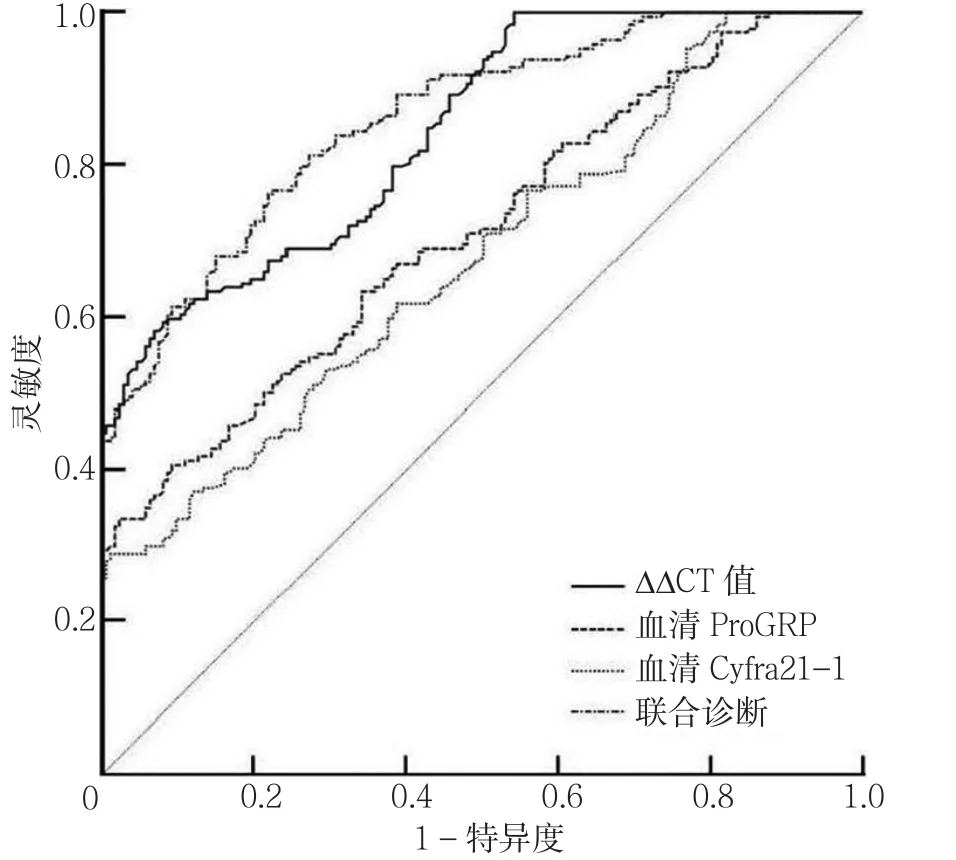
图1 不同指标诊断肺癌的ROC曲线Figure1 Diagnosis of ROC curve of lung cancer by different indexes
表5 肺癌组不同病理类型患者ΔΔCT值比较(s)Table5 Comparison of ΔΔCT value in patients with different pathological types in lung cancer group
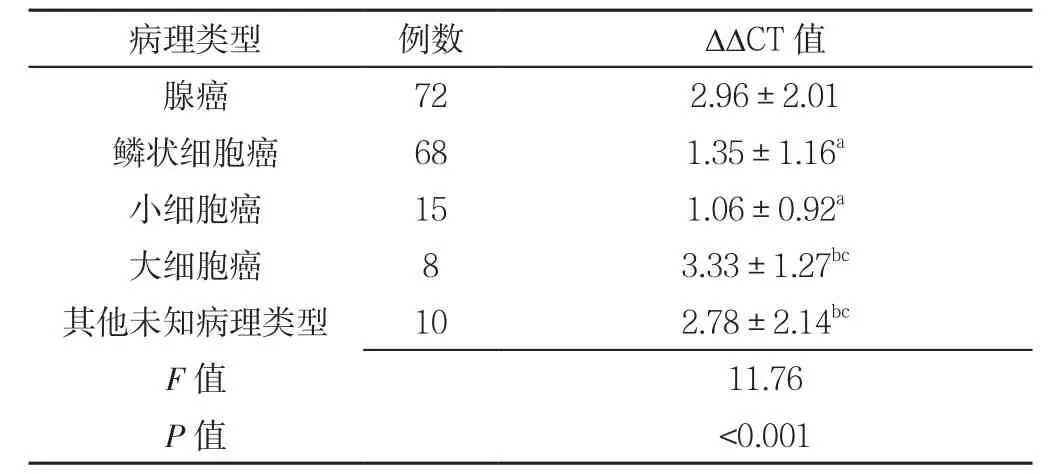
表5 肺癌组不同病理类型患者ΔΔCT值比较(s)Table5 Comparison of ΔΔCT value in patients with different pathological types in lung cancer group
注:与腺癌比较,aP<0.05;与鳞状细胞癌比较,bP<0.05;与小细胞癌比较,cP<0.05
?
表6 肺癌组不同TNM分期患者ΔΔCT值比较(s)Table6 Comparison of ΔΔCT value in patients with different TNM stages in lung cancer group

表6 肺癌组不同TNM分期患者ΔΔCT值比较(s)Table6 Comparison of ΔΔCT value in patients with different TNM stages in lung cancer group
注:与Ⅰ期比较,aP<0.05;与Ⅱ期比较,bP<0.05;与Ⅲ期比较,cP<0.05
?
3 讨论
DNA甲基化在肺癌发生的早期发挥着重要作用,且伴随肿瘤发展的整个过程,故其有望成为肺癌诊断的分子标志物[7]。近年研究发现,SHOX2基因甲基化在肺癌患者的5种标本(淋巴结、胸腔积液、支气管肺泡灌洗液、肿瘤组织、外周血)中均可检测到,但各样本检测的灵敏度差异较大,以肿瘤组织和淋巴结样品检测灵敏度最高,为94%以上[8],而胸腔积液样品则不足40%[9]。值得一提的是,血浆样品检测的灵敏度也可达60%左右[10],与有创操作相比,具有较好的操作性和可重复性,有望成为肺癌早期筛查的工具。
国内大多数肺癌患者发现时已至晚期,容易发生其他脏器的转移和损害,因而会导致体内多项指标的变化[11]。本研究对入院常规检验指标如TCL、Hb、血小板计数、ALT、AST、BUN、Cr等,常用的血清肿瘤标志物如ProGRP、SCC-Ag、Cyfra21-1、CEA,以及血浆SHOX2基因甲基化进行分析,单因素分析结果显示良性肺病组患者WBC高于肺癌组,多与肺部感染人数较多、白细胞计数显著增高有关。肺癌组患者的血清ProGRP、SCC-Ag、Cyfra21-1、CEA及血浆SHOX2基因甲基化水平高于良性肺病组,提示上述指标与肺癌的发生有密切联系,需要进一步分析。以往多篇研究提示,SHOX2基因甲基化诊断疾病的特异度较高,肺癌阴性患者的阳性检出率较低,误诊率亦不高[12-13],但本研究结果显示,良性肺病组不同疾病患者SHOX2基因甲基化水平的差异无统计学意义,与已有研究[12-13]结果相同。本研究多因素Logistic回归分析显示,血清ProGRP、Cyfra21-1及血浆SHOX2基因甲基化水平均为肺癌的独立影响因素,提示上述指标可在一定程度上独立反映肺癌的情况,与OKAMURA等[14]及KORSE等[15]关于肺癌血清肿瘤标志物的研究以及SCHNEIDER等[16]关于SHOX2基因甲基化诊断肺癌的研究结果具有较好的一致性。
以往研究大多分别对血清肿瘤标志物和SHOX2基因甲基化水平诊断肺癌进行研究,其中单独检测血清ProGRP的特异度最高,在90%以上,而灵敏度不足20%;而血清Cyfra21-1的灵敏度可达70%,特异度却不足50%[17]。血浆SHOX2基因甲基化水平诊断肺癌的灵敏度为60%,特异度为90%[18]。本研究的ROC曲线结果显示,血浆SHOX2基因甲基化水平(ΔΔCT值)与血清ProGRP联合诊断肺癌的AUC均大于ΔΔCT值、血清ProGRP、血清Cyfra21-1,血清ProGRP诊断肺癌的AUC大于血清Cyfra21-1,提示三者对肺癌和良性肺部疾病的鉴别诊断具有一定价值,且血浆SHOX2基因甲基化水平与血清ProGRP联合诊断,提高灵敏度,可作为肺癌早期筛查的指标。
本研究进一步分析血浆SHOX2基因甲基化水平与肺癌患者病理类型及TNM分期的关系,结果显示病理类型中,小细胞癌的血浆SHOX2基因甲基化程度最高,其次为鳞状细胞癌,提示不同病理类型的肺癌SHOX2基因甲基化存在一定的组织特异性,对小细胞癌和鳞状细胞癌的灵敏度较高,与宋乐乐等[19]的研究结果一致。Ⅲ期患者的ΔΔCT值低于Ⅰ期、Ⅱ期,Ⅳ期患者的ΔΔCT值低于Ⅰ期、Ⅱ期、Ⅲ期,表示SHOX2基因甲基化水平可反映病情进展,随着肺癌恶性程度的增高,SHOX2基因甲基化水平增高,更易检测;其次,恶性程度高的细胞坏死及增生活跃导致该样本DNA含量较高,因而甲基化基因拷贝数增加[20]。
本研究不足之处为,亚硫酸氢钠处理后,目标DNA链不再互补,相当于以单链为模板进行扩增,不稳定性增加,此时引物与模板发生错配的概率增高,可能造成非特异性扩增。同时,由于PCR的最佳扩增条件难以摸索,以至扩增产物不纯或失败。肺癌患者早期检测时,检测水平较患者本身低,从而导致漏诊率提高。另外,考虑仪器、设备及检测技术等多种原因,本研究SHOX2基因甲基化诊断效能较KNEIP等[4]研究低。因条件有限,未能较好地控制选择偏倚,SHOX2基因甲基化与肺癌患者的关系仍需更深入的研究。因此,笔者将在日后应用更先进的检测技术,提高SHOX2基因甲基化的检出率,同时,扩大样本量,纳入社区人群,以验证本研究的结论。
综上所述,SHOX2基因甲基化鉴别肺癌和良性肺部疾病患者具有一定价值,可作为诊断肺癌的较好的辅助指标之一。
作者贡献:夏冬平、史小武、周颖、朱珊进行文章的构思与设计;史小武进行研究的实施与可行性分析,对文章整体负责,监督管理;夏冬平进行数据收集与整理,撰写论文;周颖、朱珊进行统计学处理,论文的修订,负责文章的质量控制及审校;夏冬平、史小武进行结果的分析与解释。
本文无利益冲突。
