非免疫性胎儿水肿的诊疗新进展
——2018年《非免疫性胎儿水肿的调查和管理指南》解读
2018-12-19侯磊,王欣
侯 磊,王 欣
胎儿水肿是指胎儿软组织水肿及体腔积液,超声表现为2处及以上的胎儿体腔异常积液,包括胸腔积液、腹腔积液、心包积液及皮肤水肿,部分胎儿还并发羊水过多或胎盘增厚(妊娠中期胎盘>4 cm或妊娠晚期胎盘>6 cm)。
胎儿水肿包括免疫性胎儿水肿与非免疫性胎儿水肿(NIFH)。免疫性胎儿水肿是指孕妇对胎儿遗传的父系来源红细胞抗原产生的免疫反应,母体抗体穿过胎盘与胎儿红细胞上的抗原结合,导致溶血、胎儿水肿甚至死亡。由于妊娠前和分娩后注射抗D免疫球蛋白、大脑中动脉血流监测和宫内输血等干预措施的广泛使用,免疫性胎儿水肿的预后在过去几十年中有了很大改善。NIFH指与母体红细胞抗体无关的水肿。NIFH至少占胎儿水肿的85%,发病率约为3/10 000[1]。胎儿水肿病死率较高,且妊娠早、中期的胎儿水肿发病率较妊娠晚期更高[2]。关于NIFH,2014年美国母胎医学会发布了相关指南[3],我国也于2017年发布了《非免疫性胎儿水肿临床指南》[4],2018年8月,加拿大妇产科医生协会(SOGC)发布了《非免疫性胎儿水肿的调查和管理指南》(以下简称2018版指南),其加入了近年来的新研究成果,总结了相关的循证医学证据,对NIFH的临床诊疗具有重要指导意义,本文将对这一指南的具体内容进行解读及分析。
1 NIFH相关病因研究进展
与胎儿水肿相关的3个主要机制是宫内贫血、宫内心力衰竭和低蛋白血症。虽然胎儿水肿预后不良,但是某些病因引起的胎儿水肿可以在子宫内给予治疗,并可获得良好效果,这就需要医生全面系统地寻找病因,特别是对于可治疗的或复发性的胎儿水肿。对胎儿进行全面系统的检查后,约60%可在产前明确病因,加上分娩后的检查,病因确诊率可达80%,但仍有15%~25%的胎儿水肿查不到明确病因[1]。一项系统综述分析了225篇相关文章,描述了5 437种NIFH的相关病因,其中主要病因包括:心血管(21.7%)、染色体(13.4%)、血液(10.4%)、感染(6.7%)、胸廓内的疾病(6.0%)、淋巴发育不良(5.7%)、综合征型(4.4%)、尿路畸形(2.3%)、先天性代谢病(1.1%)、胸廓外肿瘤(0.7%)[5]。
1.1 心血管病因导致的胎儿水肿 心血管病因占NIFH的20%左右,不仅包括心血管结构异常,还包括心律失常、肿瘤、感染引起的心脏功能异常[6]。以往研究显示,影响心脏舒张期充盈的先天性心脏病是最常见的导致胎儿水肿的心血管病因,如左心或右心发育不良、心内膜垫缺损等[7]。心血管病因导致的胎儿水肿多与宫内先天缺陷导致的心力衰竭有关,病死率达92%[8]。2018版指南指出,对于NIFH胎儿,全面的超声检查及超声多普勒检查均为一线检查。
心律失常是导致胎儿水肿的心血管病因之一,可通过M超检查诊断。胎儿快速心律失常和心动过缓均可导致胎儿水肿;最常见的胎儿快速心律失常为室上性心动过速和心房扑动,均可通过母体给药进行妊娠期治疗,效果良好。STRIZEK等[9]研究显示,通过母体口服氟卡尼或地高辛,两者联合用药均能使室上性心动过速的胎儿成功复律。因此2014年美国母胎医学会指南推荐,除非孕妇近足月,胎儿的快速心律失常均建议及时通过母体给药治疗[3]。胎儿心动过缓多由于房室传导阻滞导致,继发于母亲患有自身免疫性疾病,抗SSA、SSB抗体阳性;或由于胎儿心脏结构异常—心内膜垫缺损导致,2018版指南提出,目前对抗SSA、SSB抗体阳性孕妇胎儿的房室传导阻滞使用糖皮质激素治疗是否有效尚不确定,仍在研究阶段。
1.2 染色体异常导致的胎儿水肿 染色体异常占NIFH病因的25%~70%,特别是在妊娠早期发现水肿或并发其他胎儿结构异常时,胎儿染色体非整倍体的风险更高[10]。SANTO等[11]研究显示妊娠24周前诊断的NIFH中,约50%为染色体非整倍体异常导致。以往研究也显示,在水肿胎儿中,Turner综合征及21-三体综合征发病率最高,约占水肿胎儿的13%,其次18、13及其他染色体三体综合征也可导致胎儿水肿[12]。因此,2018版指南与2014年美国母胎医学会指南均建议水肿胎儿查胎儿染色体,不推荐行无创母血胎儿染色体筛查。
与2014年美国母胎医学会指南不同的是,2018版指南更加强调了对水肿胎儿致病性拷贝数变异的检查。国家儿童健康和人类发展研究所的研究显示,患有先天性异常的正常核型胎儿中,致病性拷贝数变异的检出率达7%[13]。因此,所有NIFH胎儿应进行微阵列比较基因组杂交技术检测,可以取羊水、绒毛检测或于分娩后检测。
2018版指南强烈建议对所有产前没有诊断的NIFH胎儿或新生儿死亡后进行尸检,行X线检查评估可能的畸形综合征或骨骼发育不良;留存胎儿血液、组织、DNA和羊水的上清液以便将来进行生化或分子遗传检测;胎盘检查(显微镜,组织病理学)有助于肿瘤、贫血、感染和代谢病导致水肿的病因分析。
通过临床全面的检测及尸检,仍然至少有约20%的NIFH病因未明,对于这些病因未明的NIFH,二代测序检测有助于单基因病的检出,如Noonan综合征和多发性翼状胬肉综合征的诊断[14]。2018版指南强调对孕妇病史的搜集也有助于排除单基因病导致的胎儿水肿,如既往史和婚育史,以往的胎儿、新生儿或婴儿死亡情况,种族背景和血缘关系。对家族史孕妇需要完成三代谱系,包括死胎、婴儿死亡、发育迟缓、先天性畸形、遗传综合征、骨骼发育不良、慢性婴儿疾病、遗传性心肌病和神经退行性疾病等。
1.3 贫血导致的胎儿水肿 贫血占NIFH病因的7%,包括遗传性地中海贫血、纯合突变的球形红细胞增多症,以及B19感染、胎母输血综合征等因素继发的胎儿贫血[15]。遗传性地中海贫血为常染色体隐性遗传病,因遗传性地中海贫血导致的胎儿水肿又称为巴氏水肿胎,在地中海、非洲和东南亚人口中发病率较高,如在中国南方,妊娠20周后诊断的纯合子α地中海贫血占NIFH的55.1%[16]。可对孕妇及其配偶进行血常规筛查,患者表现为红细胞体积较小[8]。与2014年美国母胎医学会指南相同,2018版指南也推荐对于疑似贫血的胎儿使用胎儿大脑中动脉血流超声多普勒检测大脑中动脉血流峰速(MCA-PSV)确认胎儿贫血,妊娠16周后MCA-PSV与胎儿血红蛋白显著相关,尤其在胎儿极度贫血时[17]。对于各种原因的胎儿贫血,MCAPSV超过中位数的1.5倍对预测胎儿贫血的灵敏度达100%[18]。当怀疑贫血时,应通过脐血检测来确认,以便迅速开始治疗(宫内输血)。通过羊水或脐血基因检测可对地中海贫血的基因型确诊,并告知父母遗传性地中海贫血预后不良、25%的再发风险、未来妊娠需要侵入性产前诊断[19]。
严重贫血导致的心力衰竭是贫血胎儿死亡的主要原因,胎儿心力衰竭最常见的表现是房室增大,心力衰竭后心胸比也会增大,正常情况下,心胸比应<0.5[18]。
1.4 胎儿感染相关因素 宫内感染是胎儿水肿的常见原因(4%~15%),感染引起贫血、缺氧、内皮细胞损伤,从而导致毛细血管渗透性增加或心肌炎,导致水肿的宫内感染以B19病毒感染继发性贫血最为常见[20]。胎儿弓形体病和梅毒、巨细胞病毒、水痘一带状疱疹病毒感染也可表现为胎儿水肿,少数研究报道了柯萨奇病毒、单疱病毒2型和腺病毒也能够导致胎儿水肿[21],常伴发如肝大、脾大或腹腔积液(见表1)。B19病毒感染的主要超声特征是胎儿腹腔积液,有时会出现心肌收缩不良,严重时可导致胎儿死亡。2014年美国母胎医学会推荐对于B19病毒感染引起的继发性贫血NIFH胎儿进行宫内输血,可以显著改善预后[22],但是感染时胎儿常已出现腹腔积液,确诊B19病毒感染需要羊水或胎儿血清检测。英国一项包含476项的研究表明,在所有宫内感染的病原体中,巨细胞病毒感染是胎儿超声异常的最常见原因,巨细胞病毒会从感染后胎儿的尿液中排出,因此羊水中检测病毒是准确有效的诊断方法[22]。以往研究建议在妊娠21周后、母体感染6周后进行羊水检测,PCR是首选的检测方法,目前最先进的方法是实时定量 PCR[23]。
实验室检查分为血清学检测和病原体检测两类。血清学检测包括IgM、IgG和IgG亲和力检测,可提示是原发感染还是继发感染。IgM比IgG对于近期感染更有意义,但是IgM在部分患儿中能够持续存在数月甚至数年,因此确定是原发感染还是继发感染尚需参考IgG亲合力的检测结果。妊娠早期血清学检测有一定作用,能够用来确定免疫状态,为血清学转换提供证据。对于超声异常、母亲HIV阳性或有特殊临床表现的孕妇可以进行针对性的感染性疾病检查,如梅毒、埃博拉病毒。
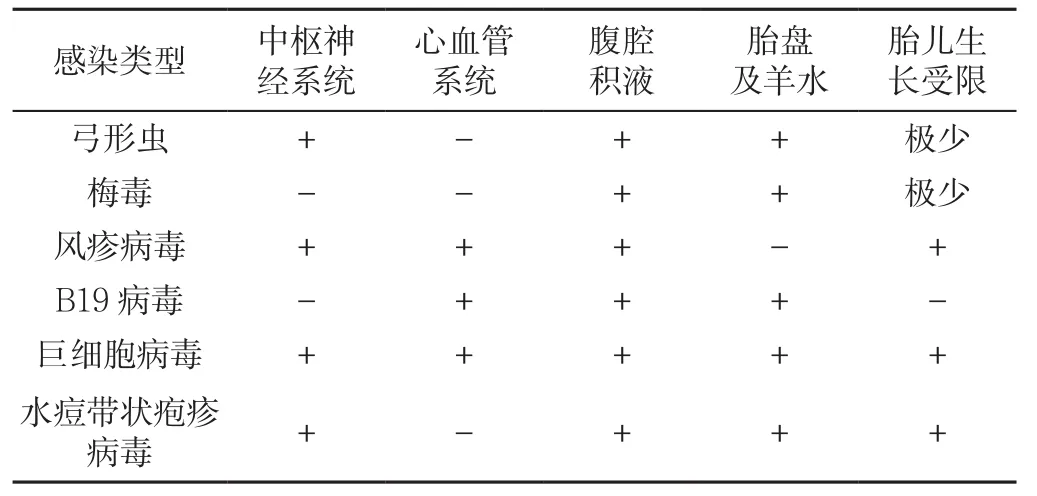
表1 感染因素导致的胎儿水肿的超声异常特点Table1 Ultrasonic abnormalities of fetal hydrops due to infective factors
1.5 其他引起胎儿水肿的病因 2018版指南详细介绍了目前越来越受到重视的代谢病导致的胎儿水肿。代谢病是特发性NIFH的原因之一,诊断或排除代谢病对于NIFH十分重要,因为这些单基因病有25%的复发风险[24]。溶酶体贮积症是NIFH中最常见的一类代谢病,以往研究NIFH胎儿中的溶酶体贮积症的检出率差异较大,为1.5%~15.2%[25-26],其中常见的疾病包括黏多糖病Ⅶ型、戈谢病、小儿半乳糖血症、2型戈谢病和婴儿游离唾液酸贮积症。戈谢病是由葡萄糖脑苷酯酶缺乏引起的隐性遗传性疾病,是溶酶体贮积症中常见的代谢病[27],根据临床表现可分为3型,其中由GBA1突变引起的致死型GD2型与胎儿水肿相关,常表现为胎儿水肿、关节弯曲、鱼鳞病,多数胎死宫内或出生后短期内死亡。半乳糖唾液酸沉积病为一种罕见的溶酶体贮积病[28],研究显示PPCA基因突变导致的半乳糖唾液酸沉积病在胎儿期可表现为胎儿胸、腹腔积液或水肿[29]。糖原贮积症Ⅳ型是GBE1突变所致糖原分支酶活性缺陷引起的类似支链淀粉多聚糖蓄积的常染色体隐性遗传病[30],发病年龄从胎儿到成年人不等,可引起妊娠中期胎儿水肿发展及运动功能障碍。GBE1突变所致的糖原贮积症Ⅳ型与NIFH相关,表现为运动功能障碍、关节弯曲、羊水过多,其他还有10余种其他先天代谢障碍可能会导致NIFH,如Niemann-Pick A型、Niemann-Pick C型、MPS Ⅰ型、MPS ⅣA型、黏脂病Ⅱ型、多重硫酸酯酶缺乏症、Farber病、Wolman病、Ⅰ细胞病、转氨酶缺乏症、皮尔逊综合征(线粒体疾病)和先天性糖基化疾病[31]。对于有代谢病家族史及复发原因不明的胎儿水肿,可以在培养的羊水细胞上通过检测特定的酶,或在羊水上清液中检测特定代谢物来进行诊断。特异性酶分析包括检测羊水细胞的乙酰肉桂酰胺-6-硫酸酯酶、β-葡糖醛酸酶、β-乳糖苷酶、β-葡萄糖苷酶、α-神经氨酸苷酶、鞘磷脂酶,或特异性代谢产物上的溶酶体存储障碍(总己糖胺酸酶、倍糖葡聚糖酶、α-甘露糖苷酶、壳三聚体酶)[25,32]。
另外,一些先天性胸腔内结构异常,如原发性乳糜胸、肺囊腺瘤、肺隔离症、膈疝、纵隔肿瘤等影响胎儿静脉血液回流的因素也会导致胎儿水肿,其他少见的原因还包括胎儿淋巴瘤、血管瘤、畸胎瘤、神经母细胞瘤等。
2 NIFH的诊断
关于NIFH的诊断,2018版指南提出了病因研究步骤:第一步为紧急,(1)胎儿影像:三级医疗中心的详细产科形态学超声和胎儿动静脉循环系统的评价,包括多普勒(大脑中动脉、静脉、动脉)、胎儿超声心动图。(2)母血:全血计数、Kleihauer-Betke试验(母血中找胎儿红细胞实验)、ABO血型和抗原状态、间接Coombs试验(抗体筛查)、梅毒实验室检查、准确的滴定度(细小病毒、弓形虫、巨细胞病毒、风疹)、肝酶、尿酸、凝血功能(可疑镜像综合征)、抗SSA、SSB抗体(胎儿心动过缓),取决于种族的检测:血红蛋白电泳、G6PD缺陷筛查。
第二步为介入/转诊/治疗,(1)羊水:无需培养的羊水细胞荧光标记的原位杂交技术(FISH)或荧光定量聚合酶链式反应(QF-PCR)检测,随后进行核型及微阵列分析、巨细胞病毒PCR诊断、B19病毒/弓形虫PCR检测(选择病例)、选择性巨细胞病毒和细菌培养、告知实验室保留羊水细胞和上清液以备将来研究使用。如果怀疑α-地中海贫血,应提取羊水DNA、胎肺成熟度检测(取决于妊娠年龄)。(2)胎血取样(母胎医学专家):全血计数、白细胞分类计数、血小板计数、直接Coombs试验、血型、染色体核型(标准)和基因微阵列分析,TORCH/病毒血清学检查,蛋白/氨基酸/肝功能检测(并非所有胎儿),血红蛋白电泳(取决于种族)。(3)体腔引流(在羊膜腔穿刺同时可以完成):引流液淋巴细胞计数、蛋白/氨基酸、肌酐/电离图(腹腔积液)、PCR检测CMV和病毒以及细菌培养。
第三步为分娩后〔和新生儿科医师一同咨询(依据妊娠年龄)〕:所有水肿胎儿进行胎盘检查,如果新生儿存活要进行详细的体格检查、颅脑超声、腹部超声、心脏监测、超声心动图、全血计数、肝功能、肌酐、清蛋白、蛋白质检测、TORCH、病毒培养,依据分娩前检查结果进行特定的检测;如果新生儿/胎儿死亡要进行临床影像学检查、胎儿细胞培养(皮肤、其他)、冷冻胎儿组织和羊水上清液、储存胎儿DNA、骨骼检查、胎盘病理检查、尸检。
3 NIFH的治疗及预后
水肿胎儿通常处于不稳定状态,即使很短时间的延误也可能影响预后。因此,2018版指南特别强调了紧急转诊的重要性。胎儿水肿作为一种紧急情况,应紧急转诊到三级医疗中心,由母胎医学专家和医学遗传学家进行快速评估,尤其是在妊娠16~18周后。包括脐静脉和大脑中动脉多普勒研究在内的超声检查均可以用于胎儿水肿的诊断及评估,如宫内输血、胎儿心脏复律或引流管放置,必要时尽快转诊,而无须等待全面的检测结果。
胎儿水肿的治疗方法取决于孕周、病因和严重程度。包括:(1)宫内输血治疗,准备O型Rh阴性、CMV-DNA阴性血进行交叉配血后输血。(2)胸腔积液、腹腔积液、胸腔囊性病变多次穿刺或分流,抽取胎儿胸、腹腔积液可作为胎儿水肿诊断和治疗措施;进行淋巴细胞计数、生化、蛋白质/清蛋白测定,组织学、病毒和细菌培养等检测。需要注意的是水肿胎儿进行内腔穿刺术后,胎儿丢失率(胎儿丢失率包括穿刺后宫缩引起流产的胎儿以及穿刺后发生死胎的胎儿)较高,约为11.32%[33]。(3)与心脏科医师密切合作,采用抗心律失常药物静脉给药或母体治疗胎儿心律失常。(4)对于严重和早期双胎输血综合征(Ⅳ期)伴水肿胎儿进行激光手术,在可能的情况下进行开放性胎儿手术,或对伴有NIFH的主要结构异常胎儿进行激光或射频消融治疗。产前体腔减压(胸腔积液、严重腹腔积液、严重羊水过多)可促进新生儿管理,减少产妇并发症。
2018版指南中NIFH的治疗:(1)针对贫血的宫内输血,如母体先天性血红蛋白疾病、胎母输血、胎儿溶血(G6PD)、胎儿继发于细小病毒感染的贫血;(2)多次穿刺或介入引流,如胸腔积液引流、腹腔积液引流、胸部囊性病变、先天性囊性腺瘤样畸形、隔离肺、肺淋巴管扩张症;(3)抗心律失常药物的静脉给药或母体治疗,如胎儿心动过速、房室传导阻滞(抗SSA/SSB抗体阳性);(4)胎儿手术、开放性胎儿外科手术或激光血管凝结/射频消融,如先天性囊性腺瘤样畸形、隔离肺、骶尾部畸胎瘤、双胎输血综合征(Ⅳ期);(5)其他,抗甲状腺药物(胎儿甲状腺功能亢进)。
除外染色体异常胎儿,NIFH胎儿的存活率为31%~48%,其中很大部分病因是致命的,对治疗反应很差,如果不进行治疗,预后通常很差,B19病毒感染导致的水肿偶有自发消退的情况[34]。
ISKAROS等[35]研究显示,妊娠24周前诊断为水肿的新生儿生存率<5%,妊娠24周后诊断水肿的新生儿生存率为20%。在一项关于23例NIFH的研究中,5例胎儿在除外了结构及染色体异常后,在妊娠22~32周接受了宫内治疗(4例羊水分流,1例宫内输血),水肿均有明显好转,妊娠持续至少35周,5名新生儿全部顺利出院[36]。
SCHREY等[37]对11例并发胎儿水肿的先天性肺囊腺瘤伴纵隔移位胎儿(大囊泡型)进行了宫内干预,放置了胎儿胸腔羊膜腔引流管,除有1例在放置引流管术后宫内死亡外,其余10例均待至足月。说明对于结构正常、核型正常的NIFH胎儿,宫内干预有很好的疗效。
最近两项研究探讨了分娩时水肿的新生儿预后。一项大型国家数据库的数据显示,先天性代谢病新生儿病死率最高(57.7%),先天性乳糜胸新生儿病死率最低(5.9%),分娩孕周小、5 min Apgar评分较低、在分娩后24 h内需要生命支持(高氧需要和高频通气)是与死亡相关的危险因素[38]。HUANG等[39]进行一项包含28例NIFH的研究显示,总体存活率为50%,淋巴管畸形婴儿的存活率为83%,妊娠<34周和血清清蛋白水平低是影响生存的两个不良预后因素。这些结果表明,NIFH的预后由于病因的不同有显著差异。为了更好地预测预后,有必要确定病因,提供产前治疗,并在三级医院分娩以改善分娩后结局。
4 小结
当妊娠期间出现已知的胎儿水肿时,应仔细监测母亲镜像综合征的发生。镜像综合征又称Ballantyne's综合征[5],指由胎儿水肿引起的母亲水肿,病因不清,病理生理改变同子痫前期,因孕妇预后较差,当镜像综合征出现时应考虑是否继续妊娠。
2018版指南认为,不同病因的NIFH预后存在显著差异,产前遗传学检查和母胎医学提供了潜在病因诊断的新方法。迅速转诊至母胎医学中心对胎儿进行评价和治疗可以显著改善妊娠结局。病因诊断可以更好地判断预后,提供适宜治疗,预测再发风险,做好再次妊娠的管理计划。
2018版指南增加了许多新的内容,如及时转诊可显著改善部分NIFH胎儿的预后。微阵列比较基因组杂交技术及二代测序技术有助于病因的查明,以及对代谢病相关的NIFH进行了详细的汇总,提高了医生对代谢病的认识。新内容对临床有重要的指导意义。对于NIFH诊治仍有许多方面需要医生及科研人员的努力,产前诊断机构须增加NIFH的检测项目,规范NIFH的诊治流程,以提高病因诊断率,改善预后。对病因不明NIFH进行二代测序及代谢病检测,进一步明确胎儿水肿所涉及的片段及基因。我国南方的原发性血红蛋白病高发,如遗传性地中海贫血。对于高发地区要加强宣传,加强筛查,减少巴氏水肿胎儿综合征的发生及重型遗传性地中海贫血胎儿的出生。
作者贡献:侯磊进行资料收集整理、撰写论文并对文章负责;王欣进行研究设计、评估、指导及质量控制。
本文无利益冲突。
