LAMP技术的染料、辅助剂的研究进展
2018-12-19贾晓曼马亚男李晓军
贾晓曼,翟 浩,张 勇,马亚男,李晓军
(山东省果树研究所,山东 泰安 271000)
病原物的检测在医学、农业、食品、海关等方面的需求极多,需要操作简便、效率高、条件简易、结果易观察、实地性强的检测方法,满足快速检测及现场检测的工作需要。环介导等温扩增技术(Loop-mediated isothermal amplification, LAMP)便具有上述特点[1]。自LAMP技术产生以来,已经在多种病原物的检测上得到应用。许多学者将LAMP与反转录、微流体、横向流动试纸条等技术结合起来[2-4],展示了广阔的发展和应用前景。本文从LAMP的原理、染料和助剂的选择及研究进展方面进行了综述。
1 LAMP的原理及检测
1.1 LAMP的原理
LAMP技术由Notomi等[1]于2000年首次报道。在65 ℃左右条件下,DNA处于动态平衡状态,可利用特异性引物及链置换DNA聚合酶,使链置换DNA不停地自我循环合成,终产物是含有若干反向重复目标片段和花椰菜结构的茎环DNA[1-5]。反应体系一般包括Bst DNA聚合酶缓冲液、Bst DNA聚合酶、dNTP、4条引物、模板DNA、辅助剂、Mg2SO4和染料等。反应中只需要Bst DNA聚合酶,即可在等温条件下进行基因扩增[1-5],其动态原理图可参考网站http://loopamp.eiken.co.jp/e/lamp/anim.html。LAMP具有以下优点:扩增效率高,扩增时间短,在15~60 min内便可使DNA量放大109~1010倍;特异性较高,产生大量扩增产物及焦磷酸镁沉淀,可通过观察沉淀来判断检测目标基因序列的存在[6-7]。
1.1.1 引物设计 Notomi等发现目的DNA大小选择在130~200 bp可获得最好的结果,超过500 bp时扩增效果差,因此,包含F2和B2的目的片段应小于300 bp[1]。可用在线软件Primer Explore (http://primerexplorer.jp/e/)确定引物区域及引物。图1摘自Mori[8],其中正向外引物F3与F3c区域互补,内引物FIP由与F2c区互补的F2区和与F1c区相同的序列组成,环引物LF与F2/F1区域互补,反向引物B3、BIP、LB同理。
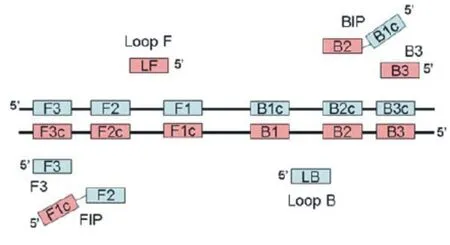
6个引物:F3、FIP、LF、B3、BIP、LB。6个区域:F3c、F2c、F1c、B1、B2、B3。
LAMP引物应符合以下要求:F2和B2的5′端之间的距离为120~180 bp;F2、F3以及B2、B3间的距离为0~20 bp。成环区域(F2的5′到F1的3′,B2的5′到B1的3′)的距离为40~60 bp。Tm值在正常或富含GC的情况下为60~65 ℃,在富含AT的情况下为55~60 ℃[1]。依据F1c/B1c的5′末端和F2/B2及F3/B3的3′末端6 bp的dG值小于-16.75 kJ/mol的标准,来确定引物末端的稳定性。除引物区域外的目的DNA若存在限制性内切酶位点,则可用于确认扩增产物的特异性[8]。
4个引物在初始步骤中与目的DNA的杂交会影响LAMP的效率,应选择合适的引物序列和长度,使Tm值在一定范围内。F2、B2的Tm值宜在60~65 ℃之间,即Bst聚合酶的最佳温度。Flc、Blc的Tm值应略高于F2、B2的,以便在从模板释放单链DNA后立即形成环状结构。F3、B3的Tm值应低于F2、B2的,以确保从内部引物起始的合成早于从外部引物起始的合成。此外,外引物与内引物的浓度比应在1/4~1/10[9]。也有研究者设计了环引物[8,10],环引物并非必需,但能将扩增时间缩短约1/3~1/2,可在30 min之内完成扩增[11]。
1.1.2 LAMP的反应过程 LAMP的反应过程如图2所示,摘自Mori[43],分以下3个阶段:
第一阶段为起始材料生产阶段。在60~65 ℃温度条件、Bst聚合酶的作用下,引物FIP的F2序列与模板F2c区域结合向前延伸,引物F3与模板F3c结合置换出完整的FIP链,FIP链上的Flc与F1碱基配对形成环状结构。引物BIP、B3的原理与引物FIP、F3类似,与FIP链结合延伸,最终产物两端均能形成环状结构,该哑铃状产物即LAMP循环扩增的起始模板。哑铃状产物有两种,分别暴露F2c和B2c端,形成没有先后,在整个反应体系中随机发生。
第二阶段为循环扩增阶段。以哑铃状产物为模板,引物FIP、BIP分别与F2c、B2c区域结合,开始链置换合成,解离出的单链核酸也会在两端形成哑铃状的结构。同时哑铃状产物以自身为模板,以3′末端的F1、B1区域为起点,进行DNA链置换及合成,形成新的茎环状结构,产物长度增加1倍。引物FIP、BIP上的F2、B2区域也可与之结合,启动新一轮的循环扩增。
第三阶段为延伸再循环阶段。引物FIP、BIP的F2、B2区域可以结合先前的产物进行扩增,产物也能以自身为模板进行合成,且产物长度增加1倍。由此下去,最终形成具有不同长度、不同数目茎环结构和反向重复序列的DNA混合物,电泳后呈现瀑布状梯形条带[1,10]。
1.1.3 LAMP的结果检测 判定LAMP结果的方法主要有以下几种:(1)Mg2+与从dNTP中析出的焦磷酸根离子结合,形成乳白色的焦磷酸镁沉淀,可通过观察是否产生白色沉淀,或应用实时浊度仪来监测反应结果[12-13],使扩增和产物检测能够一步完成;(2)加入染料观察是否产生相应的颜色变化[14];(3)进行琼脂糖凝胶电泳,看是否有典型的瀑布状梯形条带[1,10];(4)通过恒温扩增微流控芯片实时观察反应结果[15]。
染色检测法因其直观性和简便性而最为常用。根据染料对反应是否产生抑制,染料可在反应后或反应前添加。但在反应后开盖添加,易在空气中产生气溶胶,并在之后的检测中造成假阳性。染料和辅助剂的种类都会对反应效率及结果判断造成影响。因此,根据染料、辅助剂的作用特点进行合理的选择及应用,对LAMP结果的正确性和可靠性有重要意义。
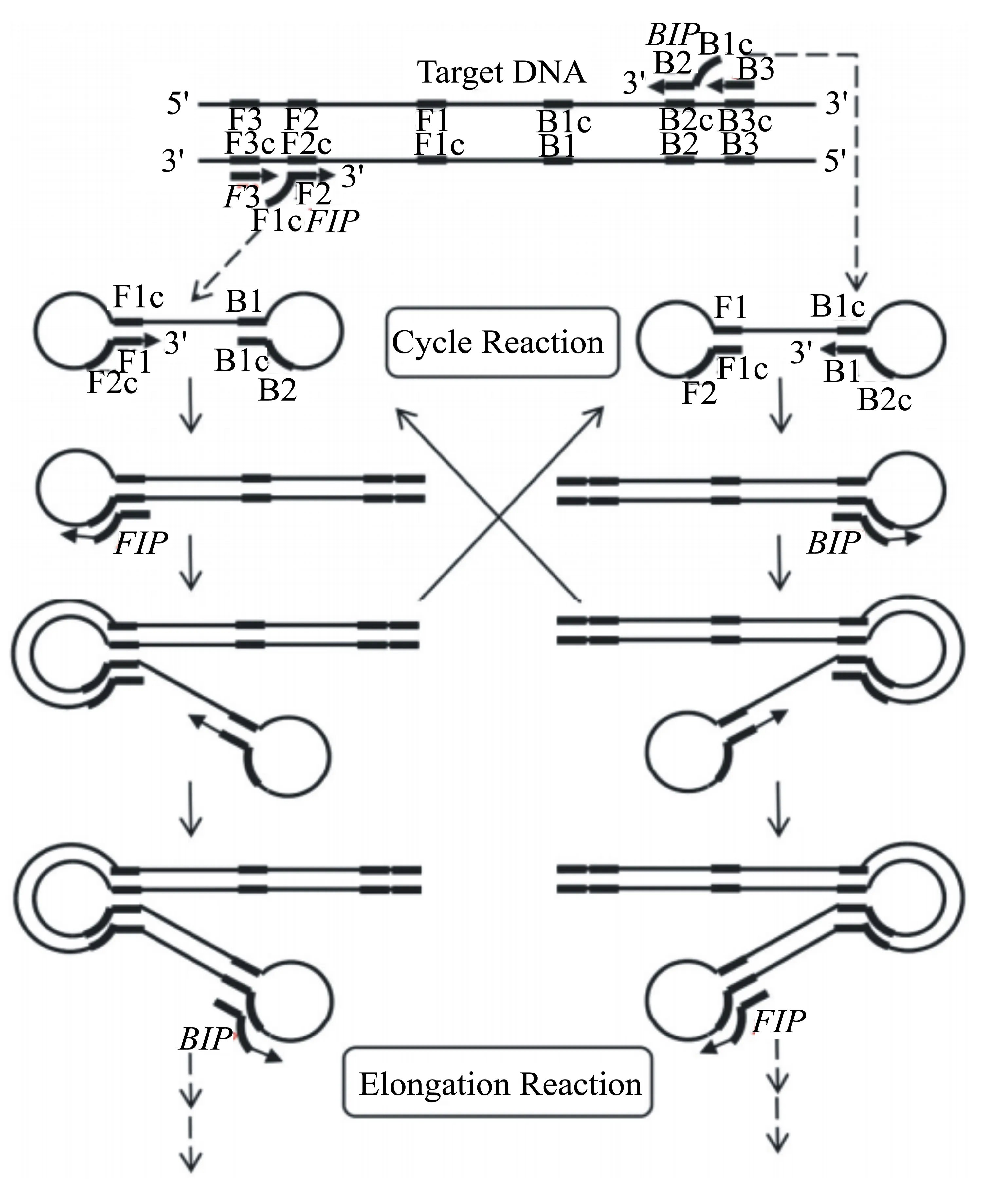
图2 LAMP机制示意图
1.2 染料的选择
染料的种类有很多,应用较多的有3种:钙黄绿素[10,16]、SYBR Green[17]和羟基萘酚蓝[18-20](表1)。
由于不同染料的作用原理不同,加入的时间和用量也不同,作用条件、颜色变化也有差异,观察者以个人标准判断颜色差异也会对LAMP结果造成影响。因此,如何合理地选择和使用颜料,是实验人员面临的重要问题。
1.2.1 钙黄绿素 钙黄绿素(Calcein)是一种络合指示剂和荧光指示剂。Tomita等[16]用钙黄绿素和氯化锰开发了一种有效的LAMP终点检测方法。将钙黄绿素溶于二甲基亚砜(DMSO)成5 mmol/L溶液,再用蒸馏水配制成0.5 mmol/L钙黄绿素、10 mmol/L MnCl2的储备溶液。钙黄绿素通过与适量的Mn2+结合而荧光淬灭,随着反应中产生的焦磷酸根离子与Mn2+生成沉淀,钙黄绿素与Mg2+结合,又产生荧光[10]。应注意在低浓度的Mg2+条件下,酶活性降低,产物量下降,在Mg2+浓度过高时,会出现非特异性反应,所以应选择合适的Mg2+浓度[21]。Loopamp荧光检测试剂(LMP221)的主要成分为钙黄绿素,并就其对紫外线的照射要求进行了研究,发现:当钙黄绿素处于短波长(240 nm)到长波长(370 nm)时,产生黄绿色荧光;在中间波长(325 nm)的激发光下荧光最强;当激发光接近320 nm时,虽然从阳性样品观察到的荧光增强,但阴性对照的荧光也加强。因此,建议在短波长(240~260 nm)或长波长(350~370 nm)的激发光下进行LAMP可视荧光检测,通过比较样品与阳性、阴性对照的荧光强度进行判断。

表1 染料的种类及使用量
1.2.2 SYBR Green I SYBR Green I的灵敏度较高,能结合到双链DNA的小沟部分,加入后会影响酶的效果,所以宜在反应结束后加入。但在反应后开盖加染料,产物会形成气溶胶,引起产物或后续LAMP反应的污染,从而造成假阳性[17]。不少试验人员选择将SYBR Green I于反应前滴加于反应管的盖上,反应后通过弹入或离心将染料与反应体系混匀,避免了对反应效率的影响及对产物的污染[22]。但需注意的是,在PCR仪开启热盖的模式下,染料会变干凝固,不易回溶,所以宜采用水浴或PCR仪不开热盖的模式。SYBR Green I不能特异性地指示扩增产物,在存在引物二聚体或非特异性产物的情况下也有荧光,易造成假阳性,对引物的设计要求较严格[4]。
1.2.3 羟基萘酚蓝 羟基萘酚蓝(hydroxy naphthol blue, HNB)可与Mg2+结合而呈紫罗兰色;随着LAMP反应的进行,从dNTP析出的焦磷酸根离子与Mg2+生成沉淀,失去Mg2+的HNB变成天蓝色,而阴性对照仍为紫罗兰色,阴性和阳性结果差异明显[22]。HNB在终浓度为120 μmol/L时对扩增没有抑制,可在反应前加入[23]。反应可在96孔微孔板中进行,用酶标仪测量650 nm处的吸光度,体系中的HNB暴露于环境光超过2周,颜色仍然稳定[23]。阴性反应的结果与甜菜碱的使用与否有关,使用甜菜碱时,阴性反应呈紫罗兰色,否则呈天蓝色[24-25]。
上述3种染料相互比较,SYBR Green I和HNB的检测灵敏度比钙黄绿素高10倍,可能由于Mn2+的抑制,或者钙黄绿素与DNA的相互作用引起钙黄绿素灵敏度的降低[23]。
1.3 辅助剂的选择
不同的辅助剂会对LAMP的效率和结果产生不同的影响,应根据辅助剂的作用特点进行合理的选择及应用。在使用助变性剂提高PCR反应的特异性和避免异常产物扩增中,需将辅助剂的用量控制在对酶活性没有抑制的范围内[25]。在高GC含量靶序列的扩增时,模板所具有的高变性温度会导致扩增效率降低,而助变性剂在降低Tm值和提高反应特异性方面有良好的效果[26-31]。
1.3.1 甜菜碱 DNA可能含有复杂的碱基(Py-G-C),使DNA聚合酶停滞而影响延伸。甜菜碱(Betaine)可通过提高富含GC区域的水合作用,影响DNA分子结构,降低碱基堆积力,增强DNA聚合酶的稳定性,帮助其顺利沿模板延伸[32]。Spiess等[34]发现,甜菜碱也能减少RNA二级结构,降低RNA的Tm,保持逆转录酶的活性。甜菜碱能降低高GC含量序列的Tm值,使引物的Tm值接近,使反应更加容易进行[33]。魏洪岩等[35]发现,甜菜碱的有无对于检测苹果根结线虫的LAMP扩增效果没有明显影响,且达到一定浓度后反而会抑制扩增反应,这主要是由扩增区域GC含量较低造成的。卢永灿[36]在扩增苹果褪绿叶斑病毒(ACLSV)和苹果茎痘病毒(ASPV)时,甜菜碱的浓度为0~1.6 mol/μL时条带有逐渐变亮的趋势,当不加甜菜碱或所加浓度过高时,均不利于反应的进行。所以不同反应体系应对甜菜碱的浓度进行优化,以便达到最优产物量。
1.3.2 L-脯氨酸 研究发现,使DNA螺旋不稳定的化学物质能显著提高LAMP的扩增效率。L-脯氨酸(L-Proline)跟甜菜碱一样,能减少碱基积累[33,37-38],刺激反应的整体速率,也能增加对目的DNA的选择性,并显著降低无关序列的扩增,从而提高结果的特异性[1]。
1.3.3 其他辅助剂 Fukuta等在RT-LAMP试验中采用了DTT,因为其中的巯基可以保护酶的二硫键,进而增加逆转录酶的稳定性[2]。也有研究者采用吐温20或NP40来消除核酸提取残留的SDS(0.01%及0.10%)的抑制作用[39]。也有研究者通过添加DMSO提高了检测的特异性和灵敏度[40]。
1.4 假阳性的预防措施
在LAMP反应中,可通过以下几点来避免假阳性的产生。
1.4.1 溶解液 不能使用含有螯合剂的缓冲液溶解钙黄绿素,如TE缓冲液,因为与钙黄绿素结合的Mn2+可被TE缓冲液中的乙二胺四乙酸(EDTA)螯合而产生荧光。此外,含有大量Ca2+和Zn2+的样品也可能会造成假阳性的结果[41]。
1.4.2 紫外照射 反应管不能长时间暴露于紫外灯下,否则可能由于荧光背景的增加或荧光的猝灭而导致误判。当紫外灯输出太强时,阴性对照也像有荧光发射,此时可将紫外灯远离反应管或改变反应管的角度,以便观察阴性、阳性对照间的差异。
1.4.3 气溶胶 在反应结束后,反应管尽量不开盖,因为开盖后产物会在室内形成气溶胶,造成测试区域的污染。LAMP的灵敏度较高,染色法检测易因气溶胶而产生假阳性。可将加样及开盖电泳进行分区实验,或使用封闭剂从而避免气溶胶污染的产生。刘威[42]以熔点为40~55 ℃的全精炼石蜡作封闭剂,于试验前加入,反应中封闭剂为液态,反应后为固态,将产物封闭于管底,杜绝了气溶胶污染造成的假阳性。为了防止扩增产物分散,使用过的反应管不应开盖,宜保持完全封闭,并用可密封的乙烯基袋子进行焚烧或双层包装,勿用高压灭菌器处理。
2 LAMP技术的应用前景
LAMP技术不仅能实现对DNA的检测,还可直接用RNA作模板,从而实现对病毒的检测。在判定LAMP扩增结果的方法中,沉淀法和染色检验法会因观察者的个体差异、颜色不明显而造成肉眼观察不便及误判,也不能满足高通量检测的要求;运用恒温扩增微流控芯片及实时浊度仪则需要购置昂贵的分析仪器。因此,许多学者都在寻找一种廉价、便捷、准确的判断方法。
2.1 RT-LAMP
在检测病毒时,因逆转录酶也存在链置换活性,可直接在LAMP体系中加入逆转录酶,即可在反转录的同时,完成对病毒的检测[43]。RT-LAMP可实现对ACLSC、ASPV[36]、黄瓜花叶病毒[44]、番茄黄叶病毒(TYLCV)[45]等的监测。由于LAMP所用的酶对生物样品中抑制物质的敏感性低,有助于节省样品处理所需的时间和成本[8]。RNA提取可选择简单的方法,用400 μL 0.5 mol/L NaOH研磨100 mg组织,直至没有大片组织。从该提取物中快速转移10 μL至含有490 μL 100 mmol/L Tris-HCl (pH 8.0)的新管中,充分混合,并取1.5 μL到25 μL反应体系中,用于RT-LAMP试验[39,46-47]。
2.2 LAMP+纸质微流体技术
2007年Whitesides团队[48]首次提出的纸质微流体技术,又称微流控纸基分析设备(Microfluidic pape-based analytical devices, μPADs),简称纸质芯片[3],是近几年微流控芯片发展的新方向。LAMP与纸质微流体技术结合,有助于实现低资源环境下基因即时检测系统的使用[8]。纸质芯片以滤纸或层析纸为材料,通过切割或疏水材料处理制成含微通道的2D设备,或通过堆叠、折叠制成3D设备。将LAMP技术与芯片整合,通过仪器传感定量检测或肉眼观察检测,可同时检测多个基因和样本,完成对病原菌的高通量检测,简便低廉,在现场检测等资源有限的条件下也可进行[49]。
2.3 LAMP-LFD
LAMP-LFD通过LAMP技术与横向流动试纸条技术(Lateral flow dipstick, LFD)相结合,使LAMP结果更加直观。Sano等[50]建立的检测微量抗原技术是LFD的基础,LAMP-LFD技术结合了分子生物学手段和免疫层析技术。在LAMP反应结束后,将试纸条直接插入到缓冲液和扩增产物的混合溶液中5~10 min,由生物素标记的LAMP产物与由异硫氰酸荧光素(FITC)标记的探针特异性杂交形成免疫复合物,由于层析作用而扩散,与试纸条上具有生物素抗性的检测线结合而显色,未杂交的探针和抗体形成二元复合物,继续扩散并与质控线结合显色。LAMP-LFD最低可检测5 pg的DNA[51],具有结果直观、灵敏度高、设备简单、成本低的优点,可应用于病毒、细菌、真菌、转基因产品的检测等[4,35]。
3 总结
LAMP技术所需设备简单,反应速度快,反应结果特异性高,易判定。染料法检测虽然结果直观,但不同的染料对操作的要求不同,需注意区分;染料法也可以结合吸光度检测、沉淀观察、电泳等进行检验。应根据目的DNA的GC含量等实际情况选择辅助剂的添加浓度,以免抑制反应的速率。LAMP与纸质微流体、LFD等技术相结合,使其应用更加便利和广泛,可视化程度增加,在农业病害检测、食品安全检测、海关检验检疫中的应用前景更加广阔。
