植物对盐胁迫的响应及耐盐调控的研究进展
2018-12-19王康君樊继伟孙中伟郭明明张广旭郑国良
王康君,樊继伟,陈 凤,李 强,孙中伟,郭明明,张广旭,郑国良
(连云港市农业科学院,江苏 连云港 222000)
我国盐渍化土壤面积约3600万hm2,盐碱化的耕地约760万hm2,占全国可利用土地总面积的4.88%[1]。土壤盐渍化严重影响植物的生长,是自然界的非生物胁迫之一[2]。土壤中的高浓度Na+会引起盐胁迫,影响植物体内的水分循环系统,积累有毒离子,引起植物毒害[3]。盐胁迫对植物的影响最直观的表现为抑制种子萌发[4-7]、降低光合作用、阻碍植株生长[4,6,8]等,这些影响在植物生长的不同时期表现有所差异[9],不同植物种类也会对盐胁迫表现出不同的敏感性[10]。前人研究表明,植物通过各种生理及分子机制来适应盐胁迫环境,这些机制包括渗透调节、转录调控、信号转导等[11-12]。因此,通过研究植物响应盐胁迫的生理及分子机制,培育耐盐品种,研发提高植物耐盐能力的调控措施,对提高农业生产力意义重大。本文综述了盐胁迫对植物生长产生的影响,植物对盐胁迫的响应机制以及调控植物耐盐性的途径,并展望了提高植物耐盐能力的研究,旨在为植物耐盐性研究及相关耐盐育种工作提供理论依据。
1 盐胁迫对植物的危害
1.1 盐胁迫对植物产生危害的形态表现
根系是植物最先感知盐环境的器官,盐胁迫会导致植物根系发生一系列的变化,比如单株平均根数减少、幼苗主根变短、侧根数变少、根系鲜重下降、根总面积减小[13-15];茎是输送水分、无机盐等养分的器官,土壤盐分过高会对植物茎的生长造成影响,主要表现为株高变矮、分蘖减少、生物量的降低等[16-17];叶片是植物进行光合作用及蒸腾作用的主要器官,受到盐胁迫时,植物叶片的外部形态会发生变化,如有的植物叶片会发育出盐腺,把体内过多的盐分排出体外以降低盐胁迫危害[18-19];还有的植物通过增厚叶片及表皮细胞角质层,使叶片储水能力增强,从而减少蒸腾[20-21]。
1.2 盐胁迫对植物产生危害的生理表现
盐胁迫首先引起植物遭受渗透胁迫,然后造成离子失调,继而导致离子毒害,并引起营养元素的亏缺,最后引起氧化胁迫导致膜透性改变、生理生化代谢紊乱及有毒物质积累,最终影响植物的生长发育及形态建成[22]。
1.2.1 渗透胁迫 土壤盐分过多,会导致植株根系周围土壤中水势降低,当细胞外的水势低于细胞内的水势时,会造成植物吸水被抑制,使得细胞内的水分向外倒流,引起生理干旱[23]。土壤盐浓度过高还会引起植物细胞的渗透势增加、气孔导度下降及叶绿体受损,影响植物的蒸腾作用,导致其生长发育受到抑制,甚至死亡。
1.2.2 离子失调 土壤中的盐分大多以离子形式存在,K+是植物生长发育所需的重要离子,其可作为细胞内60多种酶的活化剂,能够促进蛋白质与糖类的合成及运输,是形成细胞渗透势的重要成分[24]。造成植物盐害的主要离子是Na+,因为其与K+的离子半径及水合能相似,所以对K+表现出明显的竞争性抑制作用,也导致盐胁迫会造成植物同时受到Na+毒害与K+亏缺的伤害[25]。钙是植物的重要营养元素之一,参与植物体内多种生理过程的信号转导[26],由于盐胁迫下Na+和Cl-大量进入细胞,使细胞质中Ca2+水平增加,导致其介导的钙调蛋白调节系统及磷酸肌醇调节系统失调,进而造成细胞代谢紊乱甚至死亡[27]。此外,盐胁迫条件下,植物对NH4+和NO3-的吸收也会受到抑制[28]。
1.2.3 生理代谢紊乱 盐胁迫会抑制植物的生长发育,引起一系列的代谢失调。过高的盐浓度会降低PEP羧化酶和RuBP羧化酶的活性,使叶绿体分解,进而干扰到叶绿素和类胡萝卜素的生物合成,气孔关闭,光合作用受到抑制[29]。盐胁迫引起植物气孔关闭,导致胞间CO2浓度降低,会产生单线态氧(1O2),其是一种活性氧,性质比氧气更活跃,氧化能力也更强,活性氧会破坏细胞膜结构,引起线粒体DNA突变,造成细胞衰老,导致细胞内质网膨胀、液泡膜破碎等[22];盐分过多还会降低植物蛋白质的合成,加速蛋白质的分解,并在植物体内积累有毒代谢产物[30]。
1.3 不同植物的耐盐能力存在差异
在禾谷类作物中,大麦的耐盐性最强,水稻耐盐性最差,小麦属于中等耐盐作物;高冰草与小麦同源性较高,是最耐盐的单子叶植物之一。相较单子叶植物而言,双子叶植物的耐盐性差异更为显著,例如豆科植物对盐胁迫的响应较水稻更为敏感,而苜蓿及滨藜等表现出极强的耐盐性[10]。同样是沉水植物,川蔓藻在70 g/L以下的盐度环境下都能存活,篦齿眼子菜可以生长在盐度低于18 g/L的水体中,狐尾藻通常分布在盐度低于10 g/L的水体中,角果藻只能生长在低于5 g/L的水体中[31]。有研究者对6种湿地常见植物进行耐盐性研究,发现芦苇、香根草、香蒲和美人蕉相较水葱和黄花鸢尾耐盐能力更强,它们分别通过减少Na+的吸收,并增加K+的吸收以平衡整体渗透压,进而降低盐离子的毒性;或是在吸收盐离子的同时,增加体内薄壁细胞和细胞液以稀释体内盐浓度;芦苇和香蒲则是将吸收的Na+积累在茎和叶中以提高对高盐环境的适应性[32]。大红花、狗牙花、鹅掌藤及花叶假连翘是南方海滨沙地常见的园林植物,其在耐盐试验中表现出明显的耐盐性差异:花叶假连翘和狗牙花相对另外2种植物的耐盐能力更强[33]。此外,还有诸多研究指出,多倍体化可以增强植物的抗逆能力,同源多倍体的耐盐性要优于其同源二倍体,如在盐胁迫条件下,四倍体的水稻、马铃薯、柑橘、刺槐等的细胞膜与叶绿体受损伤程度相比其同源二倍体轻得多[34-37]。四倍体植物既是优良的种质资源,同时又为三倍体和高倍性资源育种提供了基础,在遗传改良中具有重要的价值[38]。
2 植物对盐胁迫响应机制
植物对盐胁迫响应机制主要包括渗透调节与离子分布、盐分的外排和细胞内区隔化、活性氧清除及基因的转录调节等几个方面。
2.1 渗透调节与离子分布
在盐胁迫条件下,为了保持细胞内的水分可以维持正常的生理代谢,细胞会进行渗透调节以降低细胞内的水势,促使水分的跨膜运输朝着有利于细胞生长的方向移动,即渗透调节是植物耐盐的主要机理。盐胁迫下参与植物渗透调节的物质主要分为2类:一是主要从外界环境中吸收的无机离子;二是由细胞内合成的有机溶质。
在盐胁迫环境下,植物会从土壤及细胞外界溶液中吸收Na+、K+、Cl-等不至于造成极高浓度或表现出毒性的离子,以提高细胞内的盐分浓度,提高渗透势。然而,无机离子的积累虽然可以帮助细胞获得一定的水分,但离子浓度过高却会伤害细胞内的生理系统,因此,为了与细胞质隔离,无机离子进入细胞后往往会被运往液泡。细胞质则受到外界环境与内部液泡的双重胁迫,其会通过合成一些小分子有机物进行内外渗透势的平衡,用以降低水势从而维持植物体内的水分平衡,保证正常生长。参与渗透调节的有机物质主要包括氨基酸及其衍生物(甜菜碱、脯氨酸、甘氨酸等)[39-40]、糖类及其衍生物(如甘油、甘露糖醇及赤藓糖等)[41]、叔硫酰化合物(如β-二甲基硫代丙酸)[42]等,这些物质对细胞无害,不会抑制代谢。
通过吸收离子进行渗透调节有利于缓解渗透胁迫,为了避免离子毒害,植物往往通过对离子的选择性吸收、外排和区域化来维持细胞内生理代谢所要求的动态平衡,进而表现出不同程度的耐盐性。
2.2 盐分的外排和细胞内区隔化
植物对盐胁迫响应的另一重要机理是盐分的外排及在细胞内的区域化分配。液泡是植物成熟细胞内的最大细胞器,其在膨压调节、代谢产物储存、有毒物质积累和信号转导等方面起着重要作用。液泡膜上存在的H+-ATPase和H+-PPase两类质子泵分别通过水解ATP和PPi向液泡内转运质子,并在膜两侧形成质子梯度,然后以此作为驱动力,通过液泡膜Na+/H+逆向转运蛋白将细胞质中的Na+泵入液泡内,以减轻细胞质中Na+对蛋白质的毒害作用,并起到渗透调节作用,缓解水分胁迫(图1)[12,43](在Deinlein[12]及Taiz[43]等基础上修订)。此外,进入根细胞的Na+在液泡中积累后,减少了向地上部的运输,减轻了对地上部光合作用的影响,因此,液泡膜上的Na+/H+逆向转运是细胞盐分区域化的基础。
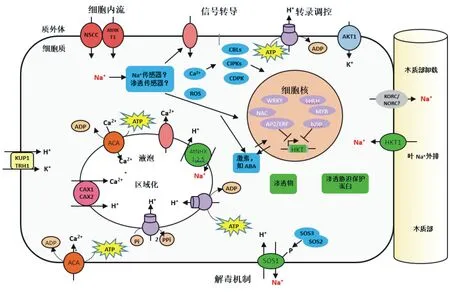
ABA:脱落酸;ATP:三磷酸腺苷;ADP:二磷酸腺苷;CBLs:钙调磷酸酶B类蛋白;CDPKs:钙依赖蛋白激酶;CIPKs:CBL互作蛋白激酶;HKT:高亲和性K+转运蛋白;KORC:K+外向整流电导;NORC:非选择性外向整流电导;NSCC:非选择性阳离子通道;ROS:活性氧;SOS1:质膜Na+/H+逆向转运蛋白;AtHKT1:Na+通道;AKT1:K+通道;ACA:液泡膜/质膜Ca2+-ATP酶异构体;KUP1/TRH1:K+-H+高亲和协同转运蛋白;AtNHX1,2,5:液泡膜逆向转运蛋白;CAX1,2:Ca2+/H+反向转运体;VP:液泡膜H+磷酸化酶;NAC、WRKY、bHLH、AP2/ERF、bZIP:位于细胞核的转录因子,其中AP2/ERF和bZIP负调控HKT基因的表达。
2.3 活性氧(Reactive Oxygen Species,ROS)清除
ROS是植物有氧代谢的副产物,但其也是参与调控植物的生长发育及各种胁迫反应的重要信号分子。在正常状态下,ROS的产生与清除是一个动态平衡过程,盐胁迫会使植物体内活性氧的产生与清除系统失去平衡,积累大量ROS,如H2O2、O2-、OH-等,若不及时清除,则会对植物细胞造成氧化损伤,导致细胞内的蛋白质、膜系统及光合作用等受到直接破坏[44]。为避免伤害,植物体进化出酶促和非酶促2个活性氧清除系统,抗氧化酶主要包括超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、谷胱甘肽还原酶(Glutathione reductase,GR)等[45]。SOD能够将O2-反应生成H2O2和O2,在活性氧清除过程中发挥着重要作用;CAT和POD主要存在于植物的过氧化物体中,它们的主要作用是清除H2O2等;APX主要存在于植物叶绿体和胞浆中,以抗坏血酸为电子供体,与H2O2的亲和力相对于CAT弱许多。研究表明,APX可能是调节起信号作用的活性氧含量,CAT主要负责清除过量活性氧,而POD可能主要负责清除低浓度H2O2。诸多研究者对盐胁迫下植物幼苗抗氧化酶活性的变化进行了大量的研究,但由于试验条件及操作方法不同,研究结果也不甚一致[46-48]。非酶促的抗氧化剂有抗坏血酸(AsA)、半胱氨酸(CyS)、类胡萝卜素(CAR)、生物碱(ALK)、α-生育酚(VE)、类黄酮(FLA)及还原性谷胱甘肽(GSH)等,可以有效协助抵抗胁迫所产生的伤害[49]。
2.4 基因的转录调节
耐盐性是由多个基因共同控制的数量遗传性状,在盐胁迫条件下,转录因子通过自身表达的变化调控着各种基因的表达水平,进而影响植物的耐盐性。报道指出的几个核心转录因子家族包括bZIP转录因子、WRKY、AP2/ERF类、MYB类、DREB类、bHLH类及NAC类,其中bZIP转录因子是数目最多、多样性最广泛的基因家族之一。Johnson等[50]通过观察长期处于盐胁迫下小麦的生长发育发现,对盐胁迫较敏感的品种,其bZIP基因表达上调,而较为耐盐的品种bZIP基因表达下调。陈成等[51]通过对拟南芥野生型及Hira-1突变体进行盐胁迫处理,发现Hira-1突变体对高浓度盐胁迫处理更加敏感,因而认为拟南芥中AtHIRA很可能在盐胁迫响应方面起着一定作用。苏莹等[52]利用RT-PCR和RACE技术,通过基因克隆研究发现,盐胁迫会使转基因棉花中GhWRKY41基因表达量显著上升,该基因的过表达又可以提高转基因棉花的衣分,因而认为GhWRKY41参与了棉花响应盐胁迫的应答过程,且过表达可以提高转基因棉花的耐盐性。
SOS信号(Salt Overly Sensitive)传导途径主要负责将根系细胞中的Na+排出,其参与维持植物离子的动态平衡,与植物的耐盐能力有着密切的关联。有研究者通过对拟南芥突变体进行筛选,获得了5个基因位点的突变,其中SOS1、SOS2、SOS3三个基因参与了介导细胞内离子平衡的信号传导途径[53]。当植物处于高浓度盐分胁迫时,SOS2和SOS3共同参与并调控SOS1 mRNA蛋白的含量和磷酸化过程,通过V-ATPase的催化调节,SOS3-SOS2蛋白激酶复合体调控质膜上SOS1的表达,进而将Na+排出植株体外,维持细胞内Na+与K+的平衡,使植物可以忍受较高浓度的盐胁迫[2,54-55]。
耐盐相关基因的表达受到多种途径的调控,如DNA甲基化[56-57]、Ca2+信号传导[58]等。DNA甲基化直接影响盐胁迫相关基因的表达,植物主要通过去甲基化酶基因Ros1(Repressor of Silencing 1)介导的碱基切除修复实现DNA去甲基化。盐胁迫会促进Ros1的表达,降低基因组DNA的甲基化水平,提高植物耐盐性。介导SOS途径的SOS1离子转运体的表达与活性受到Ca2+应答的SOS3-SOS2蛋白激酶复合体的调控。
3 植物耐盐性的调控研究
3.1 耐盐锻炼
植物受到盐胁迫时会诱导一些盐相关蛋白表达量的增加或下降,有研究对小麦幼苗进行耐盐处理(耐盐锻炼)时发现,某些耐盐相关基因特异表达,使抗盐蛋白表达量增高,当其再次受到高盐胁迫时,幼苗体内残存的代谢产物会对胁迫应答产生影响,某些相关蛋白会更快速地表达,从而提高耐盐性[59]。刘晓忠等[60]对水稻进行幼苗期低盐锻炼发现,低盐(0.1% NaCl)锻炼可以刺激叶片中SOD及CAT等酶活性升高,增强植物地上部组织活性氧的清除能力,减轻活性氧诱导的脂质过氧化作用所造成的伤害,增强水稻的耐盐能力。
3.2 外源化学物质调控
对于逆境胁迫,植物往往会通过调节内源激素水平来缓解胁迫伤害。诸多研究也指出,外源化学物质对缓解作物逆境胁迫有显著作用[61-62],主要有以下几种调控方式。
3.2.1 激素调控 激素调控是植物在应对各种胁迫环境下的基本调控途径,且不同激素间存在着相互作用[63]。调控盐胁迫报道较多的主要有以下几种植物激素。
赤霉素(Gibberellins,GA):是一类较大的萜类化合物家族,可以缓解盐胁迫对植物种子萌发及植株生长的危害。GA对盐胁迫下种子萌发的影响主要表现在以下几个方面:(1)GA可以诱导内聚甘露糖酶、β-1,3-葡聚糖酶等水解酶的合成,这些酶可以帮助种子打破种皮、胚乳等的机械阻力;(2)GA可激发液泡膜H+-ATPase的活性,形成跨膜电化学梯度,为各种溶质分子跨膜运输提供驱动力,增加种子萌发时的耐盐性。
脱落酸(Abscisic Acid,ABA):是最重要的植物激素,植物可以通过调节ABA含量来应对冻害、干旱、盐胁迫等各种环境胁迫[64]。高盐胁迫下施用一定浓度的ABA可以显著增加幼苗的株高、根长、鲜(干)重等,提高植株体内的抗氧化酶活性,保护膜系统的完整性,增强玉米、黄岑、甘薯、水稻等在高盐条件下的适应性[65-68]。此外,ABA由于可以诱导盐胁迫相关基因的表达,如离子转运蛋白(H+-ATPase、Na+/H+逆向转运蛋白、H+-PPase)、渗透调节物质合成相关蛋白(脯氨酸、甜菜碱合成酶等)、抗氧化酶类等,使植株代谢减缓,从而增强植物对盐胁迫的忍耐能力[69-70]。
水杨酸(Salicylic Acid,SA):作为一种植物内源信号物质,水杨酸影响着植物的离子吸收与转运、光合作用及生长等生理生化过程,其可以缓解植物由于盐胁迫造成的膜脂过氧化作用[71]。Erdal等[72]通过对培养2周的小麦幼苗进行叶面喷施不同浓度的水杨酸(SA)发现,SA处理显著增加了盐胁迫下小麦根系及幼苗的鲜重与干重,显著增加了过氧化物酶及过氧化氢酶活性,降低了H2O2含量。刘亚栋等[73]的研究结果还表明,SA浸种处理显著降低了盐胁迫下小麦幼苗体内的Na+含量,显著提高了K+、K+/Na+比值,研究结果与前人一致[74]。Morad等[75]通过对盐胁迫下小麦幼苗进行叶面喷施SA研究发现,小麦的生长发育相较盐胁迫下无外源SA处理受到显著促进。
此外,还有乙烯(Ethylene,ET)[76-77]、生长素(Auxin)[78]、茉莉酸(Jasmonate,JA)[79]等也可以调节植物的耐盐性。
3.2.2 其他化学物质 硝普钠:作为外源NO供体,硝普钠浸种可以刺激盐胁迫下种子萌发,增加胚根、胚鞘干重,降低胚中脯氨酸含量,提高发芽率,增加盐胁迫下植株体内SOD、POD、CAT等抗氧化酶活性及抗坏血酸、脯氨酸及总酚含量,通过调节抗氧化防御机制,有效缓解盐胁迫造成的危害[80-82]。
硅:为地壳中第二丰富的元素,易获得,有益于大多数高等植物的生长。前人研究表明,硅能促进植物的生长发育,缓解逆境胁迫[83-84]。郑世英等[85]在水培条件下研究了外源硅对盐胁迫条件下小麦的影响,结果表明:施用适当浓度的外源硅,可以增加盐胁迫下小麦株高、次生根数量及茎、叶、根干重,增加净光合速率与气孔导度,降低细胞间隙二氧化碳浓度,显著提高小麦的抗盐性。外源施硅可降低O2-·及H2O2的含量,提高SOD、APX、POD的活性,增加叶绿素含量及光合速率[86],降低植物中Na+含量,提高K+含量及K+/Na+,尤其可以提升植物根系对K+和Na+吸收的选择性,进而缓解盐胁迫对植物造成的生长抑制[87]。Daoud等[88]关于硅对缓解不同小麦生育阶段盐胁迫的研究结果表明,相比于其他生育期,硅对缓解孕穗期小麦受到的盐胁迫效果更显著。
褪黑素:有研究以猕猴桃实生苗为试验材料,用不同浓度褪黑素根灌预处理5 d后进行根灌盐胁迫处理,结果表明:褪黑素预处理可降低盐胁迫下猕猴桃叶片的相对电导率及活性氧含量,缓解可溶性蛋白的降解,增加脯氨酸及可溶性糖含量,有效缓解盐胁迫对猕猴桃幼苗的伤害,且以0.1 μmol/L的褪黑素预处理的效果最好[89]。
烯效唑:孟娜等研究发现,叶面喷施80 mg/L烯效唑能够有效缓解盐胁迫对大豆的伤害[90]。金喜军等研究证实烯效唑浸种对盐胁迫下糜子的萌发和幼苗质量均具有一定的调控作用,但这种调控作用受浸种浓度影响,并存在品种间差异[91]。
H2O2:一种重要的信号分子,在植物细胞受到胁迫时可以生成H2O2,并进一步调节应激反应的一系列信号转导[92]。研究表明,H2O2可以促进盐胁迫下小麦种子萌发[92]、羽衣甘蓝幼苗的生长[93],低浓度H2O2能促进植物幼苗中产生酶类与非酶类抗氧化剂,减少膜脂过氧化物的含量,进而提高其耐盐性[94]。
硫化氢(H2S):H2S已被证实参与调节植物的生长发育,包括种子萌发、根系形成及光合作用等,是继NO和CO后被发现的又一重要气体信号分子[95-97]。
其他见诸报道的调控物质还有硒(Se)[98]、氯化钙(CaCl2)[99]、α-生育酚[100]等。
3.3 肥料处理
除了上述外源化学物质的调节外,合理施肥也能有效缓解盐胁迫对植物造成的损害。有研究指出,在盐碱地区,氮是影响植物生长的主要因素,施氮能增大光系统Ⅱ(PSⅡ)最大光化学效率、潜在活性、实际光量子产量、非调节性能量耗散的量子产量、相对电子传递速率等,显著增加植物功能叶叶绿素与类胡萝卜素含量及叶绿素a/叶绿素b,提高PSⅡ光能利用率,进而增强植物对盐胁迫的适应性[101]。刘爱荣等[102]对盐胁迫下的高羊茅进行不同水平的施氮处理,结果表明,适宜浓度的氮素处理可以改善盐胁迫下高羊茅氮素营养、抗氧化能力及蛋白质表达量,增强其耐盐性。相似的研究结论也出现在段德玉等的研究报道中。代建龙等[103]研究指出,盐胁迫和施肥对影响棉花生长及肥料利用方面存在显著的互作效应,合理施肥能提高盐胁迫下棉花植株的肥料利用率,缓解盐胁迫,低盐浓度(0.15%)下的施肥效果好于中度盐胁迫(0.3%)下的。此外,施用钙肥也可以缓解盐胁迫对植物生长造成的不利影响,如史骁龙等[104]研究指出,施用钙肥有利于盐胁迫下花生植株的主茎、侧枝的生长,促进地上部干物质的积累。

表1 外源物质提高植物耐盐性的研究
除了上述调控途径外,还有研究者通过引入耐盐性植物的根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)来促进盐胁迫下植物的生长[114],植物根际促生菌是定殖于植物根际系统,可以通过产生抗生素及诱导寄主植物产生病程相关蛋白等途径,帮助植物抵抗逆境胁迫下的病原菌,促进植物生长[115]。有研究指出,PGPR可以通过形成生物膜增强植物的耐盐性[116]。
3.4 转基因遗传转化
转基因技术的成熟使得通过控制相关基因的表达来提高植物的耐盐性变得更加可行,很多研究结果证明:将编码逆向转运蛋白的基因过表达是一种有效提高植物耐盐性的方法(表2)。丁林云等从晋棉19中克隆出编码锌指蛋白的GhSAP1,研究发现:过量表达GhSAP1可以提高转基因烟草的耐盐性[117]。还有研究者将盐角草(SalicorniaeuropaeaL.)的液泡膜Na+/H+逆向转运蛋白基因NHX1与榆钱菠菜(AtriplexhortensisL.)的甜菜碱合成基因BADH在烟草中共同过表达,结果表明:转双基因植物相对转单基因植物耐盐性更强,说明NHX1和BADH双基因共同转化对耐盐性可产生加性作用效果[118]。同样的加性作用也出现在姜琦彦等的报道中,将TaLEA1和TaLEA2两个基因同时过表达显著提高了植物的抗盐性,且双基因过表达转基因株系抗性更强[119]。相关报道还见诸于很多其他植物基因,如TaNHX2基因可以提高转基因普那菊苣的耐盐性[120],过量表达棉花GaSus3基因可以增强拟南芥的耐盐性[121]。

表2 转基因提高植物耐盐性的研究
4 问题与展望
植物的耐盐能力受到多基因控制[129]。大量耐盐基因已被挖掘并通过转基因方法进行了验证,但非生物逆境十分复杂,涉及很多基因,不同基因之间的相互作用及其对提高植物抗逆性的机理还有待于进一步深入研究。随着生物技术的发展及后基因时代的到来,分子标记技术及蛋白组学等技术手段的进步能有效帮助我们快速准确地找到与胁迫相关的靶点基因与蛋白,让我们对信号转导与代谢通路有更深入的认识,帮助我们对植物的抗逆性状进行定向的改造。今后,我们应该运用现代分子生物学技术对一些耐盐新植物进行重点研究,挖掘耐盐相关基因并分离和克隆,为耐盐品种选育提供技术支撑。
植物的耐盐能力在一定范围内受栽培措施的调控,因此,开展通过栽培调控技术来提高植物耐盐能力的研究也是近年来的研究热点。目前,此类研究较多集中于调控措施对盐胁迫下植物外观形态的影响,部分研究也涉及植物生理性状的变化,但有关调控措施提高植物耐盐能力的内在机制研究报道较少。此外,目前的调控大多局限于试验研究,对于如何将研究结论应用于大田生产尚无显著进展。因此,提高植物的耐盐性需对耐盐性相关的内在生理生化机制进行更深入的研究,进而从耐盐品种选育与有效栽培措施调节两方面着手。
