植物过敏性反应分子机制研究进展
2018-12-19向婧姝
向婧姝
(贵州省疾病预防控制中心,贵州 贵阳 550004)
植物随时面临着自然界各种各样的威胁,却不能像动物一样通过移动来躲避,但在与病原物长期的相互博弈中仅有少数植物被成功侵染,这是因为植物在长期的进化过程中形成了一套有效的免疫防卫机制[1]。
植物外表皮有角质层、蜡质层、细胞壁等物质覆盖,组成了一道天然屏障,抵御了大部分病原微生物的侵袭。这道屏障是植物的第一道防线,又称被动抗性,对所有的病原物都有效[2]。植物的免疫反应,又称主动抗性,是在被病原物侵染后诱发的,主要有先天免疫反应和后天免疫反应2类,先天免疫反应包括病原物相关分子模式(pathogen-associated molecular patterns, PAMPs)和损伤相关分子模式(damage-associated molecular patterns, DAMPs)激发的免疫反应(PAMP-triggered immunity, PTI)、效应因子(effector)激发的免疫反应(effector-triggered immunity, ETI)[3];后天免疫反应也有2类:系统性获得抗性(systemic acquired resistance, SAR)[4]和诱导系统抗性(induced systemic resistance, ISR)[5]。
当病原物突破植物的第一道防线后,位于细胞膜上的模式识别受体(patten recognition receptors, PRRs)能够识别PAMPs,激发植物的免疫反应PTI[6]。PAMPs是病原微生物的重要组成部分,是在进化上高度保守的分子结构,例如鞭毛蛋白、延伸因子、几丁质等[7]。病原物会产生效应因子来干扰PTI,导致植物感病,称为效应因子激发的感病性(effector-triggered susceptibility, ETS)。但同时植物也有响应机制,植物进化出了专一性识别效应因子的抗性基因(resistance gene,R基因),其编码的蛋白具有核苷酸结合结构域和亮氨酸重复区(nucleotide binding, NB和leucine rich repeat, LRR domains,即NB-LRR结构)。该蛋白能够专一性识别病原物的效应因子,激发植物的ETI免疫反应,ETI可以加速并放大PTI反应,导致植物产生抗病反应,同时在侵染点附近会产生局部的细胞程序性死亡(programmed cell death, PCD)来抑制病原物扩散,即过敏性反应(hypersensitive response, HR)。病原物会继续进化出新的效应因子来避免植物的ETI反应,而植物也会随之进化出新的抗性蛋白来识别[8]。Jones等(2006)据此提出了一个拉链模式(zigzag model)来解释植物与病原物的互作过程[8],如图1所示。
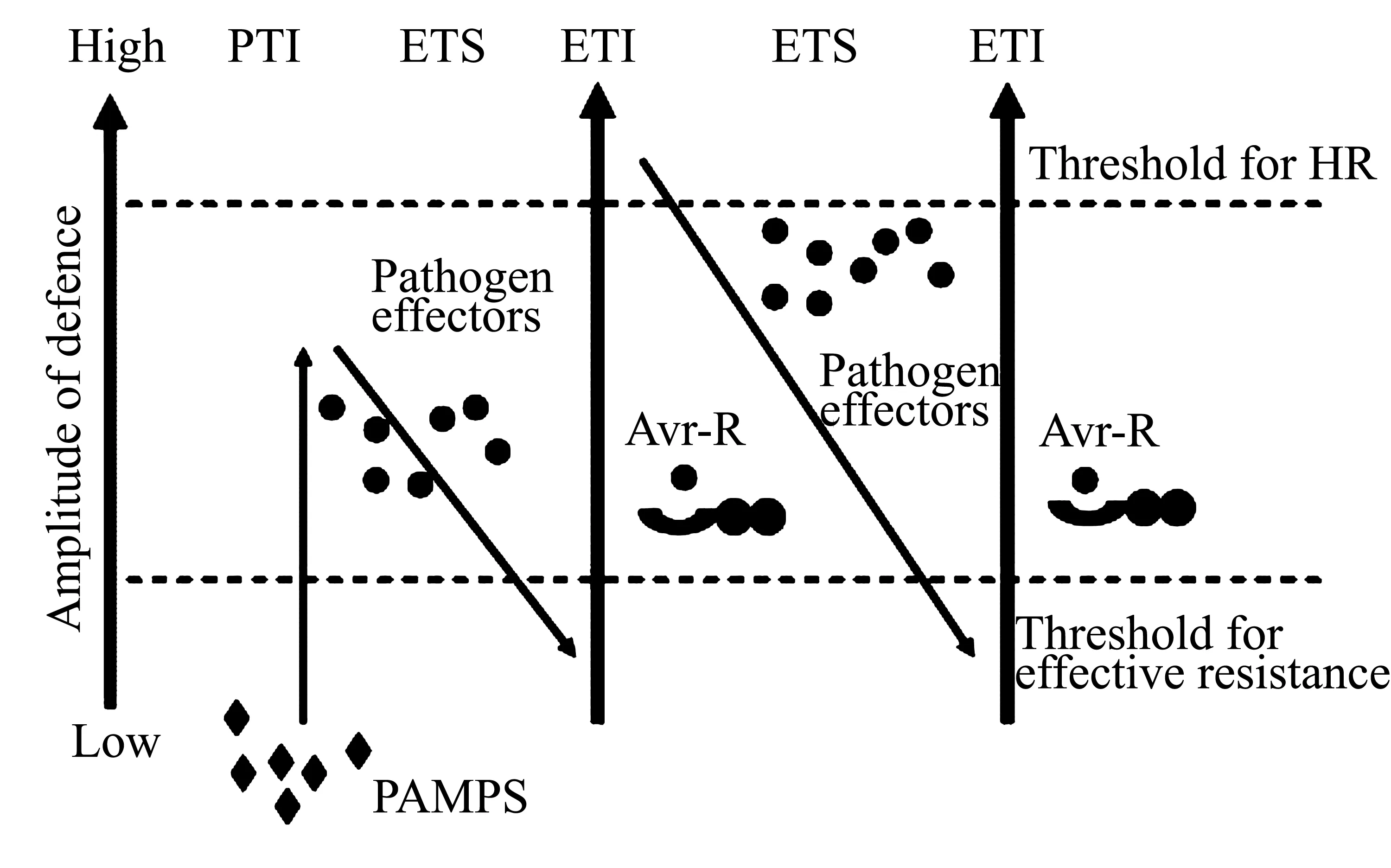
图1 植物与病原物互作的拉链模式
1 植物过敏性反应
病原物与植物的相互作用有2种:亲和互作(compatible interaction)引起植物感病;不亲和互作(incompatible interaction)导致植物抗病。植物过敏性反应(hypersensitive response, HR)是植物与病原物不亲和互作时,植物产生的一种防卫反应。过敏性反应这一概念最早由Stakman(1915)提出,用来描述锈病在其谷类抗病品种上形成的快速、局部的植物细胞死亡[9]。后来人们研究发现HR反应与植物的抗病性相关,在植物遭受病原菌侵袭后,植物受侵染点以及邻近组织快速坏死,从而限制病原菌的生长[10]。植物过敏性反应是一种细胞程序性死亡(PCD),主要包括植物识别病原菌、植物细胞死亡、抗病反应的激发、病原菌生长的抑制这4个方面[11]。
根据Flor(1971)提出的“基因对基因”假说[12],植物R基因编码的产物特异性地识别病原物无毒基因(avirulence gene)编码的产物并相互作用,在侵染点就会产生过敏性反应[13]。目前已经有很多研究证实了这一假说,Tang等(1997)发现番茄抗性基因Pto产物和无毒基因AvrPto编码产物在分子水平互作[14];Jia等(2000)利用酵母双杂交系统研究发现稻瘟菌的无毒基因AvrPita和水稻抗性基因Pita也能互作[15];Leister等(2000)发现拟南芥抗性基因RPS32蛋白和无毒基因AvrRpt2表达产物在叶肉的原生质体中瞬时表达时会发生免疫共沉淀[16]。
除了无毒基因编码的产物会在植物上引起过敏性反应外,一些激发子(elictor)也能引起HR反应,激发植物的抗病反应。Wei等(1992)从梨火疫病菌中分离到的蛋白质激发子harpin,能引起烟草的过敏性反应[17]。Kulye等(2012)从极细链格孢菌(Alternariatenuissima)中分离出一个蛋白质激发子Hrip1,能引起烟草的过敏性反应,并增强对烟草花叶病毒(TMV)的抗性[18]。Chang等(2014)从寄生疫霉上分离到一个蛋白质激发子OPEL,可以在烟草上引起HR,并增强植物的基础抗性[19]。
过敏性反应发生的同时,时常会伴随着一些相关的抗性事件,例如活性氧爆发、离子流、一氧化氮的产生、胼胝质积累、细胞外pH值升高、细胞壁木质化加厚、病程相关蛋白(pathogenesis-related proteins, PRs)的表达等[20-21]。这些抗性反应最早出现在侵染点细胞,尔后扩散到邻近的没有被侵染的细胞,最后扩散到整株植物产生SAR抗性反应,使得植物能够抵抗多种病原物[22]。
2 活性氧与植物抗病
活性氧(reactive oxygen species, ROS)是一类高氧化性物质的总称,主要包括过氧化氢(H2O2)、超氧阴离子(O2-)、羟基自由基(·OH)、单线态氧(1O2)、脂氢过氧化物(ROOH)等,主要来源于叶绿体和线粒体的一些酶促反应[23]。
植物自身有着良好的酶促清除系统和非酶清除系统,ROS在植物体内通常处于一种动态平衡状态,以维持植物自身正常的生理代谢[24]。当植物遭受到来自外界环境(如逆境、病原物侵害等)或自身的氧化胁迫时,活性氧会在植物体内大量积累。ROS作为有氧代谢副产物会对植物产生毒害作用[25],高浓度时甚至会造成植株死亡。但是活性氧同时也是一种信号分子,它作为第二信使调节着植物的新陈代谢。例如H2O2对拟南芥etr1-7乙烯受体功能缺失突变体中的气孔关闭起到干扰作用[26]。
活性氧爆发被认为是植物与病原物互作的早期事件之一,Doke(1983)首先发现在病原物与植物的非亲和性互作中会产生大量的ROS[27]。他用致病疫霉(Phytophthorainfestans)接种马铃薯,在发生过敏性反应的同时检测到了活性氧的产生,在不能引起过敏性反应的马铃薯中没有检测到活性氧,因此他认为ROS的产生与过敏性反应有直接的关系[27]。这一观点在后来的许多研究中得到证实。Vera-Estrella等(1992)用番茄叶霉病菌(Cladosporiumfulvum)侵染番茄,从发生HR反应的番茄叶片中提取细胞液感染同种番茄的悬浮细胞,产生了大量活性氧;但用没有发生HR反应的番茄叶片细胞提取液感染番茄悬浮细胞,其活性氧水平却不会升高[28]。Baker等(1993)用火疫病菌(Erwiniaamylovora)侵染烟草悬浮细胞后产生了Harpin蛋白,引起过敏性反应,并产生活性氧爆发,然而用不能产生Harpin蛋白突变体侵染烟草则不能引起活性氧爆发[29]。目前普遍认为过敏性反应中活性氧的产生与植物中的还原型辅酶Ⅱ(NADPH氧化酶)有关,并受钙离子调控[30]。Taniguchi等(2001)发现因病毒侵染烟草和番茄产生O2-的酶位于质膜上,可以与NADPH氧化酶的抗体反应,并且该酶活性受Ca2+调节[31]。Schwacke等(1992)用真菌侵染云杉细胞,发现除去培养介质里的钙离子会减少悬浮细胞中的活性氧水平,因此认为Ca2+与ROS的爆发相关[32]。
活性氧在植物过敏性反应中起了重要作用。首先,ROS在被侵染部位大量积累能直接毒害病原菌,降低其存活力。Keppler等(1989)用Pseudomonassyringaepv.syringae细菌侵染烟草悬浮细胞后产生了大量活性氧,明显减少了细菌数量,但在加入SOD活性氧清除剂后细菌数量又增加了,同时延缓了HR[33]。其次,加固细胞壁结构,H2O2可以引发细胞壁木质化,增强细胞壁强度,从而抵抗病原物入侵[34]。第三,活性氧可以诱导植保素(phytoalexin, PA)合成,植保素是在植物受到侵染或外界环境胁迫时产生的一类分子量较低的抗微生物化合物[35]。有研究发现,OH-和H2O2可以诱发大豆素的合成[36],O2-可以诱发马铃薯合成日齐素[37],而外源CAT和SOD等自由基清除剂可以抑制植保素的合成[38]。最后,活性氧能调控基因表达。ROS可以在转录水平上调控防卫相关基因的表达,Desikan等(1998)发现H2O2能够诱导拟南芥悬浮细胞中如谷胱甘肽转移酶(GST)和苯丙氨酸解氨酶(PAL)的表达[39]。
3 胼胝质沉积
胼胝质(callose)的主要成分是β-l,3-葡聚糖,存在于植物花粉管细胞、韧皮部筛板、细胞壁和胞间连丝中,在植物的生长发育中起着重要的作用[40]。当植物受到各种胁迫时,胼胝质可以通过沉积或降解,调节胞间连丝瓶颈的膨大或收缩[41]。而当病原物侵染植物时,胼胝质会在细胞壁沉积,增强细胞壁结构,从而抵御病原物入侵并抑制病原物的传播扩散[42]。Shimomura等(1975)在TMV侵染粘毛烟草(Nicotianaglutinosa)后20 h(形成坏死斑前)的叶表皮细胞壁上观察到了胼胝质沉积,坏死斑出现后依然能观察到大量的胼胝质[43]。Luna等(2010)用Flg22处理水培拟南芥后,在叶片中检测到了胼胝质[44]。Chang等(2014)从寄生疫霉中分离到蛋白质激发子OPEL,其能在烟草上引起过敏性反应,用其处理烟草后能检测到胼胝质沉积[19]。因此,胼胝质沉积也被认为是植物防御反应发生的一个重要标志。
4 防御相关酶
植物与病原物不亲和互作引发过敏性反应,植物体内一些抗病相关的防御酶活性也会发生变化,有研究表明防御相关酶活性的提升可以提高植物的抗病能力。
多酚氧化酶(polyphenol oxidase, PPO)是一种普遍存在于植物、昆虫、真菌中的含铜金属蛋白酶,广泛分布于植物的各个组织中,一般在幼嫩组织中含量较高[45]。PPO由核基因编码,在细胞质中合成,尔后转运到质体中行使其功能[46]。当植物组织遭到病原物侵袭时,质体内的多酚类物质会被PPO氧化生成琨类物质,从而发挥抗病作用。天然状态下的多酚氧化酶与内囊体膜结合而没有活性,只有当植物遇到外界刺激时PPO才会被激活与内囊体膜分离来发挥抗病作用。Bu等(2014)用蛋白质激发子PevD1处理棉花,诱导其系统抗病性,多酚氧化酶的活性在处理24 h后开始上升,在120 h时达到高峰,比对照组的活性高3~4倍[47]。
超氧化物歧化酶(Superoxide Dismutase, SOD)是减轻氧化胁迫机制中的一种重要酶,广泛存在于动植物和微生物体内。植物在正常的生理情况下会不断产生活性氧,但同时也会不断地清除活性氧以维持动态平衡,这有赖于植物体内良好的酶促清除系统,起关键作用的主要有超氧化物歧化酶、过氧化物酶、过氧化氢酶(catalase, CAT)等,其中SOD起主要作用[48]。在过敏性反应中,植物会在瞬间产生大量活性氧而导致细胞死亡,限制病原菌扩散,而同时SOD活性也会升高,从而削弱活性氧和病原菌代谢产物对植物细胞的伤害。Sgherri等(2013)发现葡萄感染了葡萄扇叶病毒后,不仅引发活性氧大量积累,SOD的活性也会上升[49]。
5 病程相关蛋白
病程相关蛋白(pathogensis-related proteins, PRs)是植物受到病原物或外界胁迫时诱导表达的一种蛋白质,在植物的防御反应中起着重要作用[50]。Van Loon等(1970)首次发现了病程相关蛋白,他们在2个烟草品种上接种TMV引起过敏性反应时发现了4种新的蛋白质[51]。随着研究的深入,许多研究者从不同植物中发现了类似的蛋白。Antoniw等(1980)将这些蛋白命名为病程相关蛋白,同时提出了命名方法[52],此后病程相关蛋白的研究得到了极大的发展。迄今为止,已经鉴定了17个家族的病程相关蛋白。
病程相关蛋白与植物的抗病反应息息相关,PRs首先在烟草对TMV的过敏性反应中被发现[51],此后的研究也发现其与植物诱导抗性有关。Czernic等(1996)发现烟草和茄假单胞杆菌(Pseudomonassolanacarum)不亲和互作时,一个过敏性反应相关基因hsr在HR中被激活[53]。Wang等(2015)用从侧短芽孢杆菌(Brevibacilluslaterosporus)分离到的激发子蛋白PeBL1处理烟草,能引起过敏性反应,并提高了烟草的系统抗性,同时检测到了病程相关蛋白的表达[54]。
不同的病程相关蛋白的功能也不尽相同,例如PR-1a、PR-5基因是水杨酸途径的标志基因。烟草的PR-1a蛋白的表达与烟草的系统获得抗性密切相关,Alexander等(1993)把PR-1a基因转到烟草中表达,结果发现PR-1a的高效表达增强了烟草转基因植株对烟草霜霉病和烟草黑胫病的抗性[55]。PR-5蛋白是一种类甜蛋白,具有激活植物防卫信号途径及抵抗真菌侵染等作用[56]。PDF1.2则是茉莉酸/乙烯信号途径的标志基因。NPR1基因是各信号途径的交叉点,在正常情况下处于失活状态,当受到外界刺激时被激活,通过与转录因子TGA互作,参与PR基因和植物抗病性的调控[57]。
6 小结与展望
植物在与病原物的长期博弈过程中,进化出了一套有效的免疫防卫机制。过敏性反应是植物抗病的典型表现,通过将病原物限制在侵染点,从而抑制其扩散。活性氧爆发、胼胝质沉积、防御相关酶、病程相关蛋白的产生是过敏性反应的重要标志,通过检测这些标志可以判断过敏性反应的发生。过敏性反应是无毒基因与抗性基因互作的结果,通过寻找抗性基因,可以深入了解植物抗病的信号转导机制,并且应用于作物的遗传改良,逐步取代化学防治的方法,解决环境污染、农药耐药性等问题。
