MRI上病灶呈双侧对称分布的脑白质病
2018-12-19杨梦歌刘玲玲综述涛审校
杨梦歌, 郑 超, 刘玲玲综述, 金 涛审校
脑白质病是各种原因引起的以脑白质结构改变为主要特征的疾病统称,谱系极广,其病灶在MRI上以多灶性、非对称性多见,如:多发性硬化、视神经脊髓炎等。而病灶呈双侧对称分布的脑白质病在临床上相对少见,且病因复杂,症状无特异性,易被误诊、漏诊。本文从脑白质营养不良、脑小血管病、中毒、感染、代谢紊乱等多角度入手,系统阐述了MRI上病灶呈双侧对称分布的脑白质病的病因、临床表现及影像学特征,以期为临床快速、准确诊治疾病提供参考。
1 脑白质的解剖、功能及血供
脑白质是人类大脑的重要组成结构之一,主要由有髓纤维以及胶质细胞构成,约占整个大脑体积的50%以上。有髓神经纤维由轴突、髓鞘和神经膜构成。髓鞘呈同心环状缠绕在轴突外侧,具有保护和营养神经纤维作用,同时使动作电位“跳跃式”快速传导。研究表明,鞘磷脂也参与认知、学习、技能发展和记忆。因此,脑白质病变临床上不仅会出现神经传导速度减慢引起的运动、感觉、视力障碍,也会出现认知功能下降等神经精神症状[1]。
脑白质的血管来源于垂直于脑表面的穿通动脉,走行较长,且为终末动脉,很少或完全没有侧支循环。特别是距离脑室壁 3~10 mm范围内的白质,恰好处于动脉供血的分水岭区,这些区域的血管侧支循环极少,供血量及供氧量远低于灰质,因此对大脑低灌注非常敏感,易发生缺血改变。
2 病灶呈双侧对称分布的脑白质病的临床特征
2.1 脑白质营养不良 脑白质营养不良是指中枢神经系统髓鞘发育或维持发生障碍的一组异质性遗传性疾病。主要在婴幼儿期发病,但是由于近年来影像学及分子遗传学检测技术的进步,成人型脑白质营养不良的诊断越来越多[2]。该类疾病影像学多表现为双侧对称性脑白质病变,治疗上以对症支持治疗为主,尚无特异性治疗方法。以下主要介绍5种相对常见的成人型脑白质营养不良。
2.1.1 肾上腺脑白质营养不良 肾上腺脑白质营养不良(adrenoleukodystrophy,ALD)是一种最常见的X-连锁隐性遗传性过氧化物酶体脂质代谢病。病理机制:ATP结合蛋白1(ABCD1)基因突变,导致其编码的过氧化物酶体跨膜蛋白ALDP缺乏,从而使饱和极长链脂肪酸在脑白质、肾上腺皮质及其它组织内沉积,引起脑白质炎性脱髓鞘和肾上腺萎缩。病灶通常开始于双侧顶枕区,横穿胼胝体,由后向前及两侧扩展,逐渐累及颞、顶、额叶白质以及视听通路等传导束,病变向下发展也可累及脑干及小脑。MRI上特异性改变为T2加权像及FLAIR呈双侧顶枕叶白质对称分布的蝶翼样的高信号,具有特征性(见图1A)[2,3]。成人ALD最常见的类型是肾上腺脊髓神经病型,14~60岁起病,临床表现为痉挛性截瘫、膀胱和性功能障碍,MRI常见皮质脊髓束、脊髓后索受累。其次是成人脑型ALD,多于21岁以后起病,临床症状主要为精神和行为改变,其次为痉挛性下肢瘫痪,共济失调和痴呆,MRI出现以双侧额叶为主的对称性异常信号(见图1B),病灶周围可呈镶边样强化(见图1C)[2,4]。实验室检查血及游离皮质醇明显降低,促肾上腺皮质激素升高,血清中饱和的极长链脂肪酸升高。ABCD1基因检测可以确诊本病。本病治疗尚无特殊方法,可限制外源性饱和极长链脂肪酸摄人,合并肾上腺皮质功能降低者,需使用激素替代疗法。
2.1.2 常染色体显性遗传成人型脑白质营养不良 常染色体显性遗传成人型脑白质营养不良(adult-onset autosomal dominant leukodystrophy,ADLD)是一种罕见的、慢性进展的、致死的神经系统常染色体显性遗传性脑白质疾病,系编码核纤层蛋白 B1的LMNBl基因重复变异所致。ADLD多于40~60岁起病,主要表现为:(1)自主神经症状:肠道膀胱功能障碍、性勃起障碍和直立性低血压等;(2)锥体束症状:四肢痉挛无力、锥体柬征阳性等;(3)小脑症状:共济失调、眼球震颤和运动性震颤等;(4)其他:痴呆[5]。MRI提示弥漫性、对称性、广泛融合性脑白质病变,通常先累及额顶叶,后扩展至脑干及小脑,也可累及胼胝体和脊髓,脑室旁白质病变通常较轻(见图2)[6]。常染色体显性遗传的家族史和特征性MRI白质病变对本病诊断有重要意义,确诊则需要基因检测。该病为慢性进展性致死性神经系统疾病,预后差,早期给予营养神经和功能锻炼治疗可能会延缓疾病进展。
2.1.3 Krabbe病 Krabbe病,也称为球形细胞脑白质营养不良或半乳糖脑苷脂贮积症,为常染色体隐性遗传病。半乳糖脑苷酯酶(GALC)基因突变导致溶酶体内GALC缺乏,造成鞘氨醇半乳糖苷蓄积,对少突胶质细胞和髓鞘产生毒性。成人患者非常罕见,通常于30岁前发病,临床主要表现为慢性进行性的痉挛性截瘫或行走困难,下运动神经元受累相对较少。有下运动神经元损害者通常传导速度下降,与周围神经系统脱髓鞘一致。成人 Krabbe病最典型的MRI特点是单纯锥体束走行区一致性受累(见图3),约占75%;其次脑白质广泛性病变,主要集中在后部白质,顶枕叶和胼胝体压部常受累;几乎不累及小脑、基底节和丘脑[2,7,8]。半乳糖脑苷脂酶活性的显著下降具有标志性诊断意义,GALC基因突变检测是确诊的重要手段。
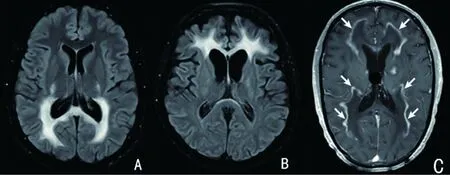
图1 病灶呈对称分布的脑白质病MRI典型特征。A:ALD顶枕叶白质对称性分布的蝶翼样的高信号;B:成人ALD出现以双侧额叶为主的对称性高信号;C:病灶周围可呈镶边样强化
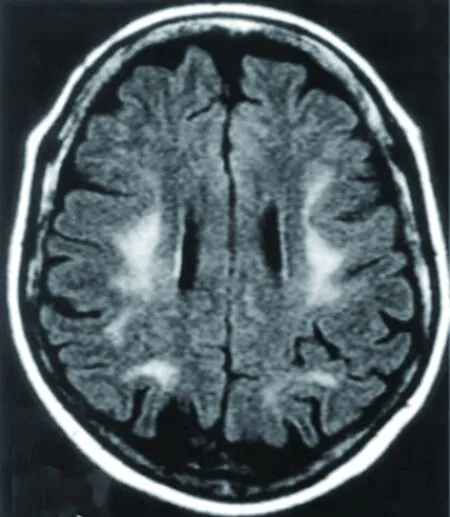
图2 ADLD额顶叶白质FLAIR高信号,脑室旁白质病变较轻
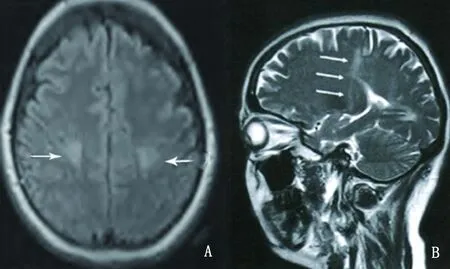
图3 Krabbe病锥体束走行区高信号(A:FLAIR轴位;B:T2矢状位)
2.1.4 异染性脑白质营养不良 异染性脑白质营养不良(metachromatic leukodystrophy,MLD)是一种进行性、神经退行性溶酶体贮积症,系常染色体隐性遗传性疾病。芳基硫酸酯酶A(ARSA)基因缺陷,导致ARSA的生成不足,使溶酶体内硫苷脂的降解受损,进而沉积在中枢神经系统的白质、周围神经系统及其它内脏组织中,引起严重的神经脱髓鞘和神经变性。成人型MLD临床特征是智力下降和精神行为异常,其次为痉挛性共济失调步态和膀胱功能障碍,多发性神经病变发生较晚。MRI表现为双侧额叶白质为主的弥漫性对称性病变(见图4)[2,4],早期“U”型纤维保留,晚期出现皮质萎缩。部分典型病灶可表现为“豹皮样”异常信号,儿童多见[9]。外周血白细胞硫酸酯酶A活性下降和ARSA基因缺陷是诊断该病的重要依据。可选择的治疗非常有限,包括酶替代疗法、造血干细胞移植等[10]。
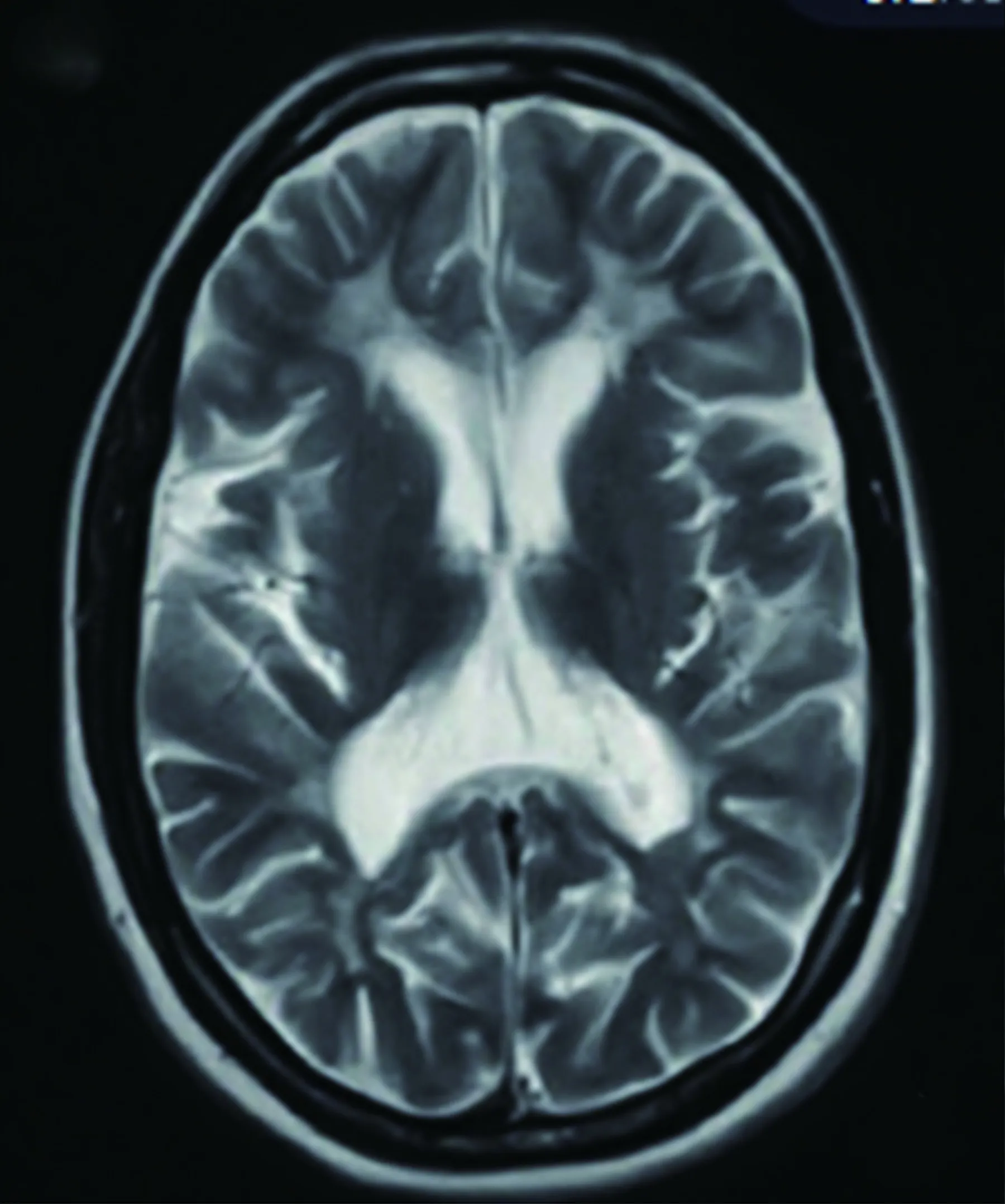
图4 MLD双侧额叶白质对称性病变,T2高信号
2.1.5 亚历山大病 亚历山大病(Alexanderdisease,AxD) 是一种罕见的纤维蛋白样脑白质营养不良脑病,多为常染色体显性遗传。该病由编码星形胶质细胞特有的神经胶质纤维酸性蛋白GFAP基因突变导致。男女均可发病,临床表现为智能减退、癫痫、肌阵挛(尤其是腭肌阵挛)、延髓麻痹、锥体柬征,以及共济失调、眼震等小脑受损症状[11,12]。成人型也可出现睡眠障碍,发作性低体温、直立性低血压、尿便障碍等自主神经功能异常表现,以及上颚呈弓形、额项短、脊柱后凸、头下垂的外貌特点[12~14]。MRI表现为以额叶为主的双侧对称性脑白质异常信号,可累及内囊、脑干、小脑、脊髓白质,可伴延髓、脊髓增粗或萎缩[14,15]。其中,延髓及颈髓萎缩,中脑被盖萎缩,但脑桥基底部保留,呈典型“蝌蚪症”是成人型AxD特征性改变(见图5)[2,4,16]。脑脊液中神经胶质纤维酸性蛋白升高,基因检测可发现GFAP基因突变,确诊需要脑组织穿刺活检发现星形胶质细胞内有罗森塔尔纤维(Rosenyhal fibers,RF)[17]。
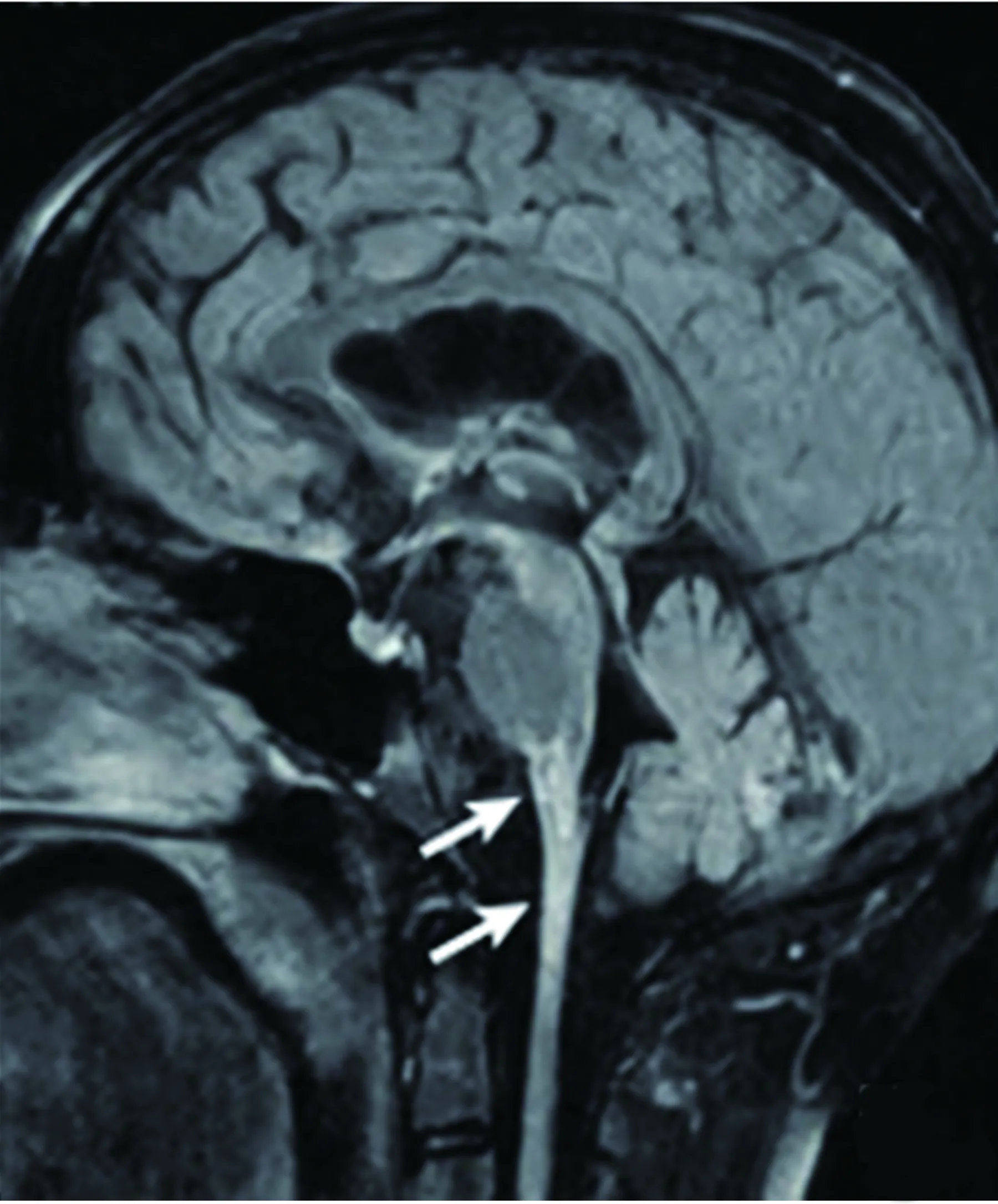
图5 AxD延髓、颈髓萎缩,脑桥基底部保留,呈典型“蝌蚪症”
2.2 脑小血管病
2.2.1 CADASIL和CARASIL 伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(CADASIL)和伴皮质下梗死和白质脑病的常染色体隐性遗传性脑动脉病(CARASIL)属于遗传性脑小血管病,可导致血管性痴呆[18]。CADASIL由NOTCH3基因错义突变引起,常于中年起病,无性别差异,多有家族病史,符合显性遗传特点,且多无高血压、糖尿病、高胆固醇血症等血管病危险因素。其四大核心临床表现:频发脑部小血管梗死或皮质下短暂性脑缺血发作、渐进性认知功能下降或痴呆、先兆性偏头痛和精神障碍。其典型MRI改变是T2WI和FLAIR序列弥漫性脑白质高信号,脑室周围、半卵圆中心、深部白质均可受累,早期为散在的、斑片状、大小不等的病灶,晚期可以融合成片,伴有多发腔隙性脑梗死灶。其中颞叶前端与外囊脑白质异常高信号是最具特征性和最有诊断价值的神经影像异常(见图6)[19]。诊断基于典型的临床和神经影像表现,确诊则依赖皮肤活检发现小血管平滑肌细胞外嗜锇性颗粒状物质沉积或免疫组化NOTCH3Eco染色阳性,以及基因检测发现NOTCH3基因突变。CARASIL由HTRA1基因突变所致,多在青年起病,好发于男性,临床表现和白质变化与CADASIL相似,但认知功能下降较早,早期脱发和腰痛是其特征性表现。MRI表现与CADASIL相似[18]。

图6 CADASAL弥漫性白质病变,伴有腔隙性梗死(B),特征性双侧颞叶前端与外囊受累(A和B)
2.2.2 脑白质疏松与Binswanger病 脑白质疏松(leukoaraiosis,LA)是由多种不同病因引起的一组影像学所描述的临床综合征,即双侧脑室旁及半卵圆中心白质弥漫性、对称性改变,在CT上呈低密度,在MRI T2WI和FLAIR上呈高信号。可见于脑血管病、糖尿病、阿尔茨海默病等众多疾病,在正常人中也占有一定比例[20]。脑白质疏松包含了早期或亚临床期的Binswanger病引起的白质异常改变。
Binswanger病(BD),属于脑小血管病,是在脑动脉硬化基础上,大脑半球白质弥漫性脱髓鞘性脑病。该类患者一般有高龄、高血压、糖尿病、高脂血症等脑血管病危险因素,临床主要表现为缓慢进行性痴呆、反复皮质下缺血性改变、步态紊乱等。MRI典型表现:(1)在侧脑室周围及半卵圆中心白质区呈对称性广泛融合的大片状病灶,边缘模糊,T2加权像呈高信号;(2)腔隙性脑梗死,以双侧基底节内囊区、丘脑及脑室旁多发小灶梗死为主;(3)脑室对称性扩张;(4)脑萎缩。本病的预后关键是早期发现、控制危险因素,预防卒中发作,改善脑血流和供氧,提高脑代谢率,纠正脑白质缺血状态。临床干预越早,预后越好[21]。
2.3 中毒性 中毒性脑白质病(toxic leucoencephalopathy,TLE)是指暴露于各种毒素而引起的脑白质病,以神经髓鞘损害为主要特征。引起中毒性脑白质病的因素有:(1)药物治疗:以抗肿瘤的化疗药物为主,其中以甲氨蝶呤、卡莫司丁和顺铂最为常见,其次为阿糖胞苷、氟尿嘧啶(FU)、异环磷酰胺、卡莫氟、左旋眯唑、氟达拉宾、放线菌素D、环丝氨酸等;免疫制剂,如白细胞介素(IL-2)、α-干扰素、环孢菌素A等;抗结核药异烟肼和抗真菌药两性霉索B等;(2)环境毒素:一氧化碳、有机锡、重金属、二氯乙烷、甲醇、苯、甲苯、二甲苯、苯乙烯、三氯乙烯、四氯三烯、二硫化碳和有机氟等;(3)毒品:常见的有海洛因、可卡因、甲基苯丙胺(摇头丸)等;④颅内放射线照射[22,23]。中毒性脑白质病最典型的临床表现为精神状态的改变,包括注意力不集中、健忘、性格改变、痴呆,重者昏迷和死亡。虽然致病源不同,但中毒性脑白质病具有相似的MRI表现:双侧半卵圆中心、脑室旁对称性长T2信号,边界较清楚[24]。根据患者毒物接触史、神经精神症状、毒物筛查(血、尿等检测酒精、可卡因、碳氧血红蛋白、砷、铅、汞等)及神经影像学的改变可做出诊断,同时需要排除遗传、脱髓鞘、中枢神经系统感染、脑血管意外等所致的脑白质病。治疗无特异性,多采取高压氧疗法,并给予糖皮质激素及对症治疗[25]。临床上迟发性缺氧后脑病、海洛因中毒性脑病、酒精中毒引起的胼胝体变性、二氯乙烷中毒性脑白质病相对常见,且有其特性,以下着重介绍。
2.3.1 迟发性缺氧后脑病 迟发性缺氧后脑病最常见的原因是一氧化碳中毒。急性一氧化碳中毒后迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP) 是指急性一氧化碳中毒后,患者经过“假愈期”(通常2~40 d),又出现一系列神经、精神症状[26]。一氧化碳中毒后迟发性脑病的发生与患者年龄、中毒严重程度、昏迷时间、高压氧治疗是否正规等因素有关。主要临床表现为:(1)智能障碍:痴呆;(2)精神症状:行为怪异,易怒等;(3)锥体外系功能障碍:四肢肌张力增高,震颤;(4)锥体系功能障碍:偏瘫、球麻痹、病理征阳性;(5)少数患者出现失语、癫痫发作[27]。MRI表现为:(1)双侧侧脑室旁及皮质下白质呈对称分布的点状、斑状或融合性病灶,可波及胼胝体、内囊、外囊及“U”形纤维,TIWI呈低信号,T2WI、FLAIR、DWI呈高信号。(2)双侧苍白球对称性T2WI和FLAIR图像上显示高信号,具有特异性(见图7)[27,28]。早期、足疗程的高压氧治疗尤为重要。它可提高血氧含量,增加脑组织的有氧代谢,对改善患者今后的生存质量有很大帮助。此外,有研究表明,添加地塞米松能有效提高高压氧的疗效[29],联合应用丁苯酞和高压氧治疗显著改善患者的认知功能障碍[30]。
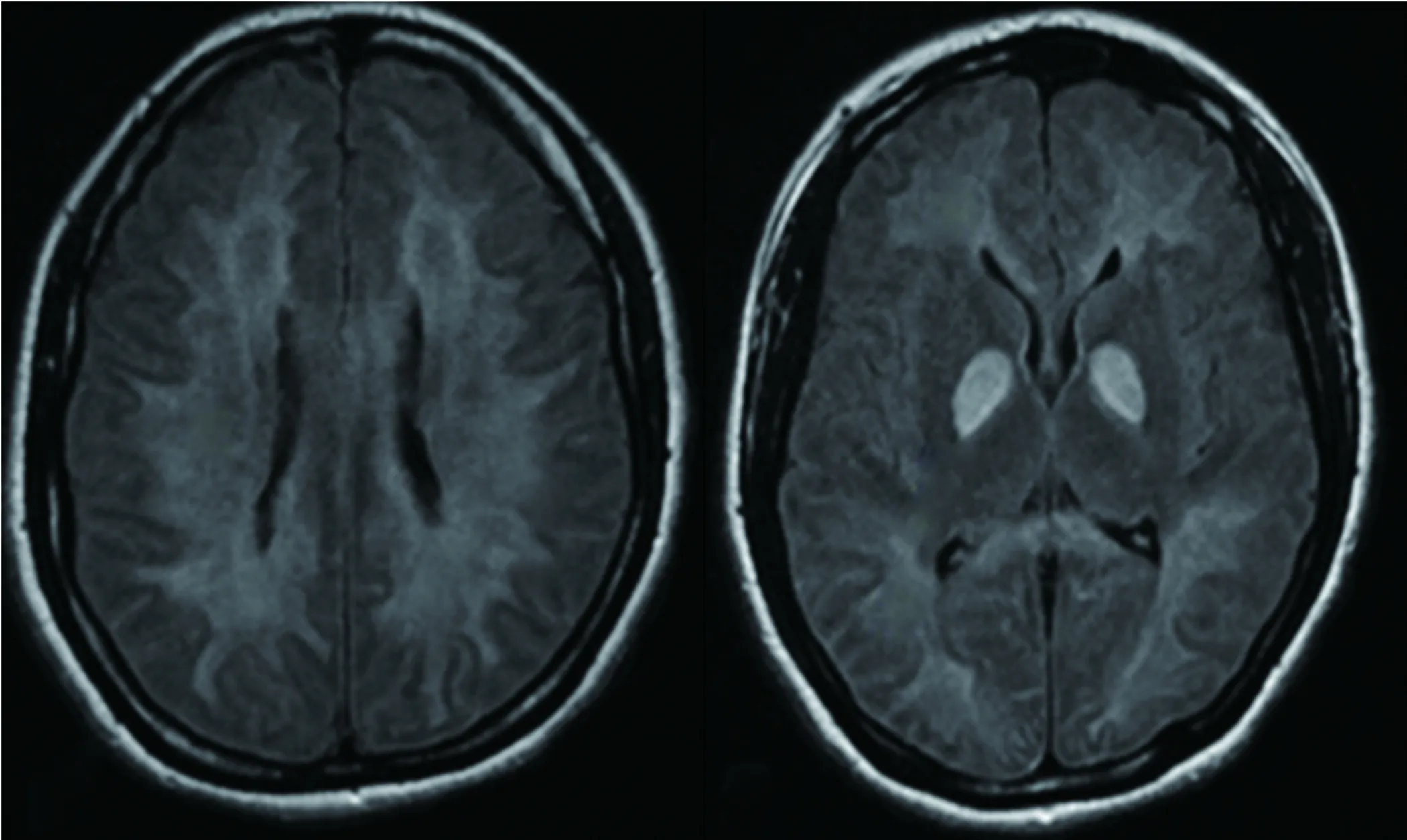
图7 DEACMP双侧脑室旁、皮质下白质及苍白球对称性FLAIR高信号
2.3.2 海洛因中毒性脑病 中毒性白质脑病是海洛因滥用罕见并发症,吸入海洛因蒸汽可引起海绵状白质脑病,静脉注射是否能引起该病有待进一步验证。发病机制尚不明确,可能与加热海洛因时,一些毒物成分被激活,直接经鼻粘膜和嗅神经进入中枢神经系统,导致选择性脑白质海绵状空泡变性有关[31]。临床上最先出现躁动和走路不稳等小脑症状,逐渐发展并出现痉挛、肌张力增高、腱反射亢进,或低张性麻痹、无动性缄默症、反应迟钝,最终可导致死亡。MRI表现为特征性双侧广泛对称性小脑半球白质、内囊后肢、大脑半球白质病变,可累及脑干和胼胝体,T1WI呈等低信号,T2WI、FLAIR呈高信号,其中以小脑半球和基底节的损害为著(见图8)[32,33]。目前无特异性治疗。

图8 海洛因中毒小脑半球和基底节FLAIR高信号
2.3.3 酒精中毒引起胼胝体变性 酒精中毒可引起胼胝体变性(Marchiafava-Bignami disease,MBD)是一种较罕见的胼胝体脱髓鞘病变。根据发病形式不同,本病可分3型:急性、亚急性和慢性。急性者起病突然,表现为严重的神经精神障碍或昏迷;亚急性者表现为进行性痴呆;慢性者表现为双侧大脑半球间失联系—分离综合征及进行性痴呆,是临床的主要类型。MRI有诊断价值,急性期表现为胼胝体局限性或弥漫性T2、FLAIR、DWI高信号,可见强化,多累及体部和膝部,也可累皮质、皮质下白质、半卵圆中心、前联合、后联合、内囊、中脑大脑脚及中脑小脑脚,多成双侧对称性改变[34~36]。在亚急性及慢性期可出现胼胝体中层信号异常,而腹侧、背侧结构完好,呈“三明治”夹层状改,具有特征性(见图9)[37]。近年来有文献报道,部分患者MRI表现出损伤的可逆性[35,38]。早期戒酒、及早应用大剂量B族维生素对改善预后有帮助。对于病情重,MRI显示胼胝体肿胀较重或伴皮质、皮质下白质受累的患者,可尝试糖皮质激素治疗。
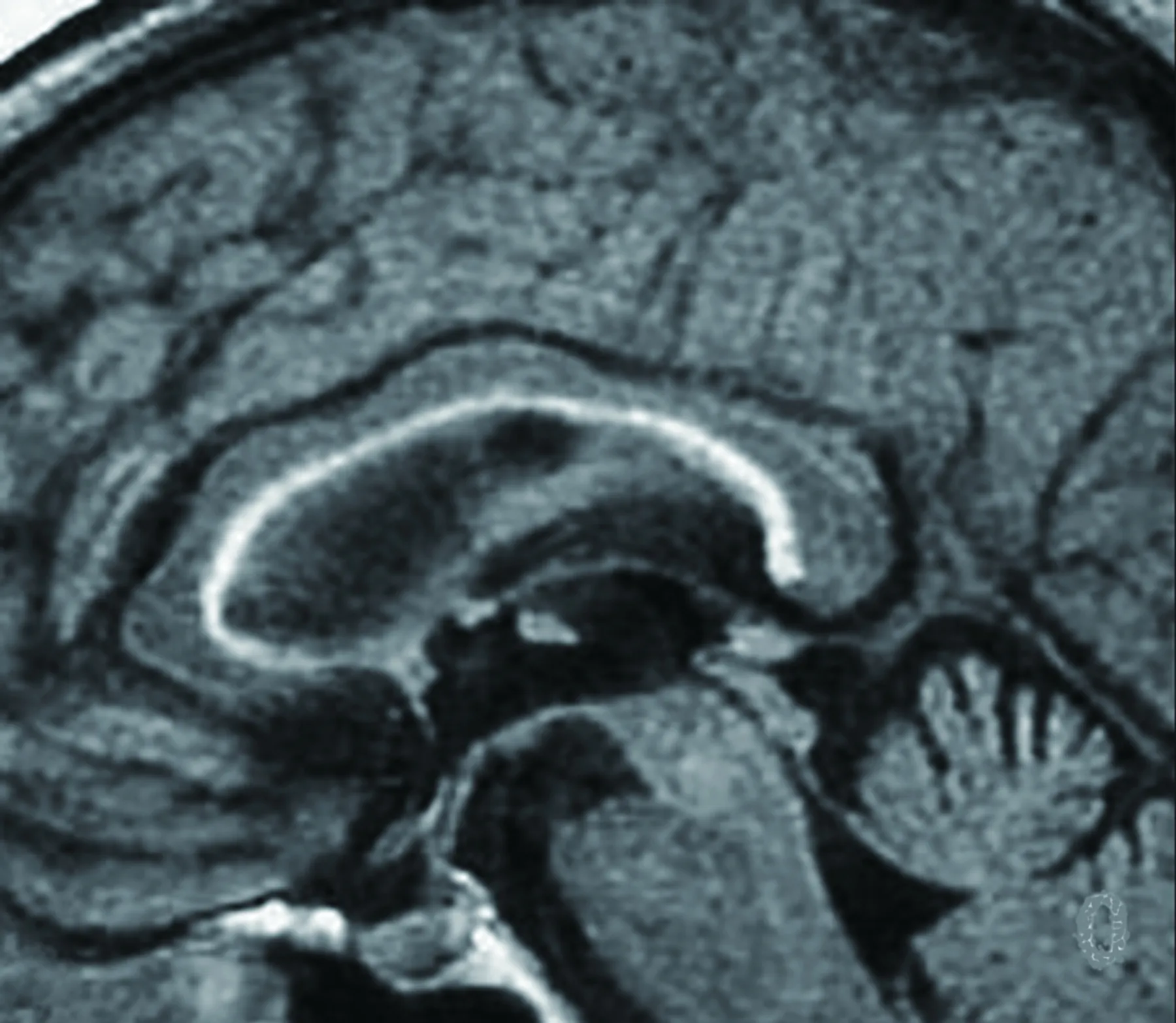
图9 MBD胼胝体中层FLAIR高信号,而腹侧、背侧结构完好,呈“三明治”夹层状改
2.3.4 二氯乙烷中毒性脑白质病 二氯乙烷是一种在工业上广泛应用的有机溶剂和粘合剂,神经毒性高,主要由呼吸道吸入而引发中毒。二氯乙烷中毒性脑白质病,以冬春季高发,主要表现为头痛、恶心、呕吐等颅高压症状,严重者可致脑疝、意识障碍,也可有癫痫发作[39]。影像学特征以脑水肿为主,MRI检查双侧大脑半球白质弥漫性、对称性病变,T2WI和FLAIR高信号,脑回肿胀,脑沟模糊不清,脑沟、脑池变浅,脑室变小。治疗上主要给予脱水降颅压、糖皮质激素及对症支持治疗[39,40]。
2.4 感染 感染引起双侧对称性脑白质病极为少见。艾滋病是由人类免疫缺陷病毒(HIV)所引起的一种获得性免疫缺陷病。HIV 脑病是艾滋病神经系统受累最常见的表现形式,由 HIV 病毒直接侵袭脑组织引起。临床上表现为进行性痴呆,在疾病后期痴呆程度较重又称艾滋病痴呆综合征,日常生活能力严重受损。脑脊液正常或淋巴细胞、蛋白轻度升高,脑电图提示弥漫性慢波。MRI提示:弥漫性脑萎缩,脑室扩大,双侧对称性脑白质T2WI高信号,常位于脑室旁、半卵圆中心、基底节、小脑和脑干。因HIV脑病神经系统损害较重,无特异性药物,预后极差[41,42]。
2.5 代谢紊乱 许多代谢紊乱性疾病也可引起脑白质对称性损害,如甲状腺功能亢进、尿毒症、苯丙酮尿症及戊二酸尿症等。甲状腺毒性脑病是一种与血液循环中甲状腺激素过多相关的脑病,不规则服用抗甲状腺药物或停药为其最常见诱因,可于甲状腺危象并存[43]。尿毒症脑病常伴随着肌酐的明显升高,引起可逆性后部脑白质病变多见,也可累及皮质和基底节[44]。苯丙酮尿症由苯丙氨酸羟化酶引起的,是一种常染色体隐性遗传性氨基酸代谢紊乱病。患者常表现出精神发育迟缓和运动功能下降。MRI上主要表现为脑室周围和枕部白质T2高信号,严重病例可延伸至额叶和皮质下白质[45]。戊二酸尿症为遗传性有机酸代谢紊乱病,可引起双侧苍白球对称性病变及白质弥漫性病变[46]。总的来讲,代谢紊乱引起的对称性脑白质病变无特异性临床表现和影像学特征,诊断依赖于患者的病史、实验室检查。治疗上,非遗传性代谢病以诊治原发病为主,遗传代谢病以对症治疗为主。
2.6 其它
2.6.1 可逆性后部白质脑病综合征 可逆性后部白质脑病综合征(posterior reversible encephalopathy syndrome,PRES)是一组多病因、多症状的可逆性皮质下血管源性脑水肿疾病。常见病因为高血压,其他为先兆子痫/子痫、肾功能衰竭、应用免疫抑制剂和细胞毒性药物,合并自身免疫疾病等。目前发病机制尚不明确,大多数学者支持高灌注学说:快速进展的体循环血压升高超过脑血流自动调节能力上限,导致脑的高灌注,血-脑屏障破坏,液体、大分子外渗引起血管源性水肿。其中内皮细胞损伤起关键作用。多为急性或亚急性起病,主要临床表现为头痛、癫痫发作、视觉障碍、意识障碍、精神异常等。MRI示双侧大脑后部白质(顶枕叶)为主的特征性血管源性水肿改变,大致对称分布,T1WI为等信号或低信号,T2WI为高信号,FLAIR像显示明显高信号,DWI为低信号或等信号,ADC像显示明显高信号,与脑梗死影像学相反。病灶也可累及额颞叶、基底节、脑干、小脑等部位,皮质也可受累[47]。临床病史、药物应用史及影像学特征对诊断意义重大。治疗上应尽早去除病因、控制血压、停用或减量可疑药物、控制癫痫发作、减少靶器官损害等。正确、及时、规范的治疗,可使绝大多数患者的症状、体征、头颅神经影像学病变消失,但治疗不及时,也可造成脑组织不可逆性损伤。
2.6.2 神经精神狼疮 神经精神狼疮(Neuropsychiatric systemic lupus erythematosus,NPSLE)是系统性红斑狼疮严重的并发症,多发生于疾病活动期,女性多见,临床表现为癫痫发作、精神障碍、认知功能障碍等[48]。神经精神狼疮脑的白质损害多为非对称性的、多灶的、小的病灶,位于皮质下白质或脑室周围白质,对称性白质损害相对少见。尽管如此,神经精神狼疮引起的对称性白质损害已经被多次报道。MRI可表现为放射冠、内囊、半卵圆中心、脑室周围等对称性长T1,长T2信号,FLAIR及DWI呈显著高信号[49,50]。神经精神狼疮给予大剂量激素及环磷酰胺冲击治疗可获得良好的治疗效果。
2.6.3 X-连锁腓骨肌萎缩症1型 X-连锁腓骨肌萎缩症1型(X-linked Charcot-Marie-Tooth disease,type 1,CMTX1)是一种周围神经遗传病,由位于X染色体的编码缝隙连接蛋白32的GJB1基因突变导致。其典型临床表现为进行性、对称性下肢远端肌无力和萎缩,伴随远端感觉减退及腱反射减弱,少数患者出现一过性中枢神经系统症状和可逆的脑白质损害,可完全缓解。MRI表现为可逆性的双侧胼胝体、放射冠区、内囊后肢的多发对称性长T1长T2信号,FLAIR高信号,弥散受限,无强化(见图10)[51,52]。肌电图检查对疾病诊断及鉴别诊断有重要意义,确诊有赖于基因检测。
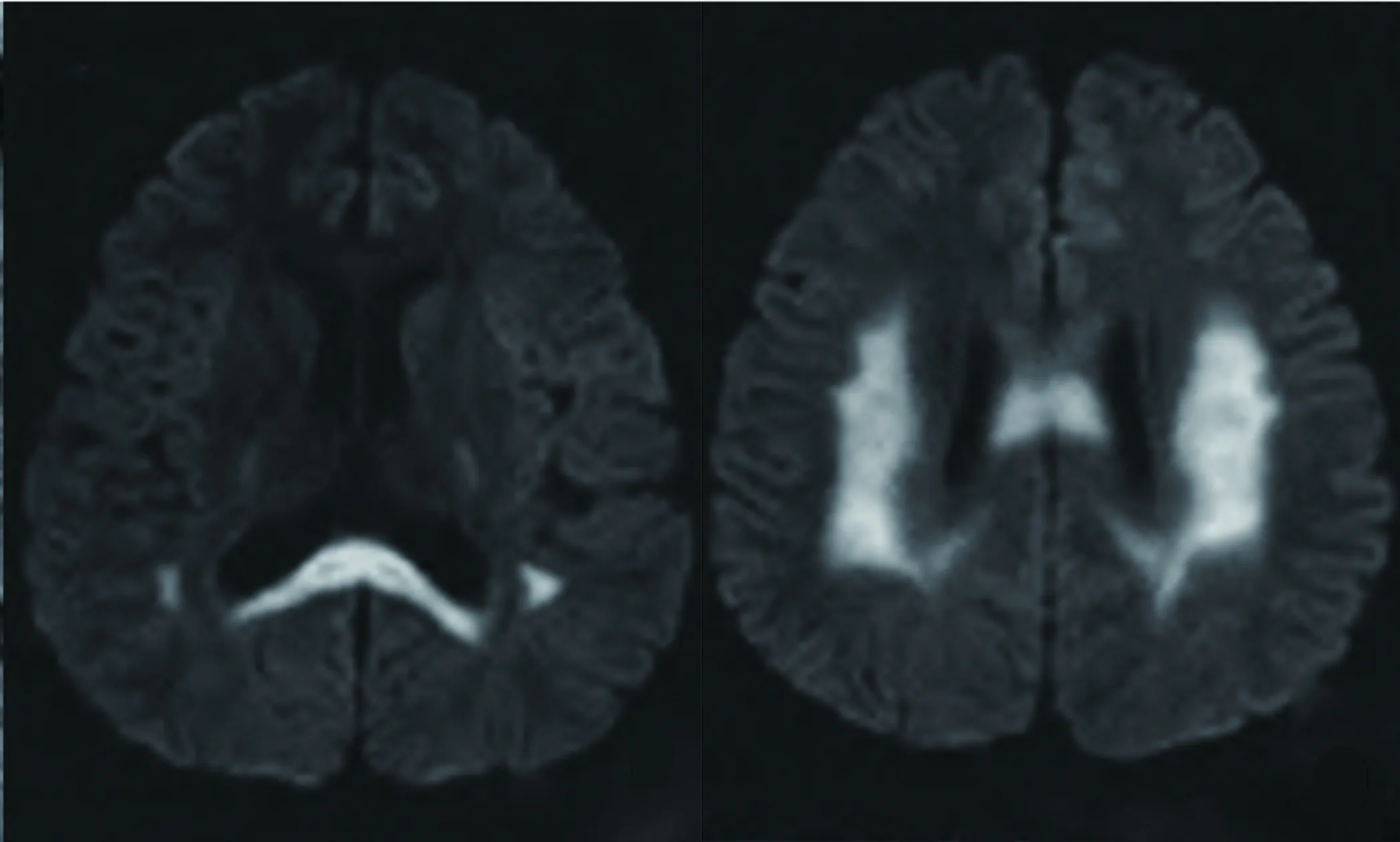
图10 CMTX1双侧胼胝体、放射冠区、内囊后肢的多发对称性DWI高信号
3 鉴别诊断
病灶呈对称性分布的脑白质病,MRI上有时并非绝对对称,可表现为非对称性、斑片状病灶,需与以下疾病鉴别:(1)脱髓鞘性:多发性硬化、视神经脊髓炎、进行性多造性白质脑病、急性播散性脑脊髓炎等;(2)感染性:脑结核瘤病;(3)血管性:脑淀粉样血管病变、Susac综合征、中枢神经系统血管炎、基底动脉尖综合症;(4)肿瘤性:大脑胶质瘤病。
MRI因敏感性及分辨率高,能准确反映病灶的部位、大小、性质,已成为诊断白质脑病的首要检查,T2WI、FLAIR序列最为敏感。MRI上病灶呈对称性分布的脑白质病的病因、临床症状及MRI表现各不相同(见表1)。当患者MRI上病灶呈对称性分布时,临床医生应根据病灶出现的部位、性质,从脑白质营养不良、脑小血管病、中毒、感染、代谢紊乱等多方面综合考虑。详细了解患者家族史、既往史、药物应用史、生活习惯、职业特点,进行系统的神经科查体,尤为重要,可发现疾病线索。在此基础上,尽早完善腰穿、毒物筛查、有机酸代谢等实验室检查,经济条件允许可行基因检测,必要时活检取病理。
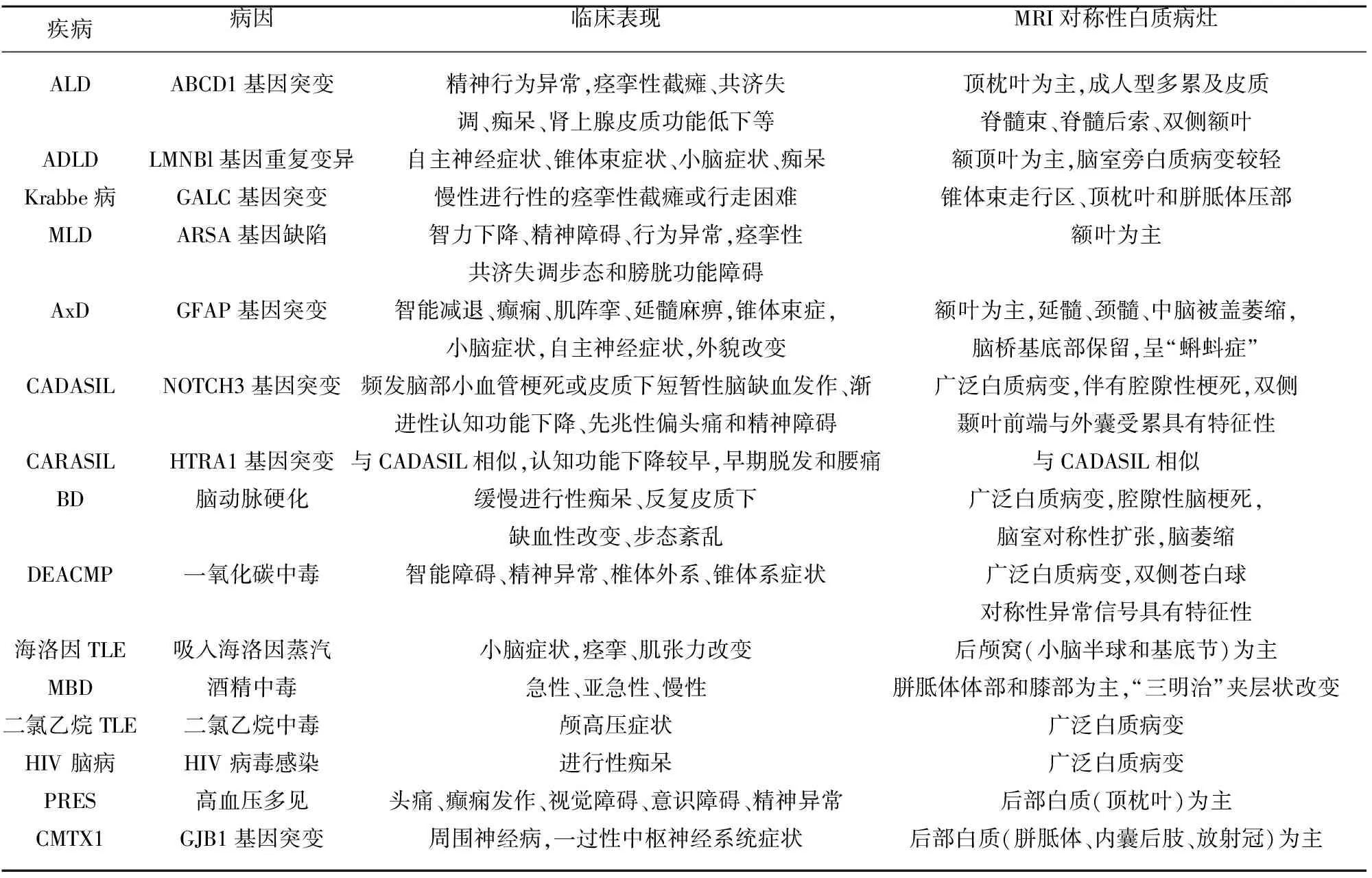
表1 MRI上病灶呈对称分布的脑白质病临床特征
注:ALD:肾上腺脑白质营养不良;ADLD:常染色体显性遗传性脑白质营养不良;MLD:异染性脑白质营养不良;AxD:亚历山大病:CADASIL:伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病;CARASIL:伴皮质下梗死和白质脑病的常染色体隐性遗传性脑动脉病;BD:Binswanger病;DEACMP:一氧化碳中毒后迟发性脑病;TLE:中毒性脑白质病;MBD:胼胝体变性;PRES:可逆性后部白质脑病综合症;CMTX1:X-连锁腓骨肌萎缩症1型。
