脂蛋白相关磷脂酶A2、颈动脉斑块内新生血管与颈动脉粥样硬化及缺血性脑卒中的相关性研究
2018-12-19魏敬美
田 晔, 贾 欢, 田 晖, 魏敬美, 于 萍, 郭 力, 李 彬
脑卒中尤其是缺血性脑卒中以其高发病率、高复发率、高死亡率及高致残率成为全世界密切关注的卫生问题。在缺血性脑卒中诸多可能病因中,临床最常见的即为大动脉粥样硬化(Atherosclerosis,AS),而颈动脉不稳定斑块的脱落及破裂又是缺血性脑卒中发生的独立危险因素[1,2]。研究表明,动脉粥样硬化斑块的形成及不稳性与内皮损伤、氧化应激、炎细胞的浸润及新生血管生成等因素密切相关[3]。动脉粥样硬化斑块内的新生血管发育不成熟,通透性增高,加重脂质、炎性细胞等物质沉积,新生血管破裂还易引起斑块内出血,加重斑块的易损性。同时斑块内增多的炎性物质可刺激巨噬细胞等产生基质蛋白酶等更多的炎性因子,进一步加重斑块易损性和新生血管生成[4]。
近些年来超声造影(Contrast-enhanced Ultrasonography,CEUS)技术发展突飞猛进,在检测动脉粥样硬化斑块新生血管方面发挥着越来越大的作用。CEUS 技术具有较高的时间分辨率及空间分辨率,且造影剂微气泡具有类似红细胞的血流动力学特征,可作为血管内示踪剂,CEUS 对活体颈动脉斑块内新生血管的检测具有很高的敏感性,而且具有半定量、定量评价的功能[5]。
研究显示,炎性因子不仅在动脉粥样硬化发生、发展及破裂的过程具有重要的作用,同时也可以刺激斑块内新生血管的生成,加重斑块的不稳定性,与急性脑血管事件发生密切相关[6]。近些年来,脂蛋白相关磷脂酶A2(Lipoprotein Associated Phospholipase A2,Lp-PLA2)在动脉粥样硬化及其相关心脑血管疾病中引起广泛关注。Lp-PLA2是一种非Ca2+依赖性的丝氨酸酯酶,属于磷脂酶A2超家族中的成员。70%~80%的Lp-PLA2在血浆中通过载脂蛋白B(Apolipoprotein B,ApoB)与低密度脂蛋白(Low Density Lipoprotein Cholesterol,LDL)结合。Lp-PLA2在水解氧化型低密度脂蛋白(Oxidized Low Density Lipoprotein,ox-LDL)的过程中可以生成氧化型游离脂肪酸(Oxidized Free Fatty Acids,ox-FFA)和溶血卵磷脂(Lyso-phosphatidylcholine,lyso-PC)两种较强的致炎物质,促进动脉粥样硬化斑块的形成,加重斑块的不稳性[7]。
目前,国内外对于Lp-PLA2水平、颈动脉斑块内新生血管与颈动脉粥样硬化,尤其是与缺血性脑卒中的相关性仍存在一定争议。本研究旨在探讨Lp-PLA2水平与颈动脉粥样硬化和缺血性脑卒中的相关性,并通过CEUS的方法研究颈动脉斑块内新生血管等级与缺血性脑卒中及Lp-PLA2的关系。
1 资料和方法
1.1 一般资料 收集2016年12月~2017年12月于河北医科大学第二医院神经内科住院治疗经颈动脉超声检测双侧颈动脉至少一处内膜中层厚度(IMT) >1.5 mm且为低回声或不均质回声斑的患者60例为病例组,其中男性34例,女性26例,平均年龄(60.27±8.11)岁,高血压患者33例,糖尿病患者22例,吸烟者22例,饮酒者10例。收集同期在河北医科大学第二医院体检中心体检经颈动脉超声检测未发现动脉粥样硬化斑块的健康体检者60例为对照组,其中男性32例,女性28例,平均年龄(58.33±7.60)岁,高血压患者19例,糖尿病患者2例,吸烟者14例,饮酒者9例。排除标准:(1)除急性前循环脑梗死且同侧颈动脉存在低回声或不均质回声斑块外的其他类型脑梗死;脑出血、脑血管畸形等颅脑疾病。(2)各种严重先天性心脏病、各种严重冠心病、各种严重心律失常;严重的肺部疾病(慢性阻塞性肺疾病、弥漫性肺间质疾病,重症肺炎),各种原因引起的呼吸衰竭;(3)合并有严重肝肾功能损害者(肝酶和肌酐超出正常值3倍以上者);(4)合并各种急慢性感染性疾病患者;(5)原发性血脂蛋白异常及继发性脂蛋白代谢异常(未控制的糖尿病、甲状腺功能减退症、肾病综合征、肝内外胆管阻塞及其他肝病、胰腺炎、异常球蛋白血症、乙醇中毒;(6)意识障碍、卒中所致感觉性失语或严重肢体瘫痪而不能完成检查、其他对诊查不依从者;(7)妊娠期、哺乳期及准备妊娠的妇女;(8)有造影剂过敏者及严重的过敏体质者;(9)患者近期酗酒或药物滥用史;(10)正在参加其他临床试验的患者或3 m内参加过临床试验者;(11)合并多系统严重疾病、多器官功能不全及自身免疫性疾病者等;(12)无法静脉给药的患者;(13)拒绝签署知情同意书者;(14)精神类疾病患者及正在或曾经服用抗精神病药物者;(15)各种外伤患者。所有入选患者及健康体检者均由其本人或监护者签署知情同意书,并提供血样,过程符合医学伦理及人道主义要求。
1.2 方法
1.2.1 血液指标测定 住院患者于入院次日晨抽取空腹静脉血标本,健康对照者于体检当日抽取空腹静脉血标本,所得标本一部分进行血常规、生化全项及凝血常规检查,另一部分放入促凝管内,充分混合均匀,于标本采集30 min内在2~8 ℃环境下以3000 r/min离心15 min,留取血清,-80 ℃ 保存备用。血清Lp-PLA2采用南京诺尔曼生物技术有限公司的NORMAN 系列散射比浊分析仪及Lp-PLA2测定试剂盒进行检测,严格按照说明说进行操作。
1.2.2 颈动脉超声造影检查 对所有病例组患者进行颈动脉超声造影检查,采用型号为GE Logiq E9型的彩色多普勒超声诊断仪,探头采用ML6-15型探头,探头频率为6~15 MHz,造影时机械指数调节为0.05~0.08,焦点设置为2~3 cm,增益设定为95%。采用意大利 Bracco公司的第二代超声造影剂声诺维(SonoVue),主要活性成分为六氟化硫(sF6)。首先应用常规二维超声纵向横向分别检查双侧颈动脉的斑块位置、大小、形态及其回声特点,非脑梗死患者选取斑块厚度>1.5 mm的体积最大的斑块为研究对象,急性前循环脑梗死者选取病灶对应侧最大斑块为研究对象,双侧梗死者选取斑块大者,记录斑块位置、大小、形态及回声特点。切换到超声造影模式前选取好最合适位置,应用团注法将造影剂混悬液经留置针进行快速注射,注射0.9 ml后立即推注0.9%氯化钠溶液5 ml,同时启动计时器并进行图像视频采集,保持探头固定,记录观察1.5 min左右。依据国内外相关文献对斑块的稳定程度设定分级标准[8]。分为4个等级:斑块内无增强的新生血管信号为Ⅰ级;斑块内部或周边数个点状增强的新生血管信号为Ⅱ级;斑块周边和内部散在点状及线样增强的新生血管信号为Ⅲ级;斑块内部和周边弥漫点状及线样增强的新生血管信号为Ⅳ级(见图1)。
1.2.3 头部核磁共振检查(Magnetic Resonance Imaging,MRI) 对病例组患者行头部核磁共振检查,设备采用型号为GESigna3.0T超导型的核磁共振扫描仪,所得到的影像学图像经至少2名影像科专业神经组诊断医师阅片,当出现意见不同情况时,医师间协商讨论后得出一致结论。根据头部核磁检查结果,将病例组患者分为脑梗死组和非脑梗死组。
2 结 果
2.1 病例组与对照组比较
2.1.1 基础临床资料比较 本研究共纳入符合入组标准的颈动脉粥样硬化患者60例,体检中心健康体检者60例,两组在性别、年龄、吸烟、饮酒方面差异无统计学意义(P>0.05),在高血压、糖尿病方面差异有统计学意义(P<0.05)(见表1)。
2.1.2 血液学指标比较 病例组的Lp-PLA2,LDL明显高于对照组,高密度脂蛋白(High Density Lipoprotein Cholesterol,HDL)低于对照组,三项指标差异均有统计学意义(P<0.05),两组Lp-PLA2,LDL,HDL水平分别为(257.23±131.99)ng/ml、(171.55±80.91)ng/ml;(3.13±0.73)mmol/L、(2.85±0.71)mmol/L和(1.09±0.24)mmol/L、(1.37±0.28)mmol/L(见表2)。
2.2 脑梗死组与非脑梗死组比较
2.2.1 颈动脉斑块内新生血管等级比较 将病例组60例患者根据头颅核磁共振检查是否存在梗死灶分为脑梗死组和非脑梗死组,其中脑梗死组40例,非脑梗死组20例,均行颈动脉超声造影检查,并对两组颈动脉斑块内新生血管等级进行比较。其中脑梗死组Ⅰ级1例(2.5%)、Ⅱ级10例(25.0%)、Ⅲ级18例(45.0%)、Ⅳ级11例(27.5%),中位等级为Ⅲ级;非脑梗死组Ⅰ级4例(20.0%)、Ⅱ级9例(45.0%)、Ⅲ级3例(15.0%)、Ⅳ级4例(20.0%),中位等级为Ⅱ级。两组颈动脉斑块内新生血管等级差异有统计学意义(P<0.05)(见表3)。
2.2.2 血液学指标比较 脑梗死组与非脑梗死组Lp-PLA2,LDL,HDL水平分别为(266.40±123.52)ng/ml、(238.90±149.18)ng/ml;(3.21±0.75)mmol/L、(2.98±0.66)mmol/L和(1.09±0.21)mmol/L、(1.10±0.29)mmol/L。统计结果显示,两组在Lp-PLA2,LDL,HDL水平方面差异无统计学意义(P>0.05)(见表4)。
2.3 不同颈动脉斑块内新生血管等级的Lp-PLA2比较 病例组60例患者根据颈动脉超声造影斑块内新生血管等级分为4组,其中Ⅰ级5例、Ⅱ级19例、Ⅲ级21例、Ⅳ级15例。各等级Lp-PLA2水平分别为(186.80±108.27)ng/ml、(255.68±112.67)ng/ml、(271.66±119.87)ng/ml、(262.46±176.38)ng/ml。统计结果显示,Lp-PLA2与颈动脉斑块内新生血管等级比较差异无统计学意义(P>0.05)(见表5)。
2.4 Lp-PLA2与颈动脉粥样硬化斑块形成的相关性 对病例组及对照组患者以是否存在颈动脉粥样硬化斑块为自变量,以血清Lp-PLA2水平为因变量进行单因素分析,结果示Lp-PLA2水平与颈动脉粥样硬化斑块形成相关 (OR=1.007,95%CI1.004~1.011),将高血压、糖尿病、脑梗死加入进行调整,通过多因素分析显示Lp-PLA2水平与颈动脉粥样硬化斑块形成仍具有相关性(OR=1.005,95%CI1.000~1.010),将高血压、糖尿病、脑梗死、低密度脂蛋白、高密度脂蛋白加入进行调整,多因素分析结果显示,Lp-PLA2水平不再是颈动脉斑块形成的独立危险因素 (OR=1.004,95%CI0.999~1.010) (见表6)。
2.5 颈动脉斑块内新生血管等级与脑梗死的相关性 对病例组的患者以是否发生脑梗死为自变量,以颈动脉斑块内新生血管等级为因变量,采用Logistic回归分析,结果显示,新生血管Ⅲ级与颈动脉粥样硬化患者发生脑梗死密切相关(OR=24,95%CI1.952~295.061),其他3个等级未发现明显相关性(见表7)。

表1 病例组与对照组基础临床资料的比较[n(%)]
P<0.05 表示两组间差异有统计学意义
表2 病例组与对照组血液学指标的比较
P<0.05 表示两组间差异有统计学意义

表3 脑梗死组与非脑梗死组颈动脉斑块内新生血管等级比较[n(%)]
P<0.05表示两组间差异有统计学意义

表4 脑梗死组与非脑梗死组血液学指标比较[n(%)]
P>0.05表示两组间差异无统计学意义

表5 不同颈动脉斑块内新生血管等级的Lp-PLA2比较
P>0.05表示两组间差异无统计学意义
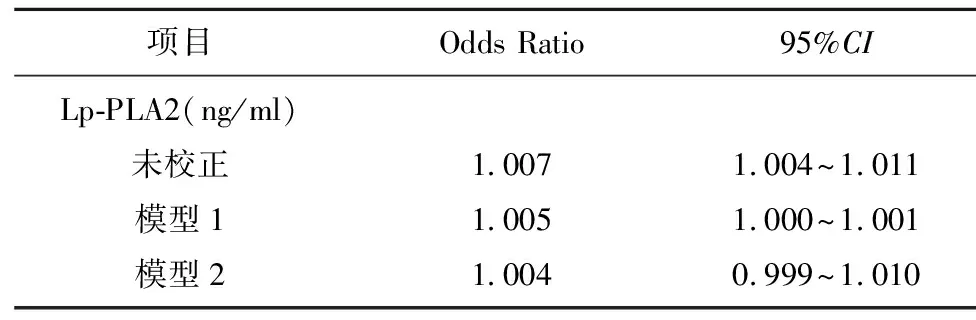
表6 Lp-PLA2与颈动脉粥样硬化的相关性
模型1:调整高血压、糖尿病、脑梗死;模型2:调整高血压、糖尿病、脑梗死、低密度脂蛋白、高密度脂蛋白
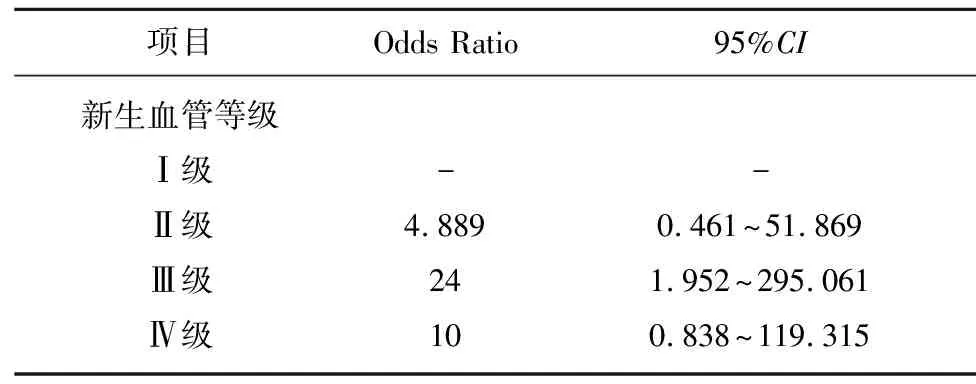
表7 颈动脉斑块内新生血管等级与脑梗死的相关性
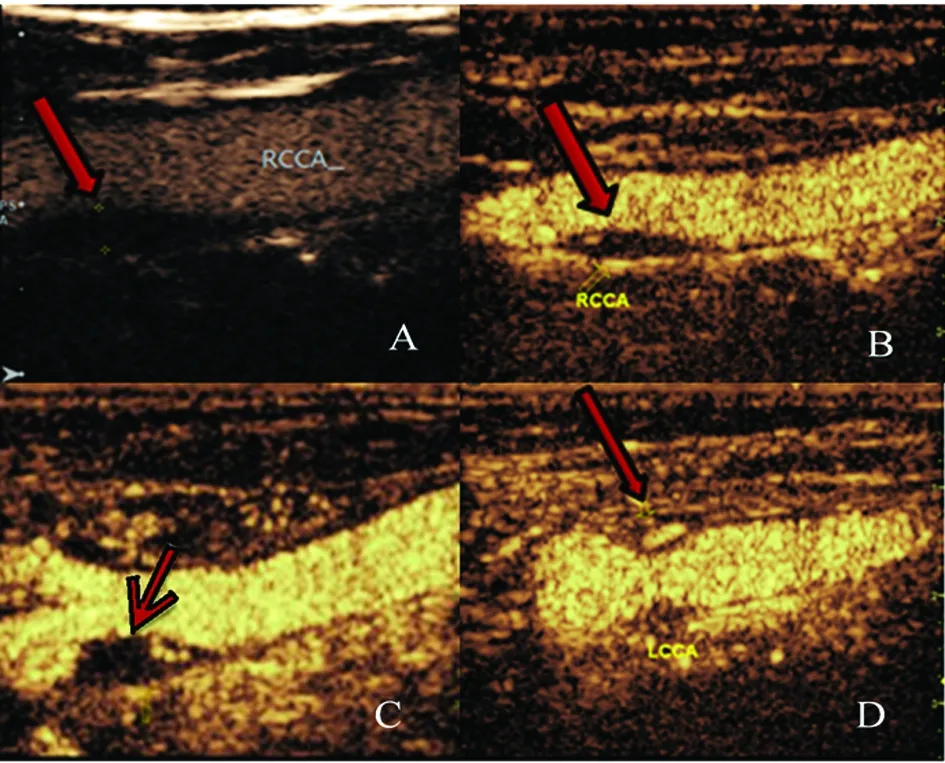
图1 颈动脉斑块内新生血管等级:A 新生血管I级;B 新生血管Ⅱ级;C 新生血管III级;D 新生血管ⅳ级
3 讨 论
动脉粥样硬化是缺血性脑血管病、冠状动脉粥样硬化性心脏病等威胁人类健康常见的缺血性心脑血管疾病的最主要病理基础。大量研究证明,动脉粥样硬化是一种血管壁的慢性炎性反应疾病,其发生和发展与炎细胞的浸润及炎性因子的参与密切相关[9]。Lp-PLA2属于磷脂酶A2超家族中的一员,又被称为血小板活化因子乙酰水解酶(Platelet Activating Factor-acetylhydrolase,PAF-AH),它是一种非Ca2+依赖性的丝氨酸酯酶,由441个氨基酸组成,相对分子质量为45KD[10]。血浆中绝大多数的Lp-PLA2通过载脂蛋白B与低密度脂蛋白结合,少量通过其他载脂蛋白与高密度脂蛋白、极低密度脂蛋白、脂蛋白a等结合[11]。Lp-PLA2水解ox-LDL可生成ox-FFA和lyso-PC,这两种较强的致炎物质通过氧化应激反应损伤内皮细胞,诱导黏附因子表达,促进巨噬细胞吞噬ox-LDL成为泡沫细胞,同时刺激血管平滑肌细胞增殖,促进动脉粥样硬化斑块形成,还能引起多种炎性因子释放,刺激斑块内产生更多的Lp-PLA2,使斑块不稳定性明显增加[12]。Mannheim等[13]研究发现,对症状性颈动脉狭窄患者行颈动脉内膜剥脱术,病理检查显示斑块内Lp-PLA2及lyso-PC水平均增高,并且呈一定的正相关性。Yang等[14]对前循环脑梗死患者的颈动脉斑块进行多普勒超声评估发现,混合斑块组和稳定斑块组Lp-PLA水平显著低于不稳定斑块组,多因素分析显示Lp-PLA2水平是颈动脉斑块形成及其易损性的独立危险因素之一。
本研究通过对60例颈动脉存在不稳定斑块的动脉粥样硬化患者和60例无颈动脉斑块的健康对照者进行比较发现,两组之间在高血压、糖尿病方面存在统计学差异,两组血液中Lp-PLA2、LDL、HDL水平均有显著的统计学差异(P<0.05)。Logistic回归分析显示,Lp-PLA2是颈动脉粥样硬化的危险因素(OR=1.007,95%CI1.004~1.011),校正高血压、糖尿病后并未改变Lp-PLA2与颈动脉粥样硬化的相关性(OR=1.005,95%CI1.000~1.010),进一步校正LDL与HDL后Lp-PLA2与颈动脉粥样硬化的相关性降低(OR=1.004,95%CI0.999~1.010),不再是其独立的危险因素。此结果也表明,Lp-PLA2在促进动脉粥样硬化形成的过程中与LDL、HDL等脂类存在一定的相关性。
目前研究多认为动脉粥样硬化是缺血性脑卒中的主要病理基础,而炎性因子在动脉粥样硬化斑块形成、发展、破裂中起着不可忽视的作用[15],越来越多的研究关注到动脉粥样硬化相关炎性因子与缺血性脑血管事件之间的关系,Lp-PLA2被认为是心血管事件的独立危险因素,并得到了广泛的证实,但Lp-PLA2与缺血性脑血管病的相关性仍存在一定的争议[16]。本研究中,60例颈动脉粥样硬化患者根据头部核磁共振是否存在脑梗死病灶分为脑梗死组和非脑梗死组,统计发现,两组间在Lp-PLA2水平方面并无统计学差异(P>0.05)。本研究并未发现Lp-PLA2与脑梗死之间的相关性,可能与样本量小有关,同时本研究中脑梗死组与非脑梗死组患者均为颈动脉存在不稳定斑块者,且为横断面研究,而Lp-PLA2又与动脉粥样硬化斑块的不稳定性密切相关,故两组之间的差异性会因此而削弱,非脑梗死组患者随着时间推移可能会发生缺血性心脑血管事件。另外,Lp-PLA2有两种常用的检测方法,一种是含量检测,一种是活动度检测,研究发现含量检测易受LDL、HDL等脂类物质影响,而活动度检测可能相对更稳定,但两者在预测疾病方面并不能完全相互替代[17]。本研究仅应用了含量一种检测方法,结果尚缺少全面性。但是,曼哈顿研究在2014年公布的结果显示,对1946例受试者平均随访11 y,最终151例发生缺血性脑卒中,校正相关危险因素后Lp-PLA2含量和活动度水平与缺血性脑卒中无显著相关性[18]。Tai等[19]研究也发现Lp-PLA2含量和活动度水平与急性缺血性脑血管事件无明显的相关性。因此,有关Lp-PLA2水平与缺血性脑卒中的相关性及其预测价值仍需要更多高水平的研究进一步探究。
动脉粥样硬化斑块的易损性与脂质核心增大、纤维帽变薄、炎性细胞浸润以及斑块内新生血管形成关系密切[3,20]。斑块内新生血管是动脉粥样斑块不稳定性的重要原因之一,易诱发斑块内出血、刺激炎性因子生成,导致斑块破裂,继发性血栓形成、栓子脱落导致心脑血管事件发生[21,22]。近些年来,CEUS技术的发展使得实时、定量观测颈动脉斑块内新生血管得以实现,研究发现CEUS显示的斑块内新生血管密度及斑块的增强程度与斑块的回声有关,新生血管密度、增强程度越高,斑块高危性越大,并且CEUS的结果与组织学检测结果相一致[23]。研究发现,斑块内新生血管密度及增强强度与症状性颈动脉粥样硬化患者斑块的不稳定性以及发生动脉粥样硬化相关心脑血管事件密切相关[24,25]。本研究的结果一定程度上与上述研究相一致,通过对脑梗死组与非脑梗死组患者行颈动脉超声造影发现,两组间在新生血管等级方面有显著的统计学差异(P<0.05),脑梗死组的新生血管等级以III级为主,非脑梗死组以II级为主,其III、IV级新生血管比例明显高于非脑梗死组。这也说明,高等级新生血管与颈动脉斑块不稳定性及脑梗死的发生存在一定的相关性。通过Logistic回归分析发现,新生血管III级与颈动脉粥样硬化患者发生脑梗死密切相关(OR=24,95%CI1.952-295.061)。Huang等[26]对存在颈动脉软斑的缺血性脑卒中患者和非缺血性脑卒中患者行CEUS检查,同样发现,斑块内新生血管的等级越高,缺血性脑卒中发生的风险越大,但两组在造影剂峰强度和达峰时间方面并无显著统计学差异。
动脉粥样硬化斑块内新生血管结构不成熟,内皮细胞发育异常及内皮间连接不完整,导致其通透性增强,各类物质易在斑块内沉积和易发生渗漏,也可引起斑块内炎性反应以及血管反应,刺激巨噬细胞分泌更多的炎性因子,加重斑块的不稳定性[4,27]。在本研究中,将60例颈动脉粥样硬化患者根据CEUS检查中新生血管等级分为4组,探究Lp-PLA2水平与斑块内新生血管等级之间的相关性,经统计分析并未发现两者之间差异有统计学意义(P>0.05)。尽管国内一些小样本量研究显示Lp-PLA2与斑块内新生血管等级存在相关性,但尚缺乏大规模、高质量研究证实。Kolodgie等[28]通过尸检发现,因冠状动脉相关事件猝死的患者,其动脉粥样硬化斑块内Lp-PLA2的含量随着斑块的发生、发展逐渐增高,高浓度的Lp-PLA2多分布在坏死核心、易损破裂斑块等部位。Dallit等[13]也通过免疫组化等方法发现,Lp-PLA2主要分布在坏死的脂质核心区。另外,研究发现,斑块内新生血管多起自动脉外膜,由动脉外膜向斑块内生长,可进入斑块中心、斑块肩部及内膜[29],Saito等[25]通过颈动脉内膜剥脱术发现,斑块内新生血管在斑块肩部更多见。我们推断,Lp-PLA2水平升高和斑块内新生血管等级增高都能够一定程度上影响动脉粥样硬化斑块的稳定性,但其在斑块内的主要分布部位及作用机制存在一定的差异,因此两者之间并无明显的相关性。本研究尚存在一些不足之处,首先本研究样本量较小,在混在因素较多的情况下可能一定程度上影响研究结果,需要更大样本量,更高质量的研究来进一步验证。其次,本研究仅检测了Lp-PLA2的含量,并未进行活动度检测与分析,结果尚不够全面。另外,目前国际上对超声造影的新生血管分级尚无统一标准,并且超声检查均具有一定的主观性,为了减小主观因素影响,本研究均由同一组超声科专家全程进行操作。此外,由于技术条件限制,本研究仅采用二维超声在单一平面对斑块内新生血管进行评估,结果存在一定的误差,而三维立体超声评价斑块内新生血管相对更加全面。
综上所述,Lp-PLA2水平与颈动脉粥样硬化不稳定斑块形成具有一定的相关性,是颈动脉粥样硬化的危险因素,并在一定程度上受LDL、HDL等因素的影响。Lp-PLA2水平与缺血性脑卒中无明显的相关性,尚需更多研究进一步证实。颈动脉斑块内新生血管等级与缺血性脑卒中的发生相关,新生血管等级高者(Ⅲ、Ⅳ级),更易发生缺血性脑卒中,但尚未发现新生血管等级与Lp-PLA2水平之间的相关性,需要更多大样本量、高质量的研究来共同探讨。
