首发精神分裂症偏执型患者的MRS研究
2018-12-17何明颖彭伟生何桂凤
何明颖,彭伟生,何桂凤,杨 毅
(中国人民解放军第180医院放射科,福建 泉州 362000)
精神分裂症(schizophrenia,SP)是由一组症状群组成、病程迁延的慢性精神疾病,临床表现复杂多样,可涉及思维、情感、意志行为及认知功能等方面,其中偏执型以幻觉、妄想为主要临床表现,是SP中最常见的一种类型[1]。近年来,诸多学者利用磁共振质子波谱成像(proton magnetic resonance spectroscopy,1H-MRS)对SP的病理生理机制进行研究,结果显示SP患者的前额叶、海马、扣带回及基底节区存在代谢指标异常。本研究利用1H-MRS对首发SP偏执型患者进行比较,以期获得更多病因学证据,现报道如下。
1 资料与方法
1.1 研究对象 选取2013年3月至2014年12月我院收治的22例首发SP偏执型患者(患者组),其中男 15例,女7例;年龄19~44岁,平均(29.89±9.8)岁;病程(4±3)个月;受教育时间 7~17 年,平均(9.1±5.5)年;均为右利手。所有患者均以临床晤谈的形式明确诊断,采用阳性症状量表(scale for assessment of positive symptoms,SAPS)或阴性症状量表(scale for assessment of negative symptoms,SANS)判断患者病情。纳入标准:①符合《国际疾病分类(第 10版)》(ICD-10)和《美国精神疾病诊断和统计手册(第4版)》(DSM-IV)中偏执型SP的诊断标准;②首次发病,病程<1年,检查前未使用任何抗精神病药物及影响脑内胆碱递质的药物;③SAPS评分>50分。排除标准:①有严重躯体、神经系统、内分泌疾病或先天神经系统发育畸形病史;②有酒精、精神药物滥用史;③存在精神发育迟滞或其他可能影响脑功能的疾病;④常规MRI检查脑实质无明显器质性病变。对照组:选择年龄(20~45岁)、性别(男15例,女7例)与患者组相匹配的健康志愿者22例,均未患任何精神疾病,利手及受教育时间2组相似。本研究经我院伦理委员会批准,研究对象均签署知情同意书。
1.2 扫描方法及后处理 采用Siemens Magnetom stero 3.0 T MRI扫描仪,8通道头颅相控阵线圈,精确摆位使受试者头颅两侧对称且中线居中,并固定海绵垫、塞耳塞减少运动及噪音的影响。首先行常规MRI扫描,明确有无器质性病变,扫描序列为T1WI、T2WI及FLAIR,后行高分辨T1WI扫描,定位后行1HMRS扫描。1H-MRS采用多体素扫描,TR 1 700 ms,TE 135 ms,采集次数3次,扫描时间6 min 53 s。将扫描数据导入后处理工作站(Siemens Syngo Multi Modality Workplace-VE40B)进行分析,选取的 ROI为双侧额叶白质、双侧海马头部及双侧扣带前回。在3个方位(矢状、冠状及横断位)的定位图像上,ROI海马尽量选取海马头部的白质区,扣带前回选取胼胝体膝部前下方的脑回。所有ROI均按照个体差异选取双侧相等的体积,约1 mm3,尽量避开颅骨、脂肪、气腔及脑脊液等部位,获得肌酸(creatine,Cr)、胆碱(choline,Cho)及 N- 乙酰门冬氨酸(N-Acetyl aspartic acid,NAA),以 Cr为参照物,得出 NAA/Cr、Cho/Cr比值。所有扫描均由1位放射科医师操作,在同一时间进行测量分析。
1.3 统计学方法 运用SPSS 16.0软件进行统计分析,将患者组左右对应ROI的NAA/Cr、Cho/Cr值进行组内配对t检验;患者组与对照组对应ROI的NAA/Cr、Cho/Cr值行组间配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者组组内比较(表1) 左侧额叶白质NAA/Cr低于右侧,左侧海马头部 Cho/Cr、NAA/Cr低于右侧(均P<0.05);双侧额叶白质Cho/Cr及双侧扣带前回NAA/Cr、Cho/Cr差异均无统计学意义(均P>0.05)。
2.2 组间比较(表1) 患者组左侧额叶白质及左侧海马头部NAA/Cr均低于对照组(均P<0.05)。右侧额叶白质、右侧海马头部及双侧扣带前回NAA/Cr与对照组差异均无统计学意义(均P>0.05)。双侧额叶白质、双侧海马头部及双侧扣带前回的Cho/Cr与对照组差异均无统计学意义(均P>0.05)。
表1 2组不同ROI的各代谢指标比较(×10-6,±s)
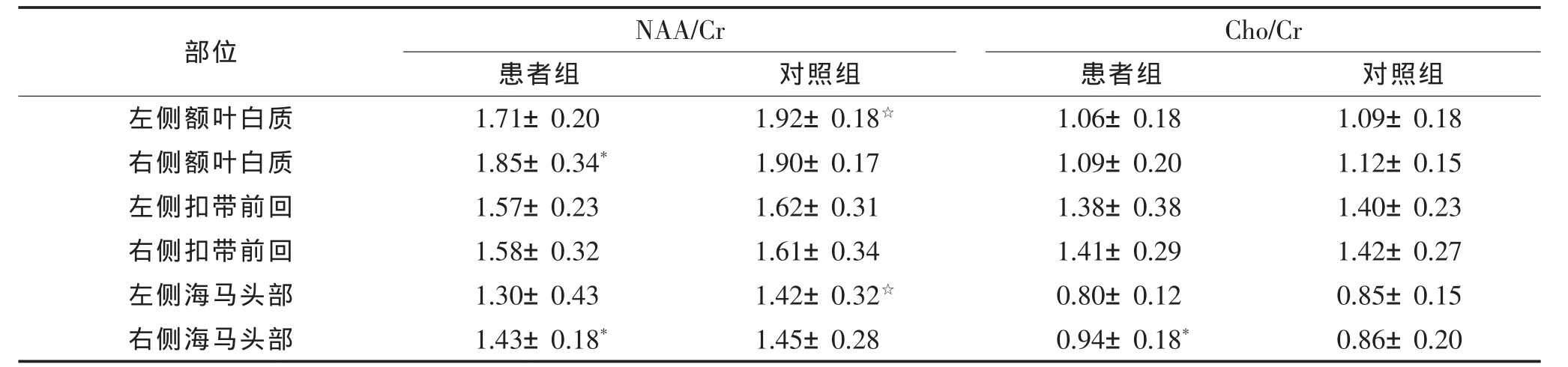
表1 2组不同ROI的各代谢指标比较(×10-6,±s)
注:NAA,N-乙酰门冬氨酸;Cr,肌酸;Cho,胆碱。 * 组内与左侧比较,P<0.05;☆组间比较,P<0.05。
部位 NAA/Cr Cho/Cr患者组 对照组 患者组 对照组左侧额叶白质 1.71±0.20 1.92±0.18☆ 1.06±0.18 1.09±0.18右侧额叶白质 1.85±0.34* 1.90±0.17 1.09±0.20 1.12±0.15左侧扣带前回 1.57±0.23 1.62±0.31 1.38±0.38 1.40±0.23右侧扣带前回 1.58±0.32 1.61±0.34 1.41±0.29 1.42±0.27左侧海马头部 1.30±0.43 1.42±0.32☆ 0.80±0.12 0.85±0.15右侧海马头部 1.43±0.18* 1.45±0.28 0.94±0.18* 0.86±0.20
2.3 对照组组内比较 对照组双侧额叶白质、双侧扣带前回及双侧海马头部NAA/Cr、Cho/Cr值差异均无统计学意义(均P<0.05)。
3 讨论
随着现代神经影像和分子技术的发展,特别是fMRI的发展,医学界对SP患者脑结构与功能异常研究日益深入,目前普遍认为,在SP症状出现前其脑内可能已经出现代谢方面的异常[2]。fMRI技术中的1H-MRS是迄今唯一能无创检测活体组织中不同代谢产物浓度、反映其病理及生理变化特点的定量分析方法,应用最广泛。1H-MRS可检测NAA、Cho及Cr等脑内代谢产物,NAA被认为是神经元的标志物,其含量反映了神经元的数量及功能情况,NAA减少被认为与神经元死亡、细胞体能量缺陷及轴索损伤有关。CHO主要为脂质,多为细胞膜的构成物质或磷脂代谢产物,其升高被认为与神经元星形细胞增多(如神经退行性改变、创伤或其他脑损害的反应性胶质增生)有关。Cr为能量代谢产物,人脑组织在不同情况下,Cr的量保持相对恒定,因此常被用来作为参照物,反映其他代谢产物量的变化[3]。
SP的fMRI研究重点多集中在额叶、海马、扣带回或丘脑等部位,这些部位均为人脑功能区域。若发生病理性损害,认知功能缺陷或缺损性的阴性症状被认为与额叶有关[4],情感和记忆症状与海马区有关[5]。但大多对SP的研究结果并不完全相同,这可能与研究对象的病程、症状、治疗与否及疗程、样本量有关。鉴于以上原因,本研究选取首次发病未治疗的SP偏执型患者作为研究对象,年龄18~45岁,消除了年龄、药物及慢性病程对脑内代谢物的影响,使研究结果相对客观。
本研究显示,患者组组内左侧额叶白质及左侧海马头部NAA/Cr明显小于右侧,考虑可能由于额颞叶发育异常或变性,导致额颞叶神经元完整性或功能异常[6]。 研究[7]表明,NAA 浓度的降低与神经元或轴突的缺失有明显相关性。Steen等[8]的Mata分析指出,SP患者脑内NAA减少的部位范围较广泛,其中以中颞叶(海马部分)和额叶NAA减少为著,与本研究一致。同时本研究还发现,首发SP患者左侧额叶白质及左侧海马头部NAA/Cr明显小与对照组,患者组双侧ROI内Cho/Cr与对照组无明显差异。甘景梨等[9]发现,患者组左侧前额叶和左侧丘脑NAA/Cr值低于对照组,与本研究结果相似。部分研究结果亦支持SP患者前额叶的NAA浓度明显低于正常人[10-11]。但何宗岭等[12]研究未发现SP患者脑代谢物与健康人有差异。
本研究表明,首发偏执型症状为主型SP患者在一定程度上存在脑生物学功能对照偏侧化特征。吴大兴等[13]对伴执行功能障碍的SP患者给予双重工作记忆作业,fMRI示激活脑区增加,以右侧额叶为著,提示左侧额叶功能弱化,认为SP患者大脑存在偏侧化差异。有观点[14]认为脑的偏侧化差异可能是导致SP发病的重要因素,由于左侧额叶及海马发育晚于右侧,优势半球功能出现异常,可能使大脑两半球在认知、情感、行为等精神活动的联系或协调方面出现障碍,从而导致疾病发生。
SP病因学的神经发育假说认为,SP可能是由基因决定的因素之间相互作用的结果[15]。海马异常是此假说的重点,神经结构、功能影像和尸检等多种研究结果也高度支持此观点。动物实验研究[16]证实有易感基因背景动物早期海马损伤后,可产生类似SP反应[16]。 亦有研究[14]发现,SP 患者双侧海马,特别是左侧海马体积明显缩小。脑病理的研究[17]显示,SP患者海马区存在膜代谢异常。此假说认为SP患者额叶功能障碍是由于海马损伤导致的海马-前额叶连接紊乱所致[18]。
综上所述,首发SP偏执型患者脑发育存在病理性改变,表现为脑生物学功能的偏侧化特征,这与既往研究部分相似,一定程度上揭示了SP的病理生理机制,但仍未明确首发SP偏执型的病因,仍需大样本研究进一步证实。
