罗伊氏乳杆菌氮源利用的选择性与特征分析
2018-12-15朱丹凤王园园崔树茂毛丙永赵建新张灏陈卫
朱丹凤,王园园,崔树茂*,毛丙永,赵建新,张灏,陈卫
1(江南大学 食品学院,江苏无锡,214122) 2(无限极(中国)有限公司,广东广州 510623)
罗伊氏乳杆菌属于乳酸杆菌,革兰氏阳性菌,无芽孢,不运动,方形杆状,属于专性异型发酵,生长过程中会产生CO2、乳酸、乙酸和乙醇等。罗伊氏乳杆菌是目前报道的可存在于所有脊椎动物和哺乳动物肠道内的乳酸杆菌,在厌氧或非厌氧环境中都可以生长[1-2]。
罗伊氏乳杆菌是多氨基酸营养缺陷菌株,不能直接利用外源蛋白质和无机氮源,必须通过降解外源蛋白质或肽,以保证菌体正常生长代谢对氨基酸的需要。通常乳酸菌编码相对完善的蛋白水解系统,主要由3部分组成[3]:细胞壁表面的蛋白水解酶,不同类型的氨基酸、二肽、三肽和寡肽转运系统,以及一些胞内肽酶。首先由细胞壁蛋白水解酶降解外源蛋白形成寡肽和氨基酸,目前大多数研究都是乳酸菌在乳制品中的蛋白水解体系,牛乳中的胞外蛋白酶主要水解酪蛋白[4],其他益生菌株对氮源的利用情况很少涉及,之后通过特定的肽转运和氨基酸转运系统运输到细胞内,寡肽通过寡肽转运系统Opp转运,二肽或三肽则是DtpP和DtpT,多数研究证明寡肽转运系统Opp对于菌株利用是最重要的[5-6]。最后由胞内各种肽酶将肽降解为更小的肽和游离氨基酸以提供给菌体生长利用[7]。但是,乳酸菌的蛋白水解系统具有很强的菌株特异性,乳酸菌为适应各自的生长环境,在进化过程中发生诸如点突变、重组或者重复序列变异等自身基因的变异,及基因水平转移,通过获得新基因来适应环境[8];也有一些乳酸菌因生长环境营养丰富,致使一些“无用”的基因不断钝化、衰退、缺失。因此,不同环境中的乳酸菌逐渐形成了菌株和环境特异的氮代谢系统,氮源的利用一直是制约乳酸菌生长的关键因素。罗伊氏乳杆菌138-1筛选自长寿老人肠道,通过动物实验被证明具有降血糖的功效,具有潜在的生产和应用价值。但是,该菌种能够利用什么样的氮源,其对氮源利用具有什么样的特征?目前还是未知。
不同种类的氮源经过不同的水解工艺后,会产生不同组成的氨基酸、寡肽和多肽。罗伊氏乳杆菌氮代谢系统的底物特异性决定其可能对不同氮源具有不同的利用效率。该文将系统探讨罗伊氏乳杆菌138-1对不同种类氮源的利用效率,并进一步分析有效利用的氮源组分,不仅可以为乳酸菌的生产提供氮源优选策略,而且可以指导氮源生产企业。根据菌株对氮源种类和分子量的要求优化水解工艺,让所生产氮源更适宜菌株的增殖。
1 材料和方法
1.1 材料与试剂
1.1.1 菌株
罗伊氏乳杆菌138-1(CCFM8631),江南大学食品生物技术中心保藏。
1.1.2 试剂
葡萄糖测定试剂盒,上海荣盛生物药业有限公司;MRS培养基,青岛海博生物技术有限公司;其余化学试剂均是分析纯,国药集团化学试剂有限公司;市售氮源见表1。

表1 试验氮源Table 1 Sources of different nitrogen sources
1.2 仪器与设备
GRP-9080型隔水式恒温培养箱,上海森信实验仪器有限公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MS 3 basic型涡旋振荡器,德国IKA公司;löser-om806m型冰点渗透压测定仪,德国löser公司;T&J-Minipod 1L×8型迷你平行发酵罐,迪必尔生物工程(上海)有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;UV-2450紫外分光光度计,日本岛津公司;高效液相色谱仪Ag1100,美国安捷伦公司。
1.3 试验方法
1.3.1 菌株的活化与培养
从冻存的甘油保菌管内,用接种环挑取少量菌液于MRS固体培养基划线,将平板置于37 ℃恒温培养箱中培养24 h。从长出的菌落中挑取单菌落,接种于5 mL MRS液体培养基中,在恒温37 ℃培养箱中活化培养18~24 h。重复上述操作1次得到活化后的种子液。
1.3.2 罗伊氏乳杆菌生长曲线的测定
将上述种子液以2%的接种量接种到MRS液体培养基中,置于恒温37℃培养箱中培养。每2 h取样,一部分样品测定菌液的OD600值,当吸光度值超过0.8时,将菌悬液稀释一定倍数,使稀释后的吸光度值在0.2~0.8,菌悬液的OD600值为测定的吸光度值乘以稀释倍数。然后以时间为横坐标,OD600值为纵坐标,绘制菌株生长曲线。另一部分样品经离心去除菌体后,测定发酵中的葡萄糖含量和总酸含量,计算罗伊氏乳杆菌发酵过程中代谢单位葡萄糖的产酸量。
1.3.3 罗伊氏乳杆菌分批培养最高生物量测定
准确称取25 g/L上述不同氮源,替换MRS培养基中的所有氮源(胰酪蛋白胨、酵母粉和牛肉膏),配制成不同氮源的培养基。以2%的接种量接入待实验菌株,置于37 ℃培养箱中静置培养,待菌株生长至稳定期前后(6、8和10 h),取样测定OD600,以MRS为对照。
1.3.4 罗伊氏乳杆菌恒pH自动反馈补糖生长曲线的测定
根据1.3.3配制不同氮源的培养基,以相同的量置于T&J-Minipod 1L×8型迷你平行发酵罐。以5%的接种量接入待实验菌株,通过发酵罐的控制系统,恒pH 6.0自动反馈补糖培养,确保菌体在增殖过程中不受到酸和碳源缺乏的抑制[9]。具体操作如下:
分别配制400 g/L(C碱)的NaOH溶液和400 g/L(C料)的葡萄糖溶液,并分别置于补碱瓶和补糖瓶。开启发酵罐补糖与补碱的关联系统,关联比例(k)根据以下公式设置:
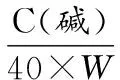
式中:40表示NaOH的摩尔质量,g/mol;W,表示菌株代谢单位质量的葡萄糖产生酸的摩尔质量,mol/g,该值由1.3.2测定得到。恒pH自动反馈补糖过程中,每2 h取样,分别测定菌液OD600、发酵液葡萄糖含量及渗透压,并在菌液浓度达到最高时,通过平板菌落计数法测定发酵液活菌数,并保存发酵前和发酵后的发酵液,用于测定氨基酸和肽组成变化。
1.3.5 发酵液氮源组成分析
根据LIU等的方法,进行发酵液氨基酸和肽组成的测定[10]。氨基酸测定操作如下:色谱柱为5 μm ODS HYPERSIL(250 mm×4.6 mm),柱温40℃,流动相A相:将8.0 g结晶乙酸钠加入1 000 mL水搅拌使其充分溶解,之后在烧杯中加入225 μL三乙胺,边搅拌边滴加体积分数为5%的醋酸,将pH值调到7.2±0.05;最后加5 mL四氢呋喃,混合后备用。流动相B相:将8.0 g结晶乙酸钠加入400 mL水搅拌使其充分溶解,同样滴加体积分数为2%醋酸将pH值调到7.2±0.05;将此溶液加入至800 mL乙腈和800 mL甲醇,混合后备用。样品前处理:取1 mL样液(根据最终氨基酸总量对样品进行稀释),加入1 mL 100 g/L三氯乙酸(TCA)进行1∶1稀释,记录稀释倍数。室温下放置1 h,用0.22 μm针头式滤器过滤。滤液取1 mL转移入1.5 mL的离心管中,离心(15 000 r/min,30 min)。取出后,移取400 μL于液相小瓶中,盖上液相小瓶帽。
肽组成测定如下:色谱柱为TSKgel 2000 SWXL(300 mm×7.8 mm),流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1混合溶液,流速设置为0.5 mL/min,柱温是30 ℃,紫外检测器的检测波长设定为220 nm。
1.3.6 发酵液葡萄糖测定
采用葡萄糖氧化酶-过氧化物酶法测定发酵液中的葡萄糖浓度,按照葡萄糖测定试剂盒的说明,具体操作如下:等体积混合试剂1和试剂2,分装成1 mL的测试管,样品管加入10 μL待测样品,标准管加入10 μL葡萄糖标准液,空白管加入10 μL蒸馏水。37 ℃水浴10 min,用空白管调零,在505 nm下测定样品管和标准管的吸光度,通过以下公式计算得到葡萄糖的浓度:
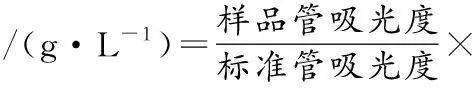
1.3.7 发酵液渗透压测定
发酵液离心后取100 μL用渗透压测定仪直接测定。
1.3.8 数据统计与分析
试验中每个实验值的测定均为3次平行实验的平均值。
2 结果与分析
2.1 罗伊氏乳杆菌生长曲线
按照1.3.2所述方法,对罗伊氏乳杆菌138-1进行生长曲线的测定。从0 h开始,每2 h测1次OD600,直至菌体不再生长为止,绘制的生长曲线如下图1。0~2 h为延滞期,菌体生长缓慢;2~8 h为指数生长期,菌体快速生长繁殖;8~12 h为稳定期,菌体生长量达到最大,并且基本保持恒定;12 h之后菌体进入衰亡期。
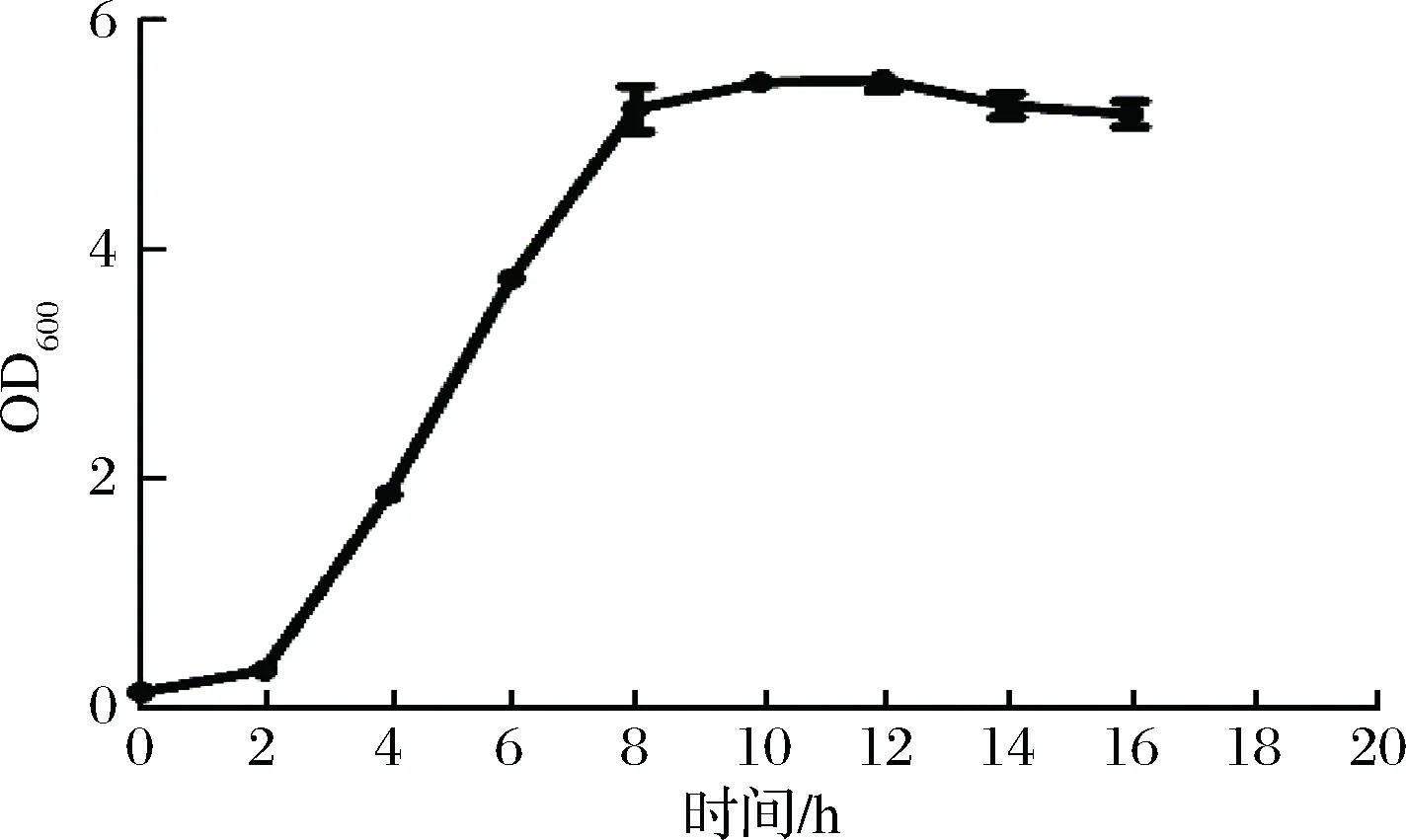
图1 罗伊氏乳杆菌138-1的生长曲线Fig.1 Growth curve of Lactobacillus reuteri 138-1
2.2 罗伊氏乳杆菌利用不同氮源初步分析
以不同氮源发酵液分批培养罗伊氏乳杆菌138-1,根据生长过程的最高生物量初步分析其对21种不同氮源的利用效率,结果如表2所示。

表2 不同氮源发酵液分批罗伊氏乳杆菌138-1的最高生物量Table 2 Effects of Lactobacillus reuteri 138-1 on theproliferation of different nitrogen sources
罗伊氏乳杆菌138-1对酵母提取物、酵母蛋白103、酵母浸粉528、酵母浸粉803具有最高的利用效率,其次是胰蛋白胨,对其他种类的氮源利用效果较差,或者基本不利用氮源。表明罗伊氏乳杆菌对不同种类的氮源具有偏好性,同时也发现同一类别氮源对菌株的增殖效果有差异。可能是同一类别的氮源经不同的水解工艺,产生的氨基酸和多肽组成不同,也说明了菌株可利用的氮源相对分子质量可能具有偏好性。
在分批培养过程中,发酵液pH值的降低会抑制菌体的生长,即氮源还未被利用完全,菌株即因酸积累停止生长。4种酵母类氮源、胰蛋白胨氮源培养基与对照MRS培养基分批培养罗伊氏乳杆菌最高生物量没有显著差异,可能是因为不同氮源的可被有效利用的成分含量不同,也可能是因为不同氮源的缓冲能力不同。因此需要通过恒pH 6.0(解除酸抑制)并补糖(自动反馈补料补充碳源)的培养方式,进一步分析上述氮源对罗伊氏乳杆菌的增殖效率。
2.3 罗伊氏乳杆菌氮源利用的选择性分析
采用恒pH自动反馈补糖培养罗伊氏乳杆菌138-1进一步分析其利用4种酵母类氮源和胰蛋白胨的增殖效率,结果如图2所示。
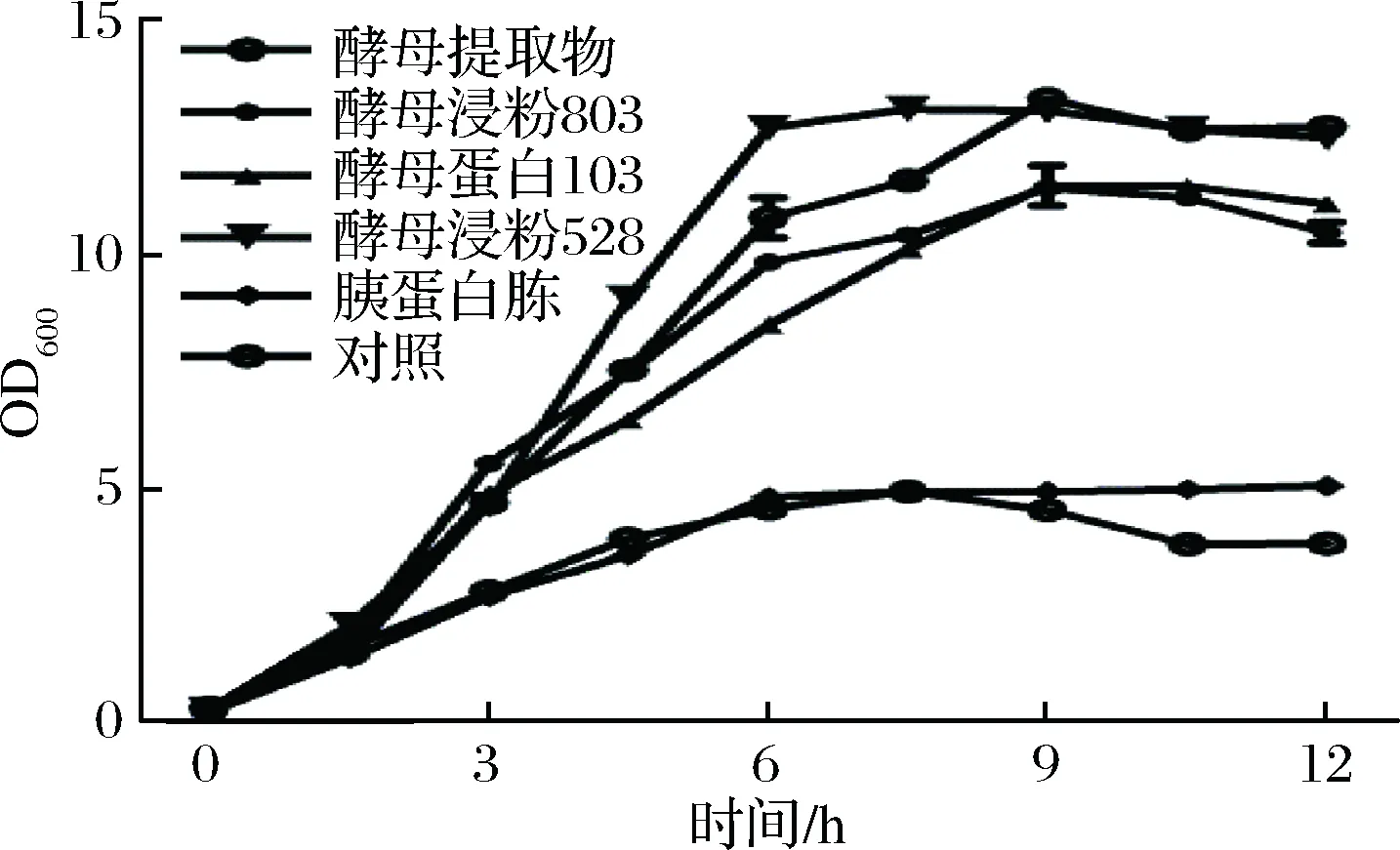
图2 罗伊氏乳杆菌138-1利用不同氮源恒pH补糖培养生长曲线Fig.2 The growth curve of Lactobacillus reuteri 138-1 using different nitrogen sources with constant pH and automatic feedback feeding culture
罗伊氏乳杆菌138-1利用酵母类氮源的生长速率和最大生物量显著高于胰蛋白胨和MRS培养基,其中利用酵母蛋白528和酵母提取物生长的最大生物量最高,OD600分别达到13.10±0.32和13.40±0.13,是胰蛋白胨和MRS培养基的3倍左右。但是,该结果不能充分说明罗伊氏乳杆菌138-1对酵母提取物和酵母浸粉528的选择性最好,菌株生长至最大生物量时也会受到发酵体系底物浓度、渗透压和生长因子的影响。
通过连续测定发酵过程中发酵液的葡萄糖质量浓度(图3),发现菌株利用不同氮源发酵过程中葡萄糖含量在一定范围内变化,但均没有出现过高或过低的情况。表明自动反馈补糖培养方式可以根据菌体生长过程中对糖的需求自动补糖,使糖含量保持在一个稳定的范围,证实了该培养方式的可靠性,也排除了糖含量不足对菌体生长的影响。通过测定各氮源发酵培养基在菌株停止生长时的渗透压,发现罗伊氏乳杆菌138-1利用酵母浸粉528生长至最高生物量时,发酵液的渗透压最高,达到(1 618±15) mOsm/kg。根据菌株的耐渗透压实验,发现直至MRS培养基添加NaCl浓度为36 g/L(约为1 600 mOsm/kg),罗伊氏乳杆菌138-1依然可以生长,排除渗透压的影响,证实各氮源培养基中菌株停止生长不是因为渗透压的影响。

图3 恒pH自动反馈补糖培养罗伊氏乳杆菌138-1生长过程发酵液糖含量的变化Fig.3 Changes of glucose content in fermentation broth of Lactobacillus reuteri 138-1 during constant pH and automatic feedback feeding culture
众所周知,生长因子是菌株生长必不可少的微量物质,但微生物本身却不可以合成,如果菌株生长缺乏生长因子的话,蛋白水解系统中的酶系表达会受影响,进而严重影响其代谢增殖水平。酵母提取物等氮源通常被认为是富含生长因子的氮源,其对罗伊氏乳杆菌138-1的增殖效率高可能是因为其富含生长因子的原因。为了探究菌株增殖浓度的不同是否是受生长因子缺乏的影响,将增殖效果差的氮源与可能含生长因子的酵母类氮源1∶1复合分析其对实验菌株的增殖效率的影响(图4)。如果增殖效果差的氮源确是因为氮源缺乏生长因子所致,且酵母类氮源富含生长因子,则两者氮源复合后,生长因子会促进实验菌株对效果差的氮源的利用,菌株利用复合氮源的最大生物量会与利用酵母类氮源相同,甚至更高;如果菌株利用各氮源的差异不是由于生长因子的缺乏所致,导致两者复合后,菌株利用复合氮源的最大生物量是利用各自氮源的最大生物量的一半相加之和。
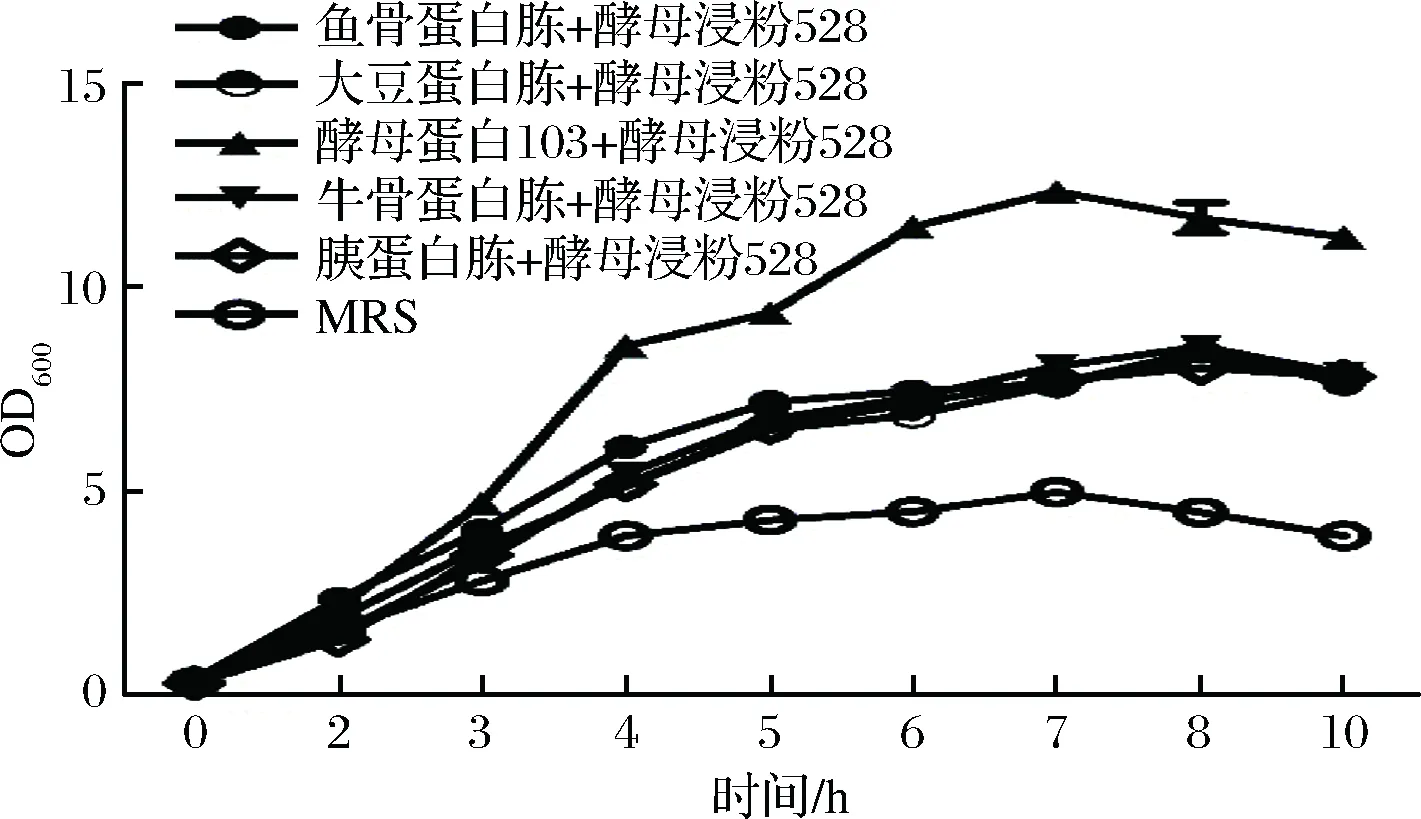
图4 恒pH自动反馈补糖培养罗伊氏乳杆菌138-1利用复合氮源的生长曲线Fig.4 Growth curve of Lactobacillus reuteri 138 - 1 with compound nitrogen sources during constant pH and automatic feedback feeding culture
通过恒pH自动反馈补糖培养罗伊氏乳杆菌138-1利用酵母浸粉528与其他氮源复合的增殖效率,结果显示,复合氮源并没有提高菌株的生长速率及最大生物量。说明增殖效果差的氮源不是由于缺乏生长因子,而是本身可被罗伊氏乳杆菌138-1利用的有效氮源含量少导致。
2.4 罗伊氏乳杆菌对氮源利用的特征
通过罗伊氏乳杆菌138-1对不同氮源的选择性分析,证实各氮源被利用的差异,是因为各氮源中被罗伊氏乳杆菌有效利用的氮源成分含量不同所致,通过分析各氮源的多肽组成(如表3),发现每种氮源的肽分子质量分布虽有差异,但分子量小于2 000 Da的多肽含量均丰富,最显著的差异是酵母类氮源中氨基酸含量高。但是,以酵母浸粉528氮源研究氨基酸对罗伊氏乳杆菌138-1的影响,发现菌株发酵前后,氨基酸的种类和含量并没有显著降低,其他氮源的氨基酸种类和含量也很丰富(文中未列出),说明氨基酸并不是限制其生长的因素。
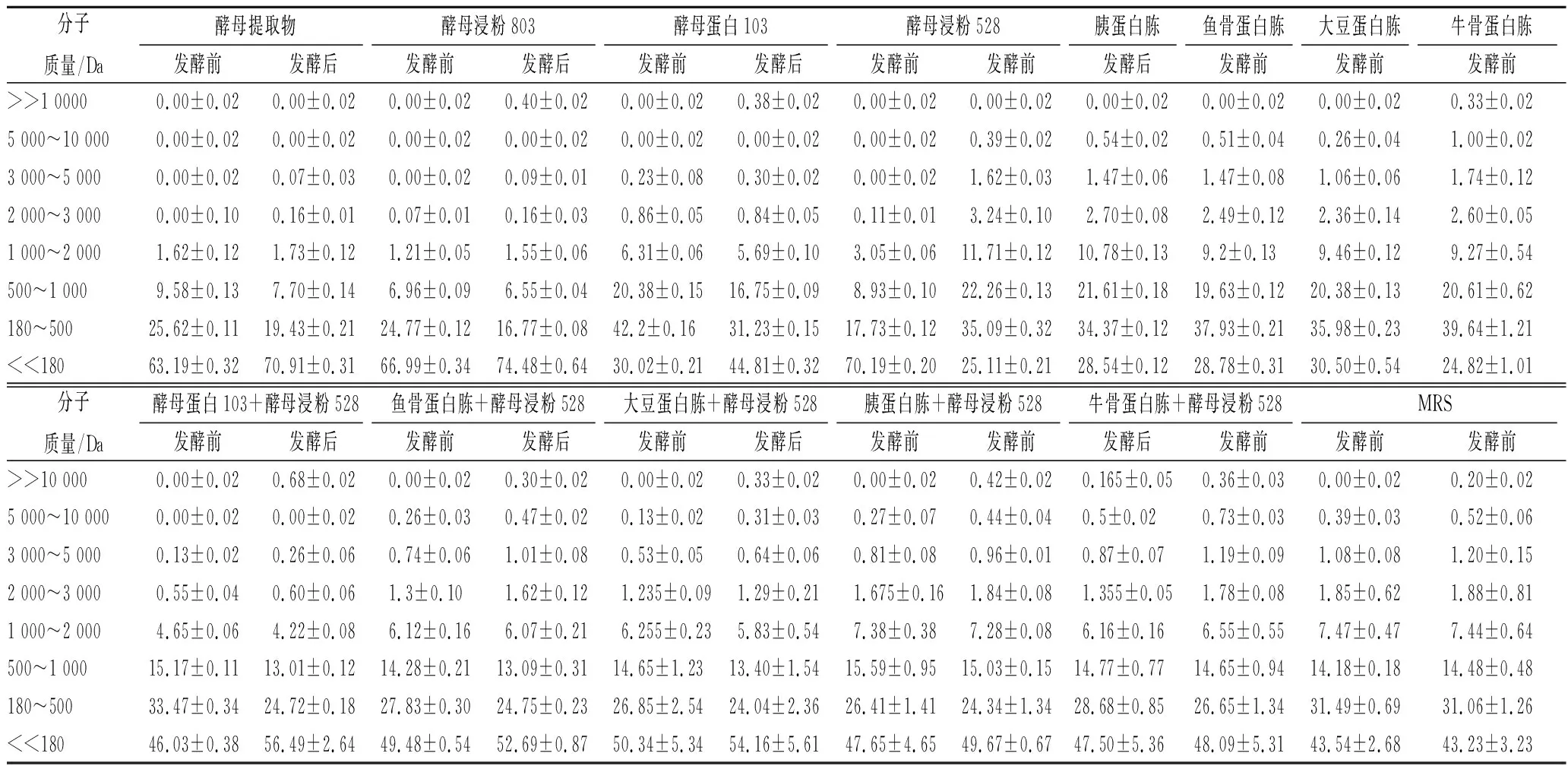
表3 不同氮源发酵前后HPLC分析Table 3 Fermentation before and after of HPLC analysis with different nitrogen sources
PICON等[3]发现,24株乳球菌中,有18株菌株含有Opp和Dpp,肽酶的活力是最高的。杜越欧等[6]研究发现,乳酸菌主要利用氮源中的多肽,在未添加和添加了多肽的培养基中,乳酸菌的关键酶基因表达有显著差异,说明肽含量是乳酸菌生长的一个限制因素。通过分析发酵前后各氮源多肽的变化,发现罗伊氏乳杆菌主要利用分子质量在1 000 Da以下的肽,且对500 Da以下的小分子肽利用率最高。1分子氨基酸平均分子质量为120 Da左右,即罗伊氏乳杆菌138-1仅能利用二肽~五肽的小分子肽,大分子肽及蛋白质无法利用,且利用的肽的种类主要来自于酵母类蛋白的水解产物,对其他蛋白水解得到的肽利用很少。酵母类氮源中含有大量的小分子肽,小分子肽通过特定的肽转运系统运输到细胞内,进一步由胞内各种肽酶降解为更小的肽和游离氨基酸以提供菌体生长利用。一些氨基酸生物合成能力较差的菌株,只能通过编码更丰富的肽酶和肽转运系统来满足自身生长的需要[11-12]。罗伊氏乳杆菌不能很好地利用大分子蛋白,可能与其不能合成细胞壁蛋白水解酶有关[13],只有小分子肽才被利用。而且不同蛋白所含的小分子肽即使分子质量相近,但由于肽转运系统的底物特异性[14-15],导致来源不同的氮源即使分子质量相同,乳酸菌也不能利用。LIU等[16]对乳酸菌蛋白水解体系在不同菌种之间的差异性进行研究,发现不同菌种甚至菌株之间蛋白水解体系都有明显的差异。因此对于上述的复合氮源结果也是吻合的,由于添加了酵母类氮源,罗伊氏乳杆菌利用其可利用的肽类,其他种类的氮源仍然不被利用,与是否缺乏生长因子没有关系。
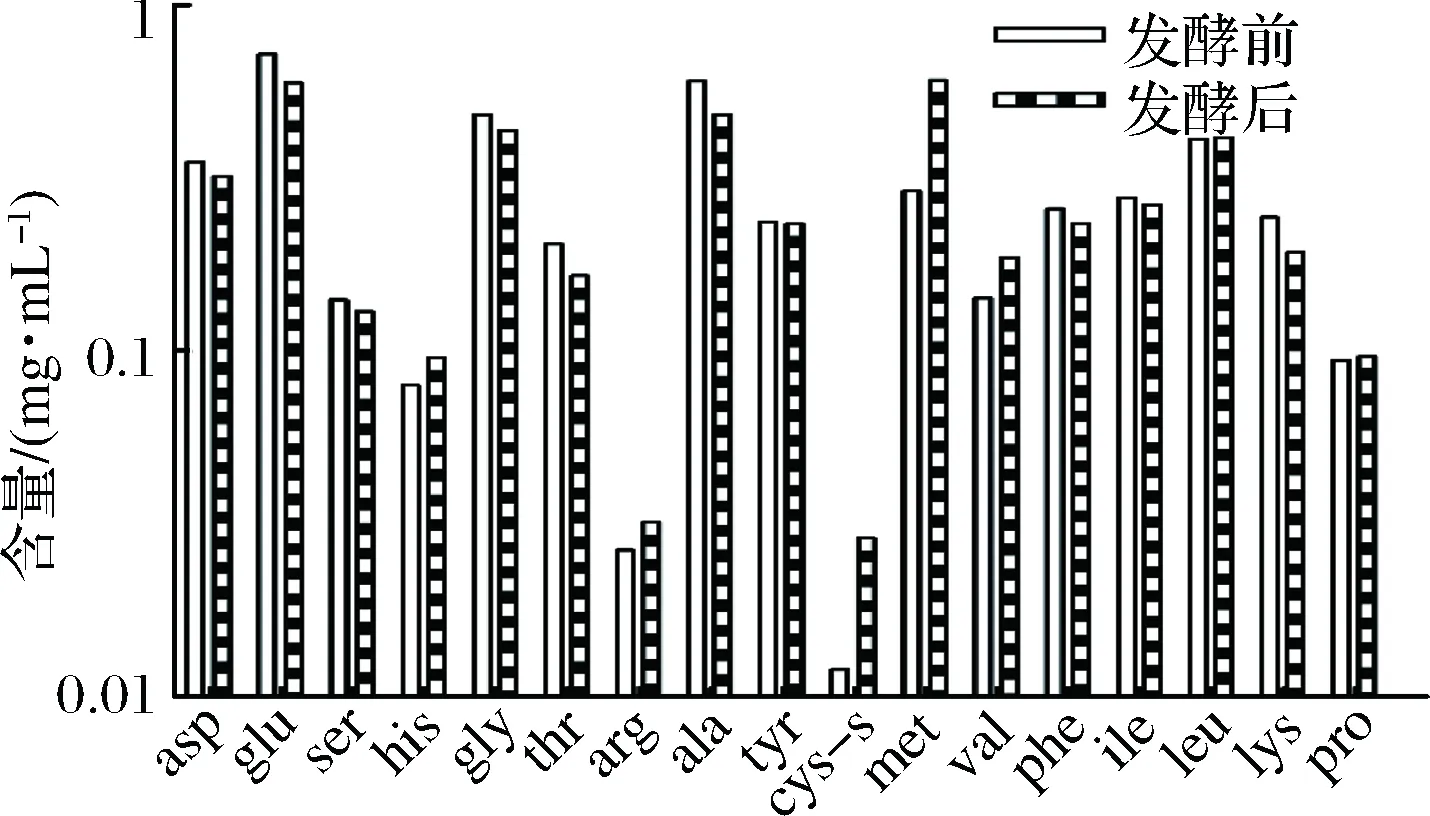
图5 罗伊氏乳杆菌138-1酵母浸粉528发酵前后游离氨基酸变化Fig.5 Comparison of free amino acid composition of Lactobacillus reuteri 138-1 with yeast extract 528 fermentation before and after
3 结论
(1)罗伊氏乳杆菌138-1对于不同种类的氮源具有偏好性,主要利用酵母类氮源,也可利用胰蛋白胨。对其他种类的氮源如植物类氮源(大豆蛋白胨、水解植物蛋白等)和动物类氮源(鱼骨蛋白胨、牛肉蛋白胨、牛骨蛋白胨等)利用效果较差或基本不利用。
(2)通过恒pH自动反馈补糖培养罗伊氏乳杆菌138-1,酵母浸粉528和酵母提取物的增殖效率最高,最大生物量分别达到13.10±0.32和13.40±0.13,是MRS的3倍左右。
(3)罗伊氏乳杆菌138-1氮源利用的选择性归因于氮源本身可被菌株有效利用的氮源含量,与生长因子无关。
(4)添加了酵母浸粉528的培养基,发酵前后游离氨基酸都是充足的,证明氨基酸不是罗伊氏乳杆菌的限制性底物,肽含量可能是菌株的生长限制性底物。而且发酵前不同种类氮源肽含量均丰富,但是菌株利用却有差异性。酵母类氮源原料是酵母蛋白,整体的分子质量都集中在500 Da以下;乳基蛋白原料是水解酪蛋白,动物类蛋白和植物类蛋白原料都是大分子的组织蛋白,可以看出罗伊氏乳杆菌可能对氮源种类具有偏好性。
(5)罗伊氏乳杆菌138-1对于同一种类的氮源也具有偏好性。虽然罗伊氏乳杆菌对微生物类氮源具有偏好性,但是当1 000 Da氮源肽段含量丰富时,菌株的比生长速率和最高生物量都会显著升高,尤其是180~500 Da利用率最高。本实验结果对于工业上罗伊氏乳杆菌的增殖具有极其重要的指导意义,同时可以结合蛋白水解技术,将廉价的蛋白原料经过蛋白酶水解,使其水解底物的肽段集中在180~500 Da,可以直接用于罗伊氏乳杆菌的增殖培养。对于不同的氮源,也可以直接推断出罗伊氏乳杆菌的增殖效果,此举减少了大量的人力物力,对未来罗伊氏乳杆菌的利用起到了很大的推动作用,不仅仅是罗伊氏乳杆菌,其他的乳酸菌也是可以同样找到规律。
