基于DART-MS技术的人参皂苷结构分析
2018-12-15闫福源王任晶崔长升刘淑莹
闫福源,许 宁,王任晶,崔长升,齐 滨,刘淑莹,王 洋,刘 莉
(长春中医药大学,长春 130117)
最早的直接离子化方式电喷雾解吸电离(DESI)由Cooks等[1]在 2004 年提出,实现了常压下对固体表面痕量待测物的直接分析,该技术还应用于药品中非法添加物分析[2]和天然植物产物分析[3]等。在所有的直接质谱分析中,最早实现商品化的直接电离源是实时直接分析(DART)[4]。2005年,Cody等[5]报道了实时直接分析,这是继电喷雾电离源成功解决了传统质谱电离源无法分析生物大分子这一难题后,又一具有革命性的质谱离子化技术。与DESI相比,因无需化学溶剂辅助离子化,对样品和环境均无污染,离子化效率更高,操作更简便,也是近年分析技术的研究热点之一,在法庭科学中微量物证和毒物毒品检验[6-7]、烟草及烟草制品中的烟碱检测[8]、包装材料中禁限用成分检测[9]和谷物中霉菌毒素分析[10]等方面均有应用。
人参皂苷(ginsenosides)是由人参皂苷元与糖相连构成的糖氧苷类化合物,为人参、西洋参和三七等五加科人参属植物中主要有效成分。通常,人参皂苷按皂苷元的结构不同主要分为三大类,即达玛烷型、齐墩果烷型和奥克梯隆型三类。达玛烷型人参皂苷包括人参二醇型和人参三醇型两类。奥克梯隆型目前为止在人参及三七中未发现,是区别人参和西洋参的特征成分。近年来,从人参中分离鉴定了50余种人参皂苷,从西洋参中分离鉴定了60余种人参皂苷,从三七中分离鉴定了20余种人参皂苷。本文通过DART-MS技术建立了人参皂苷快速定性检测方法,该方法具有通用性强、耐用性好、检测灵敏度高、操作简单等特点。
1 材料与方法
1.1 仪器与试剂 四极杆-飞行时间质谱仪(6520 Q-TOF,美国安捷伦公司),实时直接分析电离源(Dart,美国Ion Sense 公司)。
人 参 皂 苷 标 准 品 Rb1、Rb2、Rb3、Rc、Rd、Rh2、CK、F2、Re、Rf、Rg1、Rg2、Rh1、notoginsenoside-R1、原人参二醇、原人参三醇、拟人参皂苷PF11、齐墩果酸Ro由吉林大学药学院徐景达教授提供。甲醇为色谱纯试剂,水为超纯水。四甲基氢氧化铵购自阿拉丁(上海)试剂有限公司。
1.2 样品制备 取人参皂苷的标准品和样品适量,分别加甲醇制成1 mg/mL的溶液。取TMAH适量,用色谱甲醇配成1%的溶液。
1.3 仪器条件 DART离子源参数:氦气温度为400 ℃,氦气流速为2.0 L/min,干燥气(N2)流量为9 L/min,雾化器压力为275 kPa。
Q-TOF质谱参数:毛细管电压为3 500 V,锥孔电压为65 V,碎裂电压为150 V,采用正离子模式和负离子模式对人参皂苷样品进行分析。
2 结果
2.1 人参皂苷直接进样检测 人参皂苷种类不同,达玛烷型(Dammarane type)二醇型、三醇型、齐墩果烷型(Oleanane)、奥克梯隆醇型(Ocotillol),以下将分别讨论。
2.1.1 二醇型人参皂苷(例如:CK化合物 MW =622) 正谱解析过程如下:分子离子峰被发现[M+H]+(m/z 623.4360),分子脱水后形成的分子离子峰被发现[M- H2O+H]+(m/z 605.4167)。CK的二醇型苷元的分子离子峰被发现(461.3912),苷元分别脱去三分子水的分子离子峰被发现(407.3512,425.3611,443.3713),证实CK苷元中含有三个羟基,高温下发生了脱水反应。[M2+H]+(1245.8677),[M3+H]+(1869.2687),[M4+H]+(2491.6835),CK的缔合体被发现。特征峰m/z:443、623、1245。
负谱解析过程如下:CK减氢峰,二聚体,三聚体,四聚体的减氢峰被发现,即[M-H]-(621.4685)、[M2-H]-(1243.9389)、[M3-H]-(1867.4109)、[M4-H]-(2489.8728)。特征峰 m/z:621、1243、1867、2489。
2.1.2 原人参二醇(MW = 460) 正谱解析过程如下:[M+H]+分子离子峰被发现(461.3459),该峰分别脱去三分子水的分子离子峰被发现(443.3524、425.3436、407.3339),证实原人参二醇中含有三个羟基,高温下发生了脱水反应。[M2+H]+(921.8314), [M3+H]+(1382.0899), [M4+H]+(1843.4574),缔合体被发现。特征峰 m/z:425/461、921、1382。
负谱解析过程如下:发现了聚合体减氢峰[M-H]-(459.4100)、[M2-H]-(919.8192)、[M3-H]-(1380.2334)、[M4-H]-(1841.6502)。 特 征 峰 m/z:459、919、1380、1841。
2.1.3 原人参三醇(MW = 476) 正谱解析过程如下:[M+H]+分子离子峰被发现(477.3884),该峰分别脱去四分子水的分子离子峰被发现(459.3776,441.3672,423.3558,405.3476),证实原人参三醇中含有4个羟基,高温下发生了脱水反应。[M2+H]+(953.7677),[M3+H]+(1430.1496),[M4+H]+(1907.5331),缔合体被发现。特征峰m/z:459、953、1430。
负谱解析过程如下:发现了聚合体减氢峰[M-H]-(475.4048)、[M2-H]-(951.8123)、[M3-H]-(1428.2204)、[M4-H]-(1905.6316)。特征峰 m/z:475、951、1428、1905。
2.1.4 奥克梯隆型——拟人参皂苷PF11(MW =800) 正谱解析过程如下:[M+H]+分子离子峰被发现(801.4934),没有发现脱水峰。PF11脱去一个鼠李糖残基[M-146+H]+被发现(655.4364),继续脱去一个葡萄糖残基[M-146-162+H]+被发现(493.3846),即拟人参皂苷的苷元峰,苷元分别脱去四分子水的分子离子峰被发现(475.3675、457.3564、439.3475、421.3370),证实苷元中含有四个羟基,高温下发生了脱水反应。特征峰m/z:493、655、801。
负谱解析过程如下:减氢峰,二聚体的减氢峰被依次发现,即[M-H]-(799.5210)、[M2-H]-(1600.0403)。特征峰 m/z:799、1600。
2.1.5 齐墩果烷型——齐墩果酸(Ro)(MW =956),苷元(M=456) 由于齐墩果酸中含有羧基,不适合做正谱,故选择负谱。负谱解析过程如下:[M-H]-(955)、[M-162-H]-(793)、[M-162-162-H]-(631)、[M-162-162-176-H]-(455)、即齐墩果酸的苷元峰被发现,证实齐墩果酸中还有两个葡萄糖残基和一个6-甲酰基葡萄糖残基,而且6-甲酰基葡萄糖残基是连在苷元上的,两个葡萄糖是末端连接。苷元的二聚体减氢峰也被发现(911)。特征峰m/z:955、793、631、455。
2.2 人参皂苷衍生化后检测 于擎等[11]研究了人参皂苷Rb1和Rf与四甲基氢氧化铵结合后在DART源中发生甲基化及电离的过程,并从凝聚相和气相的角度对电离过程中的甲基化机理进行了研究。我们选用的衍生化试剂为氢氧化四甲基铵,具有较强的碱性和甲基化能力,同时易挥发,适合用于样品进行DARTMS检测来确定结构。
2.2.1 达玛烷型(Dammarane type)二醇组皂苷 达玛烷型二醇组皂苷的苷元是原人参二醇,C30H52O3,M =460.3916,二醇组人参皂苷在3号碳和20号碳上连有糖链,12号碳上连有一个醇羟基,其中20号碳为叔碳原子,较活拨,高温时易断键3号碳为仲碳原子,没有叔碳原子活泼,检测时未断键。
二醇型人参皂苷共有的特点是可能有1~2个特征峰,峰1为人参皂苷中20号碳原子断键后剩余的羟基全部甲基化后加合一个N(CH3)3H+形成的准分子离子峰,峰2为人参皂苷糖链上的羟基和苷元上的羟基全部甲基化后加合一个N(CH3)3H+形成的准分子离子峰,由于20号碳原子活泼,容易断键,故峰1往往是基峰。
2.2.2 达玛烷型(Dammarane type)三醇组皂苷 达玛烷型三醇组皂苷的苷元是原人参三醇,C30H52O4,M =476.3866,三醇组人参皂苷在6号碳和20号碳上连有糖链,3号位和12号位分别连有一个醇羟基,其中20号碳为叔碳原子,较活泼,高温时易断键,3号碳为仲碳原子,没有叔碳原子活泼,检测时未断键。三醇型人参皂苷共有的特点是可能有1~2个特征峰,峰1为人参皂苷中20号碳原子断键后剩余的羟基全部甲基化后和加合一个N(CH3)3H+形成的准分子离子产生的峰,峰2为人参皂苷糖链上的羟基和苷元上的羟基全部甲基化后加合一个N(CH3)3H+形成的准分子离子产生的峰,由于20号碳原子活泼,容易断键,故峰1往往是基峰。
2.2.3 苷元 1)原人参二醇(MW = 460)。基峰:m/z = M+14×n(羟基数目)+ N(CH3)3H+= 460+14×3+60 = 562。在谱图中发现562-14,562-14×2,562-14×3的峰,证明原人参二醇苷元中含有三个醇羟基,由于20号位的羟基空间位阻较大,不易甲基化,故562-14的峰丰度较高。特征峰m/z:562,562-14。2)原人参三醇(MW = 476)。基峰:m/z = M+14×n(羟基数目)+ N(CH3)3H+= 476+14×4+60 = 592。在谱图中发现592-14,592-14×2,592-14×3,592-14×4的峰,证明原人参三醇苷元中含有四个醇羟基,由于20号位的羟基空间位阻较大,不易甲基化,故592-14的峰丰度较高。特征峰m/z:578,592。
2.2.4 奥克梯隆醇型——拟人参皂苷PF11(M =800) 基峰:m/z = M+14×n(羟基数目)+ N(CH3)3H+= 800+14×9+60 = 986。在谱图中发现986-14,986-14×2,986-14×3的峰,证明原人参三醇苷元中含有三个醇羟基,由于20号位的羟基空间位阻较大,不易甲基化,故986-14的峰丰度较高。986+14:m/z = M-M(glc)+14×n(羟基数目)+ N(CH3)特征峰m/z:986。
2.2.5 齐墩果烷型——齐墩果酸(Ro)(MW =956),苷元(M = 456) 峰1:甲酰氧基断裂,m/z =(M-glc)+14×n( 羟 基 数 目)+ N(CH3)3H+=956-180+14×7+60 = 934。 峰 2: 苷 键 断 裂,m/z =(M-162)+14×n(羟基数目)+ N(CH3)3H+= 800-162+14×8+60 = 966。见图 1。
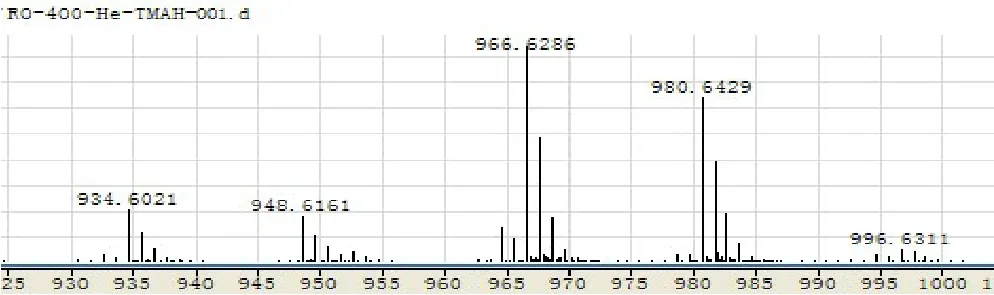
图1 Ro衍生化DART-MS图
在谱图中没有发现Ro全部甲基化后和N(CH3)3H+结合的分子离子峰,说明28号碳原子以酯键形式存在,在实验条件下极易断裂,故基峰为28号碳原子的酯键断裂后形成的峰,即峰2。谱图中还发现了934+14,966+14,是与N(CH3)4+结合的结果。值得注意的是,其他类型的皂苷的特征峰断键时只有一种情况,而Ro断键时两种情况均体现出来,其中甲酰氧基断裂的情况丰度较高,为基峰。特征峰m/z:934,966。
2.3 人参皂苷化合物及其特征峰 见表1。
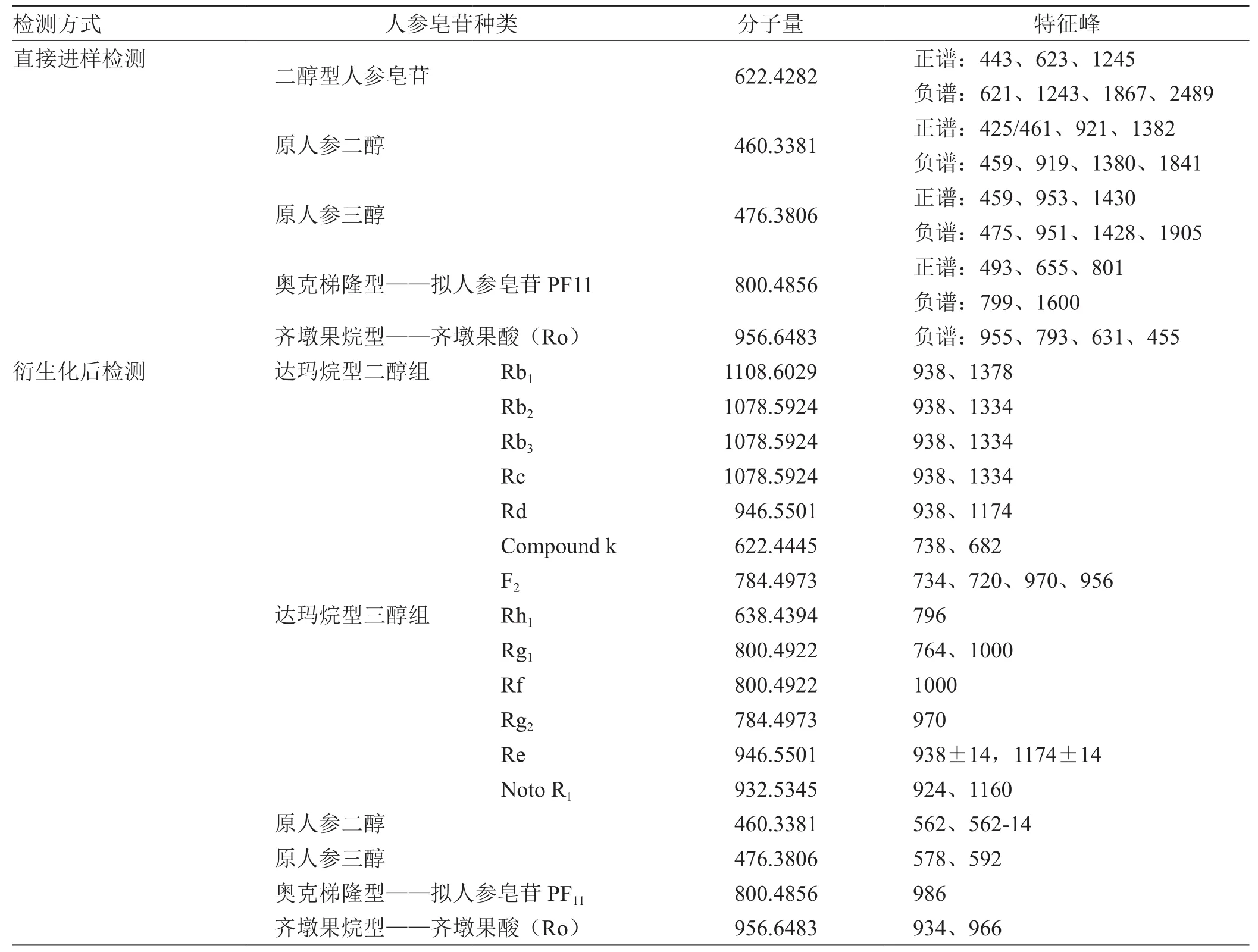
表1 人参皂苷化合物及其特征峰
3 讨论
本文应用了DART-MS技术对人参皂苷结构进行定性检测,该技术具有通用性强、耐用性好、检测灵敏度高、操作简单等特点,可以对不同的人参皂苷及人参皂苷同分异构体之间进行区分,还可以检测含有人参皂苷的样品,对该领域的进一步研究有一定的重要意义。
首先可以进行不同的人参皂苷的区分。人参皂苷-Rf是人参的特征成分,而24(R)-假人参皂苷PF11是西洋参的特征成分,三七所独有的皂苷类成分,如三七皂苷(notoginsenoside) R1。它们在DART-MS中体现的特征峰不同,故可将三种不同物质区分开。
其次可以进行人参皂苷同分异构体之间的区分。不同结构的人参皂苷体现的特征峰不同,有一些互为同分异构体的人参皂苷体现的特征峰也不相同,可以利用DART-MS技术将它们区分开。F2与Rg2的分子量均为784.497 3,但是它们的衍生化产物的特征峰不同,F2的特征峰是734、970,而Rg2的特征峰只有970,没有734,可以将二者区分开;Rg1与Rf的分子量均为800.4922,但是它们的衍生化产物的特征峰不同,Rg1的特征峰是764、1 000,而Rf的特征峰只有1 000,没有764,可以将二者区分开。
最后可以检测含有人参皂苷的样品。样品有茎叶总皂苷、人参根总皂苷、三七总皂苷、红参总皂苷,在得到的谱图中均含有938特征峰,表明其中可能还有Rb1、Rd、Rb2、Rc、Re、Rb3,而这些正是人参中的常量皂苷,丰度最高,为基峰,在上述四种物质中也发现了1174的峰,这正是Re的特征峰,表明它们均含有Re。在三七总皂苷中还发现了764、924,这是Rg1和R1的特征峰。
