碳酸钙作为褐藻酸钠钙化剂的应用研究*
2018-12-14苗钧魁祝春英于跃芹冷凯良
苗钧魁 ,祝春英 ,于跃芹 ,冷凯良
(1.青岛科技大学化学与分子工程学院,山东青岛266042;2.中国水产科学研究院黄海水产研究所;3.青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室)
中国是海藻化工生产第一大国,其产品产量占全球总产量的70%以上,其中褐藻胶是中国海藻加工行业的支柱产品,年产量为4万t左右,广泛应用于印染、食品、医药等诸多领域。褐藻胶生产需要消耗大量淡水,生产 1 t胶耗水量可达 800~1 000 m3[1]。由于大部分褐藻胶加工企业在中国北方,水资源短缺的问题不仅影响褐藻胶企业的正常生产,而且成为制约褐藻胶产业发展的瓶颈。
褐藻胶生产废水主要是废钙水,约占总废水量的60%以上,由于其含有钠盐和钙盐,导致其难以被回收利用[1-7]。目前,针对废钙水处理技术的研究主要分为两个方向:一是采用生化处理技术[8-9]使废水达标排放,但无法实现水资源的回用[2-3,5-7];二是采用膜处理技术[10-11],处理后的废水均可达到回用标准,但其运行成本过高,限制了其实际应用[1,4]。 笔者在前期工作中指出了制约废钙水回用的关键因素主要是盐度过高,并建立了电渗析处理工艺,然而在实际应用中仍面临操作较为繁琐、处理成本偏高的问题。因此,如何在尽可能低的成本条件下实现废钙水中钙离子的脱除,同时减少钠离子的引入,是解决问题的关键。
褐藻酸钠生产工艺较为简单,主要是通过加入Na2CO3消化使海藻原料中的褐藻酸钙转化为褐藻酸钠,通过净化得到褐藻酸钠胶液,再通过添加CaCl2完成钙化过程重新形成褐藻酸钙,再通过后续处理最终得到成品褐藻酸钠。在此过程中消化过程的Na2CO3用量无法减少,只有钙化步骤可以改变。CaCl2作为钙化剂在钙化过程中往往需要使用过量,其引入Cl-后必然导致盐度升高,只有通过电渗析或者反渗透的方法除去。因此想要减少离子的引入,必须将钙化剂替换[12-15]。
笔者探讨了CaCO3作为褐藻酸钠生产过程中钙化剂的可行性。CaCO3粉末可以均匀分布在褐藻酸钠溶液中,通过向溶液中通入足量的CO2,可使其中的不溶性 CaCO3转化为微溶的 Ca(HCO3)2,形成游离Ca2+与溶液中的褐藻酸钠反应形成褐藻酸钙。该方法有3个优点:1)在钙化过程中生成了HCO3-,使得钙化后游离的Ca2+可以通过添加Ca(OH)2的方式低成本地脱除,并且在除钙过程中减少了离子的引入,除钙后的废水可以作为回用水二次回用;2)脱钙过程中生成的CaCO3可以收集,作为钙化剂可以循环回用;3)反应过程中消耗的CO2可以采用天然气等产生的废气,具有一定的环保价值。
1 实验部分
1.1 材料和仪器
材料:褐藻酸钠,食品级,购于青岛明月集团。仪器:DDS-307A电导率仪;TD5A-WS离心机;KQ-600DE超声波清洗器;HJ-6多头磁力加热搅拌器。
1.2 实验方法
1.2.1 钙化工艺方案
1)氯化钙钙化(传统工艺):取质量分数为0.2%的褐藻胶溶液200 mL,在高速搅拌下缓慢加入不同量的质量分数为10%的CaCl2溶液,生成褐藻酸钙絮状沉淀。用孔径小于48μm的滤布过滤,絮状物加入50 mL质量分数为3%的盐酸溶液脱钙,重复脱钙3次。脱钙后的固体用离心机分离,用质量分数为70%的乙醇溶液清洗2次,分离得到固体,用NaOH中和至中性即得褐藻酸钠。用质量分数为95%的乙醇脱水1次,在80℃烘干后称其质量,样品编号保存。
2)碳酸钙钙化(新工艺):取质量分数为0.2%的褐藻胶溶液200 mL,在高速搅拌下缓慢加入定量的CaCO3粉末,使其分布均匀,向其中加入干冰,密封。待溶液开始凝固,向其中补充加入质量分数为10%的CaCl2溶液,生成褐藻酸钙絮状沉淀。后面的脱钙过程、中和过程、洗涤干燥过程与传统工艺相同,样品编号保存。
1.2.2 正交实验设计
通过单因素实验确定碳酸钙钙化工艺的主要影响因素有3个,即碳酸钙用量、干冰用量、氯化钙用量。采用正交实验对3种因素进行优化,获得优化条件,并进行实验验证。
1.2.3 钙化废水脱钙方案
确定最佳工艺条件后,收集废钙水进行脱钙净化。因为废水中可能含有 CaCl2、Ca(HCO3)2,所以先加入适量 Ca(OH)2除去 Ca(HCO3)2,观察电导率变化。再加入Na2CO3除去可能含有的CaCl2,至最终电导率达到最小值。此实验方案采用Ca(OH)2为脱钙剂,不仅避免引入其他离子,而且整个过程会产生白色CaCO3沉淀,可以回收利用。
2 结果与分析
2.1 氯化钙钙化工艺氯化钙添加量对产物得率及废水指标的影响
按照氯化钙钙化工艺,向褐藻胶液中添加不同量氯化钙溶液,考察氯化钙添加量对褐藻酸钠得率和废水指标的影响,结果见图1。由图1看出,加入不同量CaCl2溶液时均会产生絮状沉淀。当加入CaCl2溶液体积大于6.5 mL时,获得干基产物质量达到饱和。另外,随着CaCl2溶液加入量增大,废钙水余钙量和电导率也依次增加。综合考虑,加入6.5 mL CaCl2溶液效果较好,此时产物干基质量为0.331 g,废钙水电导率为6.28mS/cm、余钙质量浓度为849.7mg/L。
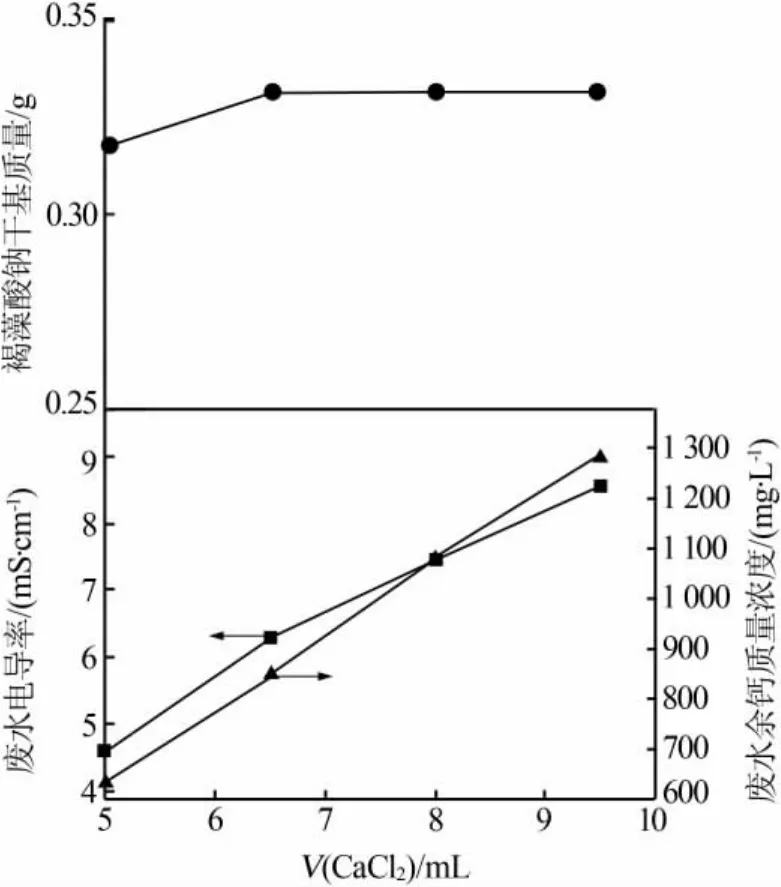
图1 氯化钙钙化工艺氯化钙添加量对褐藻酸钠得率及废水指标的影响
2.2 碳酸钙钙化工艺单因素实验分析
1)碳酸钙添加量对产物得率及废水指标的影响。设定干冰加入量为3g、CaCl2溶液用量为3mL,考察CaCO3粉末加入量对褐藻酸钠得率和废水指标的影响,结果见图2。从图2看出,随着碳酸钙加入量增加,生成的产物质量也相应增加。同时发现,随着CaCO3用量增多,废钙水电导率和余钙质量浓度也相应增加。综合考虑,选择碳酸钙加入量为0.60g,在此条件下所得产物干基质量为0.318 g,废钙水电导率为4.35mS/cm、余钙质量浓度为641.28 mg/L。
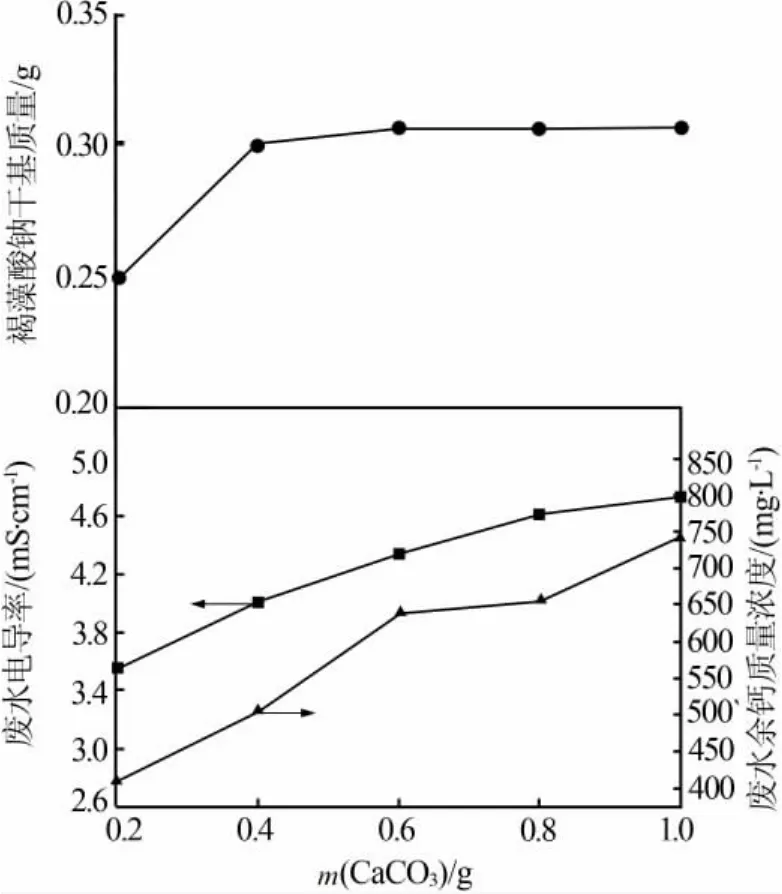
图 2 碳酸钙加入量对褐藻酸钠得率及废水指标的影响
2)干冰添加量对产物得率及废水指标的影响。确定CaCO3加入量为0.60 g、CaCl2溶液用量为3mL时,考察干冰加入量对褐藻酸钠得率和废水指标的影响,结果见图3。由图3看出,随着干冰加入量增多,所得产物质量依次增加并维持在0.300 g左右。同时,随着干冰用量增加,废钙水电导率和余钙质量浓度依次增加。综合考虑,选择干冰加入量为3g,在此条件下所得产物干基质量为0.311 g,废钙水电导率为4.27mS/cm、余钙质量浓度为620.5 mg/L。
3)氯化钙添加量对产物得率及废水指标的影响。设定CaCO3加入量为0.60 g、干冰加入量为3 g,考察CaCl2溶液加入量对褐藻酸钠得率和废水指标的影响,结果见图4。由图4看出,氯化钙溶液的加入对所得产物也有很大的影响,产物干基质量随着氯化钙溶液用量的增加而增加,并达到稳定值0.310 g左右;废钙水电导率和余钙质量浓度也随着氯化钙溶液加入量的增加而上升。综合考虑,选择氯化钙溶液添加量为2 mL,在此条件下产物干基质量为0.313 g,废钙水电导率为3.42 mS/cm、余钙质量浓度为400.80 mg/L。
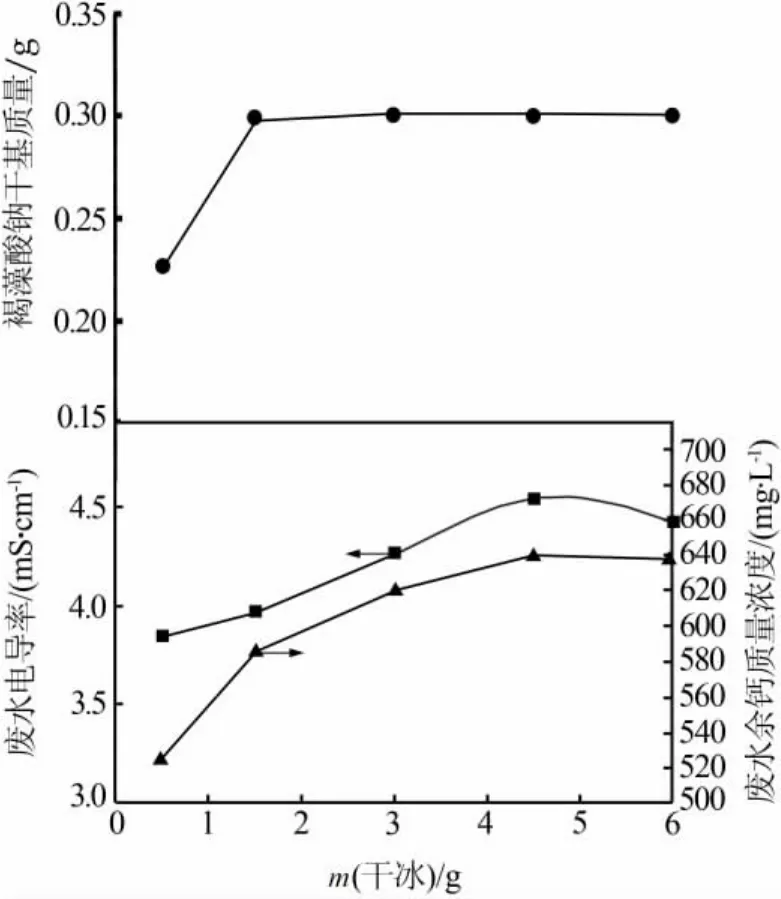
图3 干冰加入量对褐藻酸钠得率及废水指标的影响

图4 氯化钙加入量对褐藻酸钠得率及废水指标的影响
2.3 碳酸钙钙化工艺正交实验分析
以碳酸钙用量、干冰用量、氯化钙溶液用量3个因素为自变量,以生成产物干基质量为响应值,设计了三因素三水平正交实验。正交实验因素与水平见表1,实验方案及结果见表2。

表1 正交实验因素与水平

表2 正交实验方案及结果
由表2看出,5、7、9号实验效果比较好。5号实验干基质量为0.323 g,废钙水电导率为4.25 mS/cm、余钙质量浓度为620.5 mg/L。7号实验干基质量为0.311 g,废钙水电导率为4.05mS/cm、余钙质量浓度为520.5mg/L。9号实验干基质量为0.312g,废钙水电导率为3.23mS/cm、余钙质量浓度为345.7mg/L。以产物得率最高的5号实验与氯化钙钙化工艺相比,产物干基质量基本一致,但废水电导率低32.3%、余钙质量浓度低27.0%。
2.4 钙化废水脱钙分析
取氯化钙钙化工艺2号实验废水进行脱钙实验。实验中只使用Na2CO3脱钙,发现加入10 mL质量分数为5%的Na2CO3溶液时,废钙水电导率降低到5.96 mS/cm、钙离子质量浓度为104.208 mg/L。
取碳酸钙钙化工艺5号实验废水进行脱钙实验。实验发现,当加入5 mL质量分数为2%的Ca(OH)2溶液后,废钙水电导率降到 3.75 mS/cm,再加入2 mL质量分数为5%的Na2CO3溶液后,废钙水电导率降到3.13 mS/cm,并达到稳定值,此时测得钙离子质量浓度为40.02 mg/L。与氯化钙钙化工艺处理之后的废钙水相比,碳酸钙钙化工艺处理之后的废钙水中钙离子质量浓度降低了61.6%,与处理之前的废钙水相比钙离子质量浓度降低了93.55%。所以,采用碳酸钙钙化工艺,不仅可以大大降低废水中钙离子浓度,而且生成的CaCO3还可以回收利用。
3 结论
采用单因素实验和正交实验对CaCO3作为褐藻酸钠生产过程钙化剂的工艺参数进行了优化,找出最佳工艺参数。与氯化钙钙化工艺相比,碳酸钙钙化工艺无论在产物产量上还是在废钙水电导率和余钙量上都占有优势,同时后续废钙水处理后可收集CaCO3回收利用。实验中用到的干冰可采用天然气等产生的废气作为来源,价格低廉且绿色环保。在后续废钙水脱钙处理方面,以添加Ca(OH)2的方式低成本脱除,不仅可以保证无杂离子引入,而且在脱钙过程中生成的CaCO3可以循环利用,实现高效经济、绿色环保的价值理念。
