精氨酸—还原糖体系中1,2-二羰基化合物的形成和抑制研究
2018-12-12卢永翎肖留榜夏秋琴吕丽爽
卢永翎 肖留榜 夏秋琴 吕丽爽
LU Yong-ling XIAO Liu-bang XIA Qiu-qin LU Li-shuang
(南京师范大学金陵女子学院,江苏 南京 210097)
(Ginling College, Nanjing Normal University, Nanjing, Jiangsu 210097, China)
1,2-二羰基化合物,如丙酮醛(methylglyoxal,MGO)和乙二醛(glyoxal,GO),是糖基化反应过程中非酶褐变和蛋白质交联产生的活性中间产物。MGO和GO是食品加热(如蒸煮、油炸和焙烤等)和贮藏过程中形成的产物,MGO和GO不仅是颜色和芳香物质的重要前体物质,而且还会导致蛋白结构改变从而令食品营养品质的下降。研究表明,1,2-二羰基化合物可促使蛋白质发生交联反应,破坏蛋白质的结构和功能,抑制绒毛、腺体及上皮细胞中的蛋白质、DNA和RNA的合成,还可以引发人的糖尿病、阿茨海默症等症状[1-4],因此,已经成为当前食品安全研究的热点[5-7]。由此,寻求抑制1,2-二羰基化合物、控制蛋白糖基化反应成为亟需解决的问题。
国内外已有相关文献,如章宇[8]87-112在研究食品中丙烯酰胺的形成过程时,运用天冬酰胺—葡萄糖模型来模拟食品中丙烯酰胺的形成过程,为模拟食品加工条件提供了参考依据;Sara等[9]研究甘氨酸—葡萄糖模型在pH 6.8的条件下产生中间产物MGO、1-deoxy-2,3-hexodiulose和3-deoxy-2-hexosulose以及有机酸形成的动力学路径;Paul等[10]在pH 7.4、37 ℃的生理条件下研究胍基与活性羰基化合物MGO、GO和3-DG反应的动力学及其机制;付全意[11]通过阿伦尼乌斯方程研究Lys-葡萄糖模拟体系中羧甲基赖氨酸的形成动力学,并计算了该动力学下的各种参数和反应活化能。这些反应动力学的研究报道均为研究精氨酸(Arg)—葡萄糖模型产生MGO和GO的动力学提供了理论依据。
目前尚未有文献报道在高温条件下Arg-葡萄糖体系中MGO、GO产生及消除的变化过程,因此本研究将模拟食品高温加工条件,建立Arg-还原糖模型,通过对比还原糖种类、温度、时间、pH和抑制剂染料木黄酮等因素对体系中MGO和GO产生量的影响,确定主要影响因素;进而在不同的反应温度条件下添加染料木黄酮考察MGO和GO形成的动力学规律,探讨其对该体系中MGO和GO的抑制过程;计算相应动力学参数,分析在染料木黄酮介入前后的变化及其消除1,2-二羰基化合物的机制。本研究旨在为研究食品高温加工过程中发生的美拉德反应、体系中MGO和GO的形成过程,以及天然黄酮抑制MGO和GO的机制提供理论基础。
1 材料与方法
1.1 材料与试剂
精氨酸:分析纯,上海生物生工有限公司;
染料木黄酮:98%、HPLC级,南京广润生物试剂有限公司;
丙酮醛(40%水溶液)、乙二醛(40%水溶液)、邻苯二胺(DB):分析纯,美国Sigma-Aldrich公司;
磷酸二氢钠、磷酸氢二钠、2,3-丁二酮、葡萄糖:分析纯,上海国药化学试剂有限公司;
甲醇:色谱纯,上海国药集团化学试剂有限公司;
吡啶(99.5%)、六甲基硅烷(98%)、三甲基氯硅烷(99%):分析纯,成都市科龙化工试剂厂;
乙酸乙酯:分析纯,南京化学试剂有限公司;
纯净水:杭州娃哈哈集团有限公司。
1.2 仪器与设备
液相色谱—质谱联用仪:Agilent Technologies 1290/6460 Triple Quad LC/MS、DAD G4212A型,美国安捷伦公司;
气相色谱系统:7820型,美国安捷伦公司;
高效液相色谱系统:20 AT型,美国安捷伦公司;
数显恒温水浴锅:HH-6型,金坛市富华仪器有限公司;
数显恒温油浴锅:HH-S型,金坛市富华仪器有限公司;
电子分析天平:FA2104N型,上海精密科学仪器有限公司;
数字式pH计:PHS-3C型,上海三信仪表厂;
超声波清洗器:KQ-300B型,昆山市超声仪器有限公司;
氮气吹干仪:HGC-12A型,上海乔跃电子科技有限公司。
1.3 方法
1.3.1 MGO和GO含量分析 采用气相色谱法[12],以DB为衍生化试剂,程序升温条件:初始柱温40 ℃ 保持1 min,升温第一阶段4 ℃/min升至140 ℃保持1 min,第二阶段50 ℃/min 升至250 ℃保持1 min;载气流量:H2流量30 mL/min,空气流量300 mL/min,N2流量25 mL/min。
1.3.2 MGO和GO形成的单因素设计 MGO和GO的制备参考文献[13],其中还原糖及精氨酸的终浓度均为60 mmol/L。
(1) 还原糖种类:在pH 7.4,反应温度121 ℃,未添加抑制剂的条件下,分别在0,5,15,30,60 min考察不同种类还原糖(葡萄糖、果糖、核糖、半乳糖)对MGO和GO形成的影响。
(2) pH:在还原糖为葡萄糖,反应温度121 ℃,未添加抑制剂的条件下,分别在0,5,15,30,60 min考察不同pH(6.5,7.4,9.2)对MGO和GO形成的影响。
(3) 温度:在还原糖为葡萄糖,pH 7.4,未添加抑制剂的条件下,分别在0,5,15,30,60 min考察不同温度(100,121,135,150,180 ℃)对MGO和GO形成的影响。
(4) 抑制剂染料木黄酮:在还原糖为葡萄糖,pH 7.4,反应温度121 ℃的条件下,分别在0,5,15,30,60 min考察抑制剂染料木黄酮(60 mmol/L)对MGO和GO形成的影响。
抑制率按式(1)计算:
(1)
式中:
C——抑制率,%;
W1——对照组GO/MGO含量,mmol/L;
W2——试验组GO/MGO含量,mmol/L。
1.3.3 Arg-葡萄糖模拟体系中MGO和GO形成的动力学模型研究
(1) 样品制备:在pH 7.4条件下,将终浓度均为60 mmol/L 精氨酸和葡萄糖混合液于100,121,135,150,180 ℃油浴中加热0,5,10,15,20,30,40,60 min后分别取样于样品管中,于-20 ℃保存[8]115-118[14]。
(2) 体系中反应物葡萄糖含量测定:采用三甲基氯硅烷衍生化,气相色谱方法[15]测定葡萄糖含量。色谱柱HP-5(30 m ×0.32 mm id,0.25 μm);进样温度250 ℃,压力68 947.57 Pa,不分流;初始柱温100 ℃保持5 min,程序升温第一阶段5 ℃ /min升至150 ℃保持5 min,第二阶段5 ℃/min 升至240 ℃保持2 min;FID检测器温度280 ℃。载气流量:H2流量30 mL/min,空气流量300 mL/min,N2流量25 mL/min。
(3) 体系中反应物Arg含量测定:使用1-氯-2,4-二硝基苯(CDNB)液相色谱方法[16]测定Arg含量,流动相:醋酸钠缓冲溶液-乙腈(75∶15)。
(4) 体系中中间产物MGO和GO含量测定:同1.3.1。
(5) MGO/GO形成的动力学模型参数计算:阿伦尼乌斯速率常数公式(arrhenius equation for the rate constant)是用来表征温度对反应速率常数影响的关系式,能反映反应速率对温度的依赖关系。从平衡常数与温度的关系以及平衡常数与反应速率常数的关系,推断反应速率常数k与温度T的关系的指数形式为:
(2)
式中:
k——反应速率常数;
A——指数前因子或频率因子;
Ea——活化能,kJ/mol;
R——摩尔气体常数,8.314/(mol·K);
T——开尔文温度,K。
将式(2)积分可得:
(3)

(4)
(5)
式中:
t——反应时间,s;
c(Arg)——Arg的浓度,mmol/L;
c(Glu)——葡萄糖的浓度,mmol/L;
c(MGO)——MGO的浓度,mmol/L;
c(GO)——GO的浓度,mmol/L;
k1——葡萄糖在Arg作用下生成MGO的反应速率常数;
k2——葡萄糖在Arg作用下生成GO的反应速率常数。
当t=0时,Arg和葡萄糖的浓度为60 mmol/L;c(MGO) 和c(GO)为0 mmol/L。
1.3.4 染料木黄酮抑制Arg-葡萄糖模拟体系MGO和GO形成的动力学研究
(1) 染料木黄酮抑制MGO和GO的量效关系:在pH 7.4,终浓度均为60 mmol/L精氨酸和葡萄糖混合液中,添加不同浓度染料木黄酮(0.005,0.050,0.500,5.000,50.000 mmol/L),180 ℃反应20 min,根据1.3.1检测样品中的MGO、GO含量,计算抑制率[8]115-116。
(2) 染料木黄酮抑制MGO和GO的动力学研究:在pH 7.4,终浓度均为60 mmol/L精氨酸和葡萄糖混合液中,添加50 mmol/L染料木黄酮,分别反应0,5,10,15,20,30,40,60 min,根据1.3.1检测样品中的MGO、GO含量,计算抑制率[8]117-118。
(3) 染料木黄酮抑制MGO/GO形成动力学模型的构建:同1.3.3(5)。
1.3.5 染料木黄酮消除Arg-葡萄糖模拟体系中1,2-二羰基化合物形成的机制研究
(1) 样品的制备:将1.3.4(2)项下反应5 min的样品取出后解冻,取1 mL于10 mL离心管中,加入2 mL乙酸乙酯涡旋10 min,4 086×g离心10 min取出上清液,萃取2次。浓缩至干,用70%的甲醇复溶,备用。
(2) 液相色谱条件:色谱柱kromasil 100-5 C18(250 mm×4.6 mm,5 μm),检测波长260 nm,流动相甲醇-水(60∶40),流速0.6 mL/min,进样量10 μL,柱温30 ℃。
(3) 质谱条件:电喷雾负离子化(ESI-)检测,扫描范围为m/z100~1 000;喷雾电压 4 000 V,雾化压力310 264.07 Pa,辅助气压 34 473.79 Pa,毛细管温度280 ℃,裂解电压135 V。
1.3.6 统计分析方法 采用Excel 2013软件和Minitab 16软件统计分析数据。所有试验重复3次。
2 结果与分析
2.1 Arg-还原糖模拟体系生成MGO和GO的影响因素分析
运用气相色谱法同时测定Arg-还原糖体系中产生的中间产物MGO和GO的量,通过色谱峰分别计算MGO、GO和丁二酮(内标)的峰面积之比,代入标准曲线(MGO:y=1.454 5x+0.13 11,R2=0.996 1;GO:y=1.187 7x+0.157 1,R2=0.997 1)计算MGO和GO的含量。
2.1.1 糖种类对Arg-还原糖体系MGO和GO生成的影响
由图1可知,在Arg-还原糖模拟体系中,除核糖和半乳糖体系外,均在反应60 min时MGO和GO浓度达到最高值,且不同还原糖体系中GO的含量随着时间的延长而不断增加。而在核糖和半乳糖体系中MGO含量在反应 30 min 时达到最高值,后有小幅度下降;而其他还原糖MGO产生量随着时间的延长持续增高。对比MGO和GO产生量可知,MGO的量高于GO的,且约为GO量的3倍。
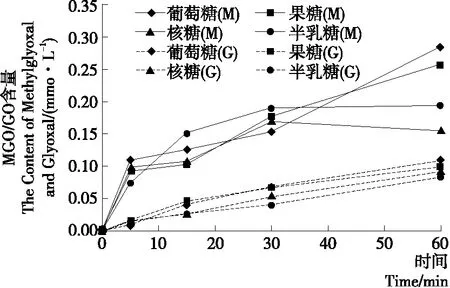
图1 Arg-还原糖模型中还原糖对体系MGO和GO生成的影响
Figure 1 Effect of reducing sugar on the formation of MGO and GO content in Arg-reducing sugar models
2.1.2 pH值对Arg-葡萄糖体系MGO和GO生成的影响
由图2可知,首先,MGO和GO的生成量均在pH为9.2 最高,其次为pH 7.4,而pH 6.5时MGO和GO的量很少。由此可以看出MGO和GO更容易在碱性条件下产生。此外,Weenen等[17]研究也表明MGO是由脱氧葡糖醛酮通过逆醇醛缩合作用裂解产生,而在pH>7时逆醇醛缩合和裂解作用加强[18],有利于形成MGO,因此在碱性条件下含量增加明显。

图2 pH对Arg-葡萄糖模型体系MGO和GO生成的影响
Figure 2 Effect of pH on the formation of MGO and GO concentrations in Arg-glucose model
2.1.3 染料木黄酮抑制Arg-葡萄糖体系MGO和GO生成的能力 由图3可知,染料木黄酮在180 ℃时可以有效地抑制Arg和葡萄糖反应生成MGO和GO。当反应达到60 min时,染料木黄酮对MGO和GO的抑制率均达到最高,分别为47.5%和56.8%。
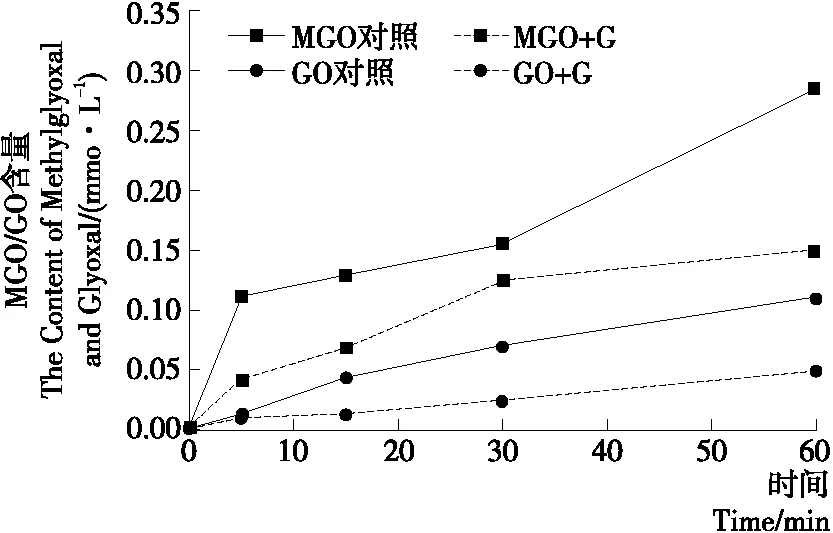
图3 染料木黄酮抑制Arg-葡萄糖体系生成的MGO和GO
2.1.4 影响MGO和GO形成因素及其交互作用分析 由表1可知,体系中影响MGO和GO形成的最重要因素是时间,影响MGO形成的第二大因素是pH,其次为温度;而影响GO的第二大因素是温度,随之是pH。
反应时间是影响MGO和GO形成的最主要因素,在反应早期阶段,MGO和GO均会随着反应时间的延长快速增长;pH对MGO的影响较为显著,位列第二,因为,在碱性条件下MGO的形成大幅增加,远远高于GO的增加量,故pH对GO形成的影响位列第三;温度对GO和MGO的形成作用均较为显著,随着反应温度的升高而使生成量增加。由此,进一步探讨MGO/GO产生的动力学过程。
表1影响Arg-还原糖体系MGO/GO形成的因素及交互作用
Table 1 Contribution of factors and interactions on the production of MGO & GO
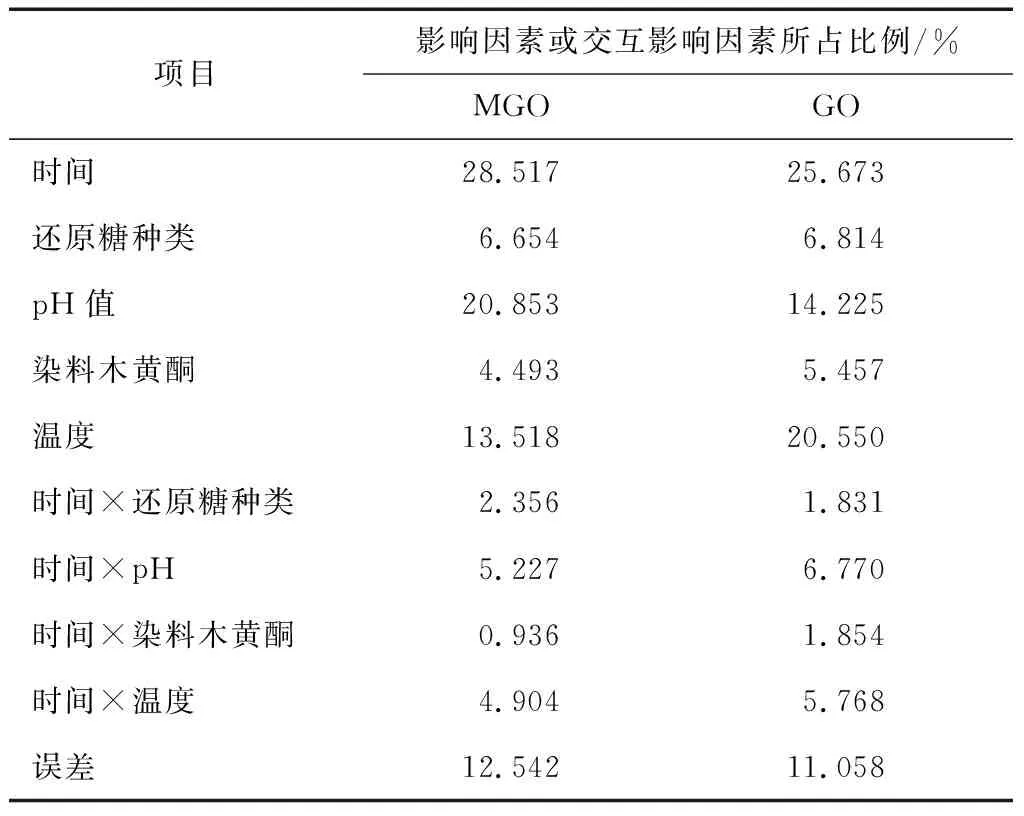
项目影响因素或交互影响因素所占比例/%MGOGO时间28.51725.673还原糖种类6.6546.814pH值20.85314.225染料木黄酮4.4935.457温度13.51820.550时间×还原糖种类2.3561.831时间×pH5.2276.770时间×染料木黄酮0.9361.854时间×温度4.9045.768误差12.54211.058
2.2 Arg-葡萄糖模型中MGO和GO形成的动力学研究
2.2.1 Arg浓度变化的动力学曲线 从图4中可以看出,Arg浓度随着反应时间的延长而迅速降低;且温度越高,Arg浓度衰减越快,特别是在反应180 ℃时。在高温加热10 min之内,Arg浓度下降到最低点。Arg浓度的降低主要来自两个方面:① Arg与葡萄糖反应生成Schiff base等产物[19];② Arg参与交联反应,与自身交联或是与中间产物MGO、GO交联形成新化合物[20-24]。

图4 Arg-葡萄糖模拟体系中Arg的动力学变化曲线
2.2.2 葡萄糖浓度变化的动力学曲线 由图5可知,葡萄糖浓度随着反应时间的延长而降低,30 min后逐渐趋于平缓。而在同一时间点,温度越高葡萄糖浓度越低;反应物葡萄糖的变化趋势与Arg的变化趋势基本一致。葡萄糖浓度的降低也是源于两个原因:① 葡萄糖自身受热氧化降解形成糖基化中间产物MGO或GO[25];② 葡萄糖与Arg生成Schiff base等产物。

图5 Arg-葡萄糖模拟体系中葡萄糖的动力学变化曲线
2.2.3 MGO/GO生成量的动力学曲线 由图6可知,在Arg-葡萄糖高温加热的体系中,MGO的浓度随着反应时间的延长而不断增加;且反应温度越高,MGO的生成量越多。GO的浓度随着反应时间的延长呈现递增的趋势,且随着温度的升高,GO生成量增加。其中与MGO生成量不同的是,在反应温度为100 ℃时,GO的生成量极少。
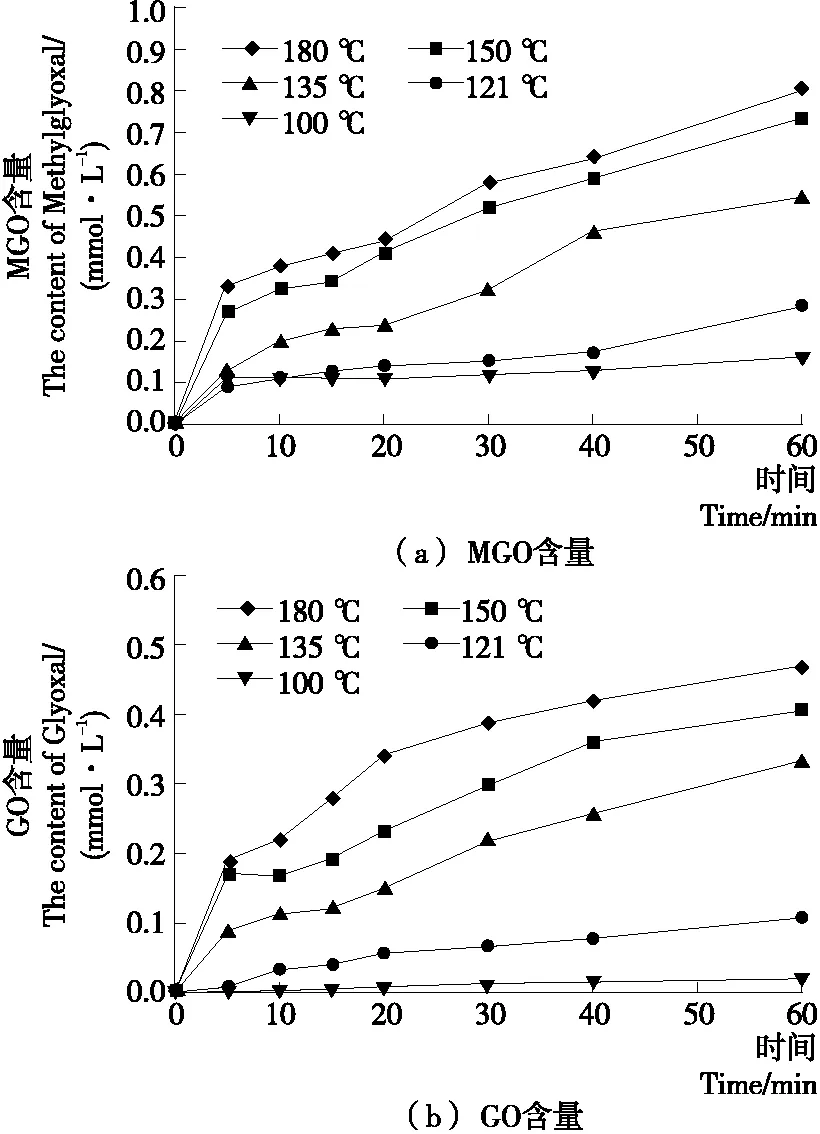
图6 Arg-葡萄糖模拟体系中MGO/GO的动力学变化曲线
Figure 6 The kinetics curve of MGO/GO in Arg-glucose model system in Arg-glucose model
2.3 染料木黄酮抑制Arg-葡萄糖模型体系中MGO/GO的动力学研究
2.3.1 染料木黄酮抑制MGO/GO的量效关系 根据温度、时间和抑制剂对Arg-葡萄糖模型体系中MGO和GO的形成量影响结果,选取在180 ℃,反应20 min条件下,考察染料木黄酮对Arg-葡萄糖模型体系中MGO和GO的抑制作用的量效关系,染料木黄酮的添加量设定为0.005,0.050,0.500,5.000,50.000 mmol/L。由图7可知,在上述添加量,染料木黄酮对Arg-葡萄糖中MGO的抑制率依次为21.1%,29.7%,37.1%,44.7%,50.4%,同时对GO的抑制率依次为37.7%,43.2%,50.0%,58.0%,65.0%。表明随着抑制剂添加量的增加,抑制率增大,且各试验组存在显著性差异(P<0.05)。由此推测:染料木黄酮可能在源头抑制MGO/GO生成;抑或同等程度捕获MGO/GO,从而呈现抑制率随着浓度增加而增长的良好相关性。另外,在180 ℃反应20 min时,发现Arg-葡萄糖模型中对MGO和GO的抑制率均在添加量水平为50 mmol/L 时达到最大,因此,选用50 mmol/L为染料木黄酮的添加量。

图7 Arg-葡萄糖模型中MGO/GO生成量与染料木黄酮添加量的关系
Figure 7 Relationship between MGO/GO contents and addition levels of genistein in Arg-glucose model
2.3.2 染料木黄酮抑制MGO/GO的动力学研究 图8为对照组(对照)和抑制组(+G)中MGO和GO含量随着时间变化的曲线。结果表明,在Arg-葡萄糖模型体系中,反应5 min,染料木黄酮即抑制MGO和GO生成,且随着反应时间的延长,抑制效果呈现增强趋势。在反应达到60 min 时,对Arg-葡萄糖模型中MGO和GO的抑制率分别为45.0%和51.1%。
2.3.3 染料木黄酮抑制MGO/GO的动力学参数对反应过程的影响 为了进一步研究Arg-葡萄糖模拟体系中MGO和GO形成的动力学机制,根据上述动力学曲线图(图4~6),计算不同温度(100,121,135,150,180 ℃)下,反应速率常数k以及表观活化能Ea。从表2可以看出,在Arg-葡萄糖模型中,随着温度的升高,反应速率常数逐渐提高,表明该反应为吸热反应。在Arg-葡萄糖模型中MGO的表观活化能显著低于GO,因此MGO的反应速率比GO高。表明体系中产生MGO反应更易于发生。同时, MGO的反应速率常数均比GO的反应速率常数高,也可以得出该结论。

图8 染料木黄酮抑制Arg-葡萄糖模型体系中MGO/GO的形成动力学曲线
Figure 8 Inhibitory effect of genistein on the kinetic profiles of MGO/GO formation in Arg-glucose model
另外,对比对照组和抑制组发现,抑制组的反应速率常数均低于对照组,说明染料木黄酮可以抑制Arg-葡萄糖模型中MGO和GO的形成。
表2染料木黄酮介入前后,MGO和GO形成的动力学模型参数
Table2 Parameter of kinetics models for the formation of MGO/GO before/after genistein involved in (n=3)

组别温度/℃反应速度常数/(×10-3 min-1)MGOGO抑制组对照组活化能1800.767 2±0.0120.401 6±0.0111000.010 0±0.0050.001 0±0.0131210.024 3±0.0020.008 7±0.0331350.138 3±0.0530.084 1±0.0211500.457 9±0.0780.262 7±0.0401801.466 1±0.0450.931 8±0.041kJ/mol10.732 014.281 9
2.4 染料木黄酮消除Arg-葡萄糖体系中1,2-二羰基化合物的机制研究
由上述结果可知染料木黄酮的介入能显著降低Arg-葡萄糖体系中MGO的形成,鉴于本实验室前期研究结果,在模拟生理条件下(37 ℃,pH 7.4),染料木素与MGO易于形成加合产物[26]。为验证在Arg-葡萄糖体系中染料木素是否具有同样的效能,本试验选取添加染料木黄酮于Arg-葡萄糖体系中,180 ℃反应5 min,采用LC-MS分析反应混合物中染料木黄酮的变化。如图9所示,除了染料木素色谱峰(12.16 min)外,出现新的色谱峰(6.43,7.08 min)。如图10所示,ESI-MS(m/z)准分子峰341[M—H]-,分子量比染料木黄酮多了72(MGO),推测为染料木素-MGO的加合产物。由此可知染料木黄酮消除Arg-还原糖体系中1,2-二羰基化合物的机制是通过捕获Arg-葡萄糖体系中生成的MGO形成加合产物,从而降低了体系中MGO。
3 结论
本试验通过气相色谱法检测Arg-还原糖模型体系产生的中间产物MGO和GO,考察还原糖的种类、时间、pH、温度和抑制剂染料木黄酮等对模拟体系生成MGO和GO的影响;采用动力学模型研究高温加热条件下的Arg-葡萄糖模拟体系中MGO和GO形成以及染料木素抑制的动力学过程。综合分析各影响因素试验结果表明,时间是影响Arg-还原糖模型体系产生MGO和GO的最主要因素。在Arg-葡萄糖模型中MGO的反应速率常数均大于GO的,生成MGO的表观活化能均低于生成GO的活化能,说明在此反应过程中更容易生成MGO。染料木黄酮介入之后,1,2-二羰基化合物产生的化学反应速率比介入之前明显降低,说明染料木黄酮可以有效抑制Arg-葡萄糖体系产生的1,2-二羰基化合物。当染料木黄酮的添加量为50 mmol/L时抑制效果最佳。LC-MS结果表明染料木黄酮消除Arg-葡萄糖体系中的1,2-二羰基化合物的机制是染料木黄酮通过捕获该体系中MGO形成加合产物而达到清除的效果。由于试验时间的限制,本试验研究了Arg-葡萄糖体系中糖基化中间产物MGO与GO的形成及抑制,今后还将进一步研究该体系中糖基化终末产物AGEs的形成及抑制的相关机制。

图9 染料木黄酮消除Arg-葡萄糖体系中1,2-二羰基化合物的机制液相图
Figure 9 The liquid chromatogram of genistein on elimination of 1,2-dicarbonyl compounds in Arg-glucose model

图10 染料木黄酮消除Arg-还原糖体系中1,2-二羰基化合物的机制质谱图
Figure 10 The mass spectrum of genistein on elimination of 1,2-dicarbonyl compounds in Arg-glucose model
