黄秋葵花、果、茎叶中有效成分提取和测定
2018-12-11吴比孙源魏亮冯冰玉姜守刚
吴比,孙源,魏亮,冯冰玉,姜守刚※
(东北林业大学,a.森林植物生态学教育部重点实验室;b.生物资源生态利用国家地方联合工程实验室,哈尔滨 150040)
黄秋葵(Hibiscus esculentus L.)别名秋葵、羊角豆,为锦葵科秋葵属1年生草本植物[1]。自20世纪90年代初引入我国,现国内各地均有栽培。黄秋葵果实具有较高营养价值和保健功能,其茎、叶、花、种子也具有一定的开发利用价值,也可以作为园林绿化观赏植物。
黄秋葵果味甘滑,有健脾益胃、润燥利肠之功效,可治脾虚乏力、肠燥便秘等症,经常食用黄秋葵能帮助消化、健胃、整肠,对胃炎、胃溃疡、肝脏等疾病均有疗效[2]。此外,黄秋葵还具有增强免疫力、保肝、治疗烧伤和烫伤等其他作用[3~6]。黄秋葵嫩荚、花中均富含植物黄酮(黄秋葵花中黄酮含量是大豆叶子的300倍左右)。黄秋葵果实富含蛋白质、脂肪、碳水化合物、维生素、矿物质和膳食纤维,同时还富含黄酮、多糖等有效成分。黄阿根等[7~10]报道,烘干后的黄秋葵嫩果中含蛋白质22.98%、总糖19.92%(其中多糖占总糖的2.00%)、脂肪9.40%、黄酮2.56%。WoolfeJA等[11]通过测定黄酮浸提液的吸光度,确定最佳提取时间为25min。
1 试验材料
1.1 仪器与试剂
722s型可见光分光光度计(上海精密科学仪器有限公司);ALC-1104型分析天平(北京赛利多斯仪器系统有限公司);B-220型水浴锅、RE52CS型旋转蒸发仪(上海亚莱生化仪器厂);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工有限公司);FDU-1200型冷冻干燥箱(上海爱郎仪器有限公司);LG10-2.4A型离心机(北京京立离心机有限公司)。
浓硫酸、过氧化氢、硝酸铝、95%乙醇、亚硝酸钠、苯酚、浓盐酸、葡萄糖标准品等均为分析纯;实验用水均为自制超纯水。
1.2 材料与试剂
试验所用的黄秋葵样品购自中国湖南省岳阳县步仙乡广福村,经东北林业大学森林植物生态学教育部重点实验室姜守刚副教授鉴定为野生黄秋葵。试验前对所采购的黄秋葵干燥样品粉碎后(过60目筛)置于玻璃样品瓶中作为供试样品备用。
2 试验方法
2.1 黄秋葵有效成分的提取方法
2.1.1 多糖的提取方法 分别精确称取黄秋葵花、果、茎叶供试样品 20g,用超纯水浸泡(料液比为1∶10)12h后,在100℃煎煮3h,趁热过滤,保留滤液。滤渣再次煎煮3h,合并2次滤液,加热浓缩至100mL。浓缩液冷却后置于玻璃容器中,加入95%乙醇,使其醇沉浓度为85%时止,用封口膜封好,静置48h。吸出上清液,5 000r/min离心10min,并回收乙醇。将沉淀物置于室温下晾干48h,所得物为粗多糖样品。
2.1.2 黄酮的提取方法 分别精确称取黄秋葵花、果、茎叶供试样品 20g,加入60%乙醇(料液比为1∶25)进行超声波辅助浸提(65℃,250W,25min,)。提取液过滤后再5 000r/min离心10min,取上清液,蒸发浓缩成浸膏状,将乙醇浸膏冷冻干燥后得到提取物为黄酮样品。
2.2 多糖含量测定
2.2.1 葡萄糖回归曲线绘制及回归方程的建立 准确称取干燥恒重的葡萄糖标准品10mg,用双蒸水将其定容至100mL,得0.1mg/mL的葡萄糖标准品溶液。分别吸取 0.0mL(空白对照)、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL葡萄糖标准品溶液于25mL比色管中,用双蒸水补足至2.0mL,分别加入5%的苯酚1.0mL、浓硫酸5.0mL,摇匀、静置、冷却至室温。490nm条件下测定待测样品吸光度。以葡萄糖含量(Yp)为横坐标、吸光度值(Xp)为纵坐标绘制葡萄糖标准曲线(图1)。
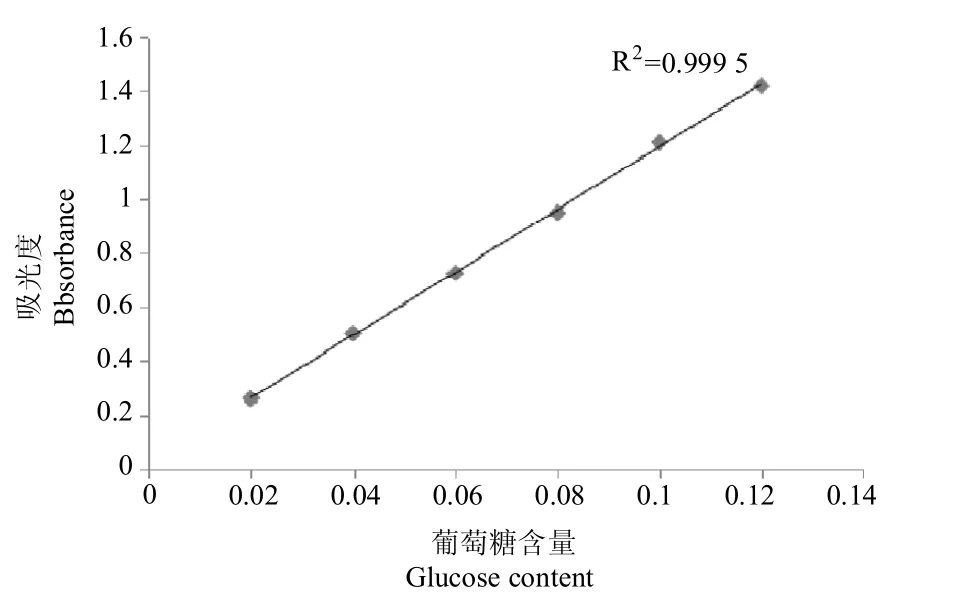
图1 葡萄糖标准曲线Figure 1 Standard curve of Glucose
根据葡萄糖标准回归曲线得出了多糖回归方程为 Yp=11.659xp+0.028 1,R2=0.999 5。
2.2.2 多糖含量测定方法 精密称取提取的黄秋葵花、果、茎叶干燥多糖各0.01g,分别用双蒸水溶解后,定容于10mL的容量瓶,分别取定容后的多糖溶液0.3mL于3支试管中,分别加入双蒸水1.7mL、5%苯酚溶液1.0mL、浓硫酸5.0mL,沸水中煮15min后冷却至室温,在490nm条件下测定吸光度。
2.3 黄酮含量测定
2.3.1 芦丁回归曲线绘制及回归方程的建立 准确称取芦丁标准品1g,用30%乙醇定容至100mL;再取芦丁标准品乙醇溶液5mL,用双蒸水定容至100mL,配制出0.5mg/mL的芦丁标准溶液。分别精确量取0mL(空白对照)、1mL、2mL、3mL、4mL、5mL、6mL芦丁标准溶液于25mL的比色管中,然后分别用30%乙醇溶液稀释到10mL,加入5%NaNO2 0.7mL,混匀后静置6min,再加入10%的Al(NO3)30.7mL,混匀后静置6min,加入4%NaOH 5.0mL,再用30%乙醇定容至25mL,混匀后静置15min。510nm条件下测定待测样品吸光度。以芦丁质量浓度(Yf)为横坐标、吸光度值(Xf)为纵坐标绘制芦丁标准曲线(图2)。
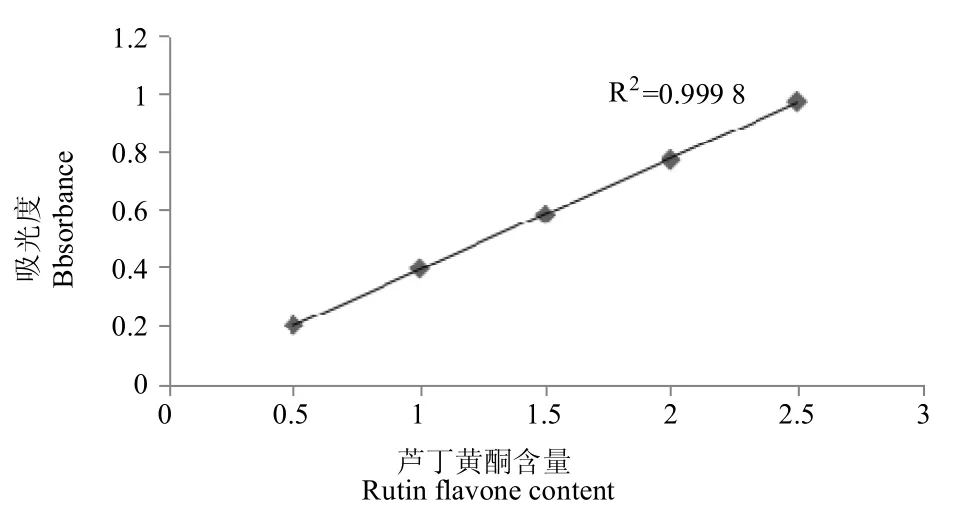
图2 芦丁标准曲线Figure 2 Rutin standard curve
根据芦丁的标准曲线得出黄酮的回归方程为Yf=0.384 6Xf+0.006 3,R2=0.999 8。
2.3.2 黄酮含量的测定方法 准确称取已提取的黄秋葵花、果、茎叶干燥黄酮各1g,用30%乙醇定容至100mL。取乙醇黄酮溶液5mL定容至100mL,分别配制出0.5mg/mL的黄秋葵花、果、茎叶黄酮溶液。取0.5mg/mL的花、果、茎叶黄酮溶液各1mL于试管中,分别用 30%乙醇稀释至 10mL,加入 5%NaNO2 0.7mL,混匀后静置 6min,加 10%Al(NO3)30.7mL,混匀后静置6min,加4%NaOH 5mL,再用30%乙醇定容至25mL,混匀、静置15min,510nm条件下测吸光度。
3 结果
3.1 多糖
3.1.1 多糖的提取 采用“2.1.1”项下方法,从黄秋葵花、果、茎叶各20g样品中分别提取了3.32g、1.16g、1.23g粗多糖。
3.1.2 多糖含量的测定 的黄秋葵粗多糖经“2.2.2”项下方法测定结果,根据多糖回归方程计算得出多糖含量,黄秋葵花、果、茎叶多糖吸光度和多糖含量结果见表1。
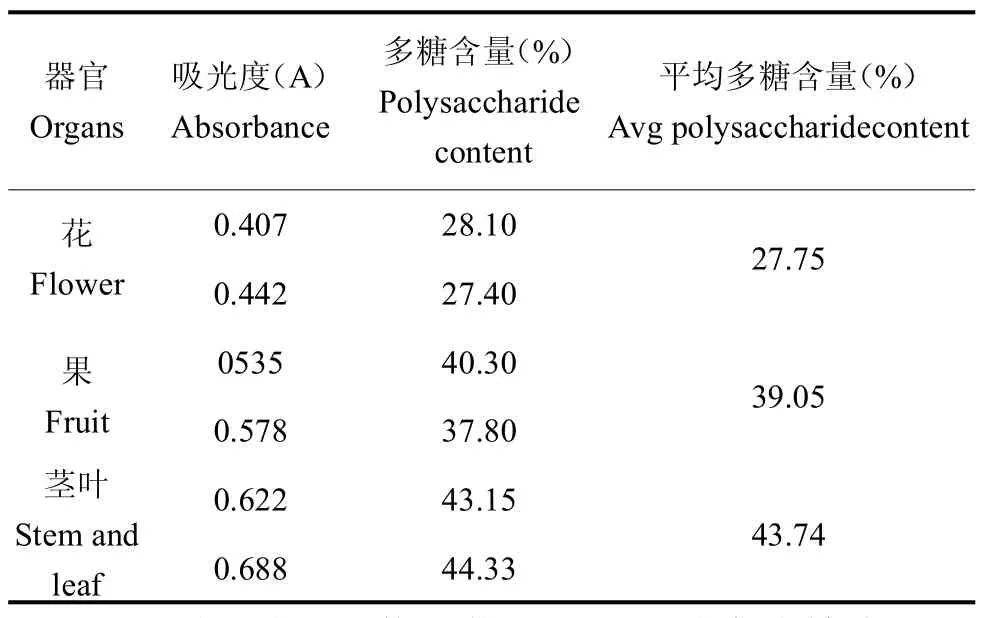
表1 多糖含量测定结果Table 1 Determination of polysaccharide content
根据表1得知,黄秋葵花、果、茎叶中多糖含量分别为27.75%、39.05%、43.74%;黄秋葵各器官中多糖含量依次为茎叶>果>花,茎叶中多糖含量最高。
3.2 黄酮
3.2.1 黄酮的提取 采用“2.1.2”方法,从黄秋葵花、果、茎叶20g样品中分别提取出了0.86g、2.66g、0.95g粗黄酮。
3.2.2 黄酮含量测定 提取的黄秋葵粗多糖经“2.3.2”项下方法测定结果,根据黄酮回归方程,计算得出黄酮含量,黄秋葵花、果、茎叶多糖吸光度和黄酮含量结果见表2。
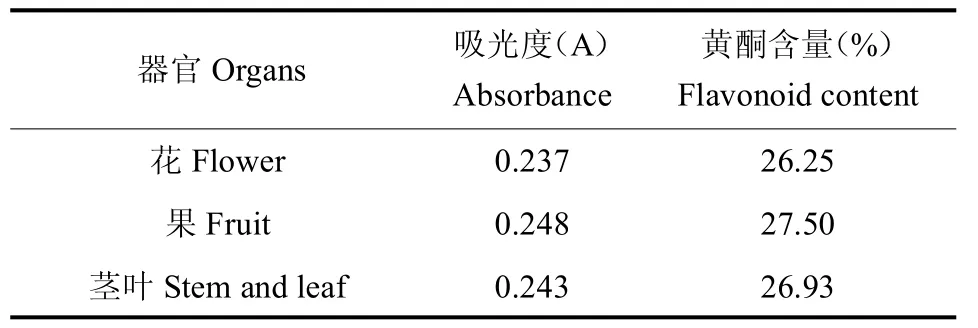
表2 黄酮含量测定结果Table 2 Results of flavonoid determination
根据上表可以得出,黄秋葵花、果、茎叶中黄酮的含量分别为26.25%、27.50%、26.93%;黄秋葵果中黄酮含量最高,各器官黄酮含量依次为:果>茎叶>花。
