仪器法与化学法测定健康麋鹿血清蛋白结果比较
2018-12-11李夷平张树苗陈颀白加德
李夷平,张树苗,陈颀,白加德
(北京麋鹿生态实验中心,北京 100076)
麋鹿(Elaphurus davidianus)是原产于中国长江中下游沼泽地带我国特有的大型鹿科动物,现属于国家一级重点保护动物,世界自然保护联盟IUCN红皮书野外灭绝物种,是我国15个重引进成功物种之一,现在我国麋鹿的迁地保护工作取得了阶段性的成功。动物血液中血清白蛋白与球蛋白组成一对缓冲对,维持着血浆胶体渗透压平衡,并在营养、运输等方面发挥重要作用[1]。因此,研究健康麋鹿的血清蛋白,为正确评估各指标在各年龄段对相关疾病诊断和预防等诸多方面均具有重要的参考价值。近年来随着科学技术的进步,全自动生化分析仪器逐渐替代了之前学者们使用的手工化学法(盐析法、溴甲酚绿法、溴甲酚紫法、双缩脲法等)测定,使各项试验条件得到控制,测定结果更为客观。本试验用全自动生化分析仪(以下简称仪器法)与手工化学法(溴甲酚绿法及双缩脲法)(以下简称化学法)对麋鹿血清同步做血清蛋白测定,探索2种方法间得出的结果是否存在差异显著及是否具有良好的相关性。
1 材料
1.1 实验动物
实验动物来源于北京南海子麋鹿苑,按张树苗等[2](以下简称报道)文章中麋鹿年龄的划分方法将试验麋鹿分为幼年组、青年组、成年组和老年组。其中,幼年组20只,青年组28只,成年16只,老年16,每组雌、雄各半。
麻醉枪对80只健康麋鹿注射药物陆眠灵进行麻醉保定,在麋鹿完全进入麻醉状态下,分别采集颈部静脉血10mL,3 000r/min离心15min,取分离后的血清加入防腐剂,分装后置于4℃冰箱中保存,备用。
1.2 试剂
溴甲酚绿试剂、双缩脲试剂、0.85%氯化钠溶液均按照《全国临床检验操作规程》[3]配制。
1.3 仪器
全自动生化分析仪(TBA40,日本东芝集团);尤尼柯UV-2102PC型紫外分光光度计(上海仪器有限公司)。
2 检测方法
2.1 化学法测定
2.1.1 溴甲酚绿法测定血清白蛋白 取试管2支,1支加血清0.2mL,另1支加0.85%氯化钠溶液0.2mL作试剂空白管,2管各加溴甲酚绿试剂5mL。蒸馏水作为空白对照,以绿色滤光板进行比色,以空白管校正光密度到0点,读取各管光密度读数。
2.1.2 双缩脲法测定血清总蛋白 取血清0.1mL,加入0.85%氯化钠溶液2.4mL,混匀取1mL加入双缩脲试剂4mL,混匀放置20min,以绿色滤光板,用双缩脲试剂作空白比色,由总蛋白标准线上查得其结果。
2.1.3 计算 血清总蛋白=总蛋白测定管光密度/标准管光密度 标准血清蛋白浓度;血清白蛋白=白蛋白测定管光密度/标准管光密度 标准血清蛋白浓度;血清球蛋白=血清总蛋白-血清白蛋白;血清白蛋白/球蛋白比值(A/G)=血清白蛋白/血清球蛋白。
2.2 仪器法测定
2.2.1 麋鹿血清总蛋白检测 比色杯中加入总蛋白试剂,推入后监测540nm下吸光度A0;标准液检测吸光度为AS。以吸光度A为纵坐标、浓度C为横坐标,将A0和AS2点在坐标图上连成线即为标准曲线。然后将样品血清如标准液一样操作流程,检测出的吸光度为A,将这个A在标准曲线上寻找其对应的浓度即血清总蛋白浓度。
2.2.2 麋鹿血清白蛋白检测 在比色杯中加入白蛋白试剂,推入后监测540nm下吸光度A01;标准液检测吸光度为AS1。以吸光度A1为纵坐标、浓度C1为横坐标,将A01和AS12点在坐标图上连成线,作为标准曲线。再将样品血清与标准液操作流程一致,检测出的吸光度为A1,将这个A1在标准曲线上寻找其对应的浓度,即血清白蛋白浓度。
2.3 数据处理方法
应用SPSS20.0统计软件进行数据分析,将仪器法与化学法测得的幼年、青年、成年及老年4个年龄段的个体以及每个年龄段雌雄个体的总蛋白、球蛋白及白蛋白数据采用独立样本t检验及相关双变量Person双侧检验,以检测2种方法间的差异性及相关性。
3 结果
3.1 麋鹿血清蛋白浓度及白球比值比较
检测结果表明,幼年血清总蛋白浓度存在显著差异(P< 0.05),具有良好的相关性(r> 0.80);幼年血清白蛋白、球蛋白及白球比2种方法测得结果均差异不显著(P> 0.05),具有良好的相关性(r> 0.80);青年、成年及老年血清总蛋白、白蛋白、球蛋白及白球比2种方法测得结果差异不显著(P>0.05),均具有良好的相关性(r> 0.80)。见表1、图1~图 4。
表1 仪器法及化学法检测健康麋鹿血清蛋白及相关与差异比较Table 1 Comparison of instrumental and chemical methods for detectingserum albumin in healthy elk(,g/L)
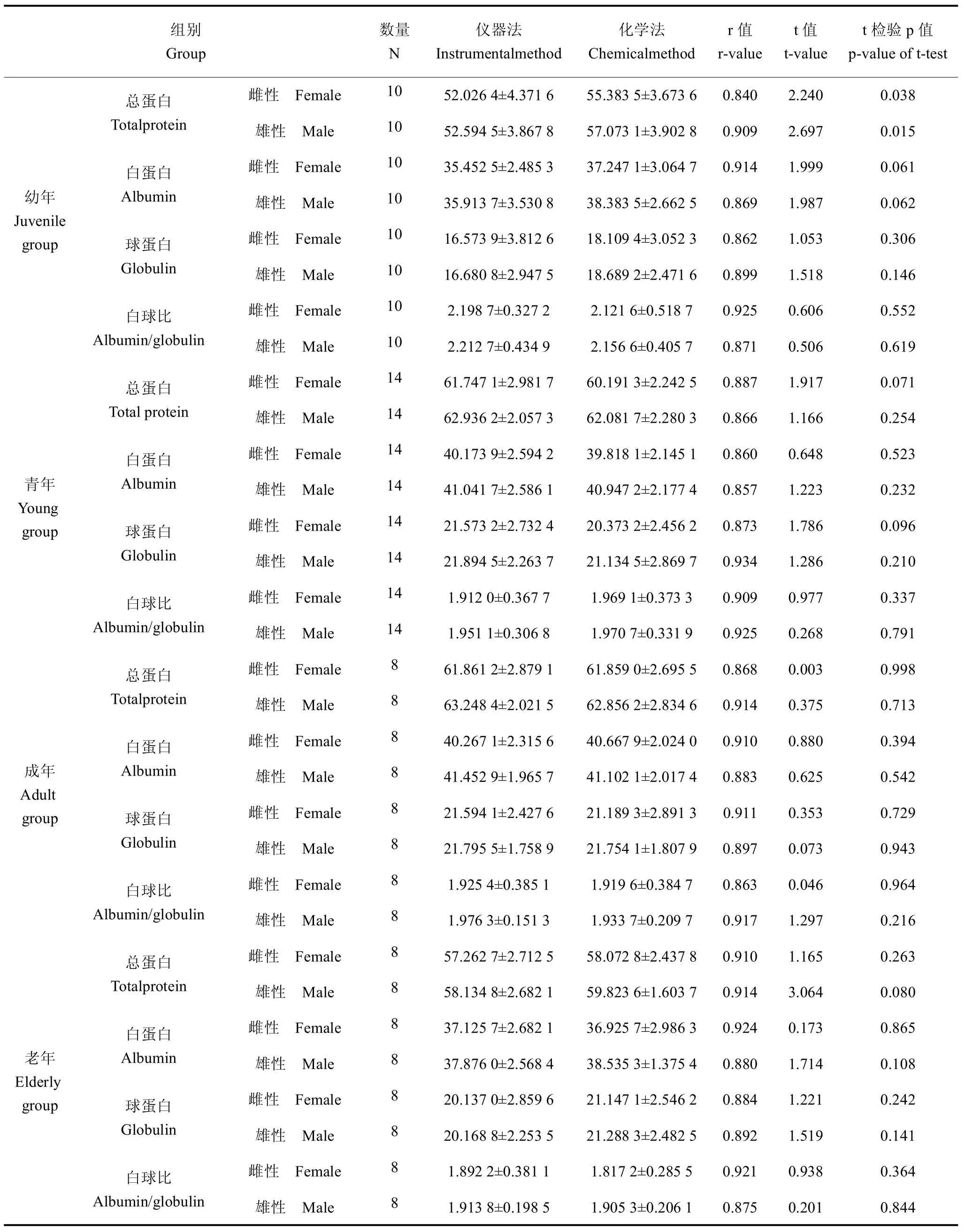
表1 仪器法及化学法检测健康麋鹿血清蛋白及相关与差异比较Table 1 Comparison of instrumental and chemical methods for detectingserum albumin in healthy elk(,g/L)
组别 数量 仪器法 化学法r值t值t检验 p值GroupNInstrumentalmethodChemicalmethodr-valuet-valuep-value of t-test总蛋白 雌性 Female10 52.026 4±4.371 6 55.383 5±3.673 6 0.840 2.240 0.038 Totalprotein雄性 Male10 52.594 5±3.867 8 57.073 1±3.902 8 0.909 2.697 0.015白蛋白 雌性 Female10 35.452 5±2.485 3 37.247 1±3.064 7 0.914 1.999 0.061幼年Albumin雄性 Male10 35.913 7±3.530 8 38.383 5±2.662 5 0.869 1.987 0.062 Juvenile10 group球蛋白 雌性 Female16.573 9±3.812 6 18.109 4±3.052 3 0.862 1.053 0.306 Globulin雄性 Male10 16.680 8±2.947 5 18.689 2±2.471 6 0.899 1.518 0.146白球比 雌性 Female10 2.198 7±0.327 2 2.121 6±0.518 7 0.925 0.606 0.552 Albumin/globulin雄性 Male10 2.212 7±0.434 9 2.156 6±0.405 7 0.871 0.506 0.619总蛋白 雌性 Female14 61.747 1±2.981 7 60.191 3±2.242 5 0.887 1.917 0.071 Total protein雄性 Male14 62.936 2±2.057 3 62.081 7±2.280 3 0.866 1.166 0.254白蛋白 雌性 Female14 40.173 9±2.594 2 39.818 1±2.145 1 0.860 0.648 0.523青年Albumin雄性 Male14 41.041 7±2.586 1 40.947 2±2.177 4 0.857 1.223 0.232 Young14 group球蛋白 雌性 Female21.573 2±2.732 4 20.373 2±2.456 2 0.873 1.786 0.096 Globulin雄性 Male14 21.894 5±2.263 7 21.134 5±2.869 7 0.934 1.286 0.210白球比 雌性 Female14 1.912 0±0.367 7 1.969 1±0.373 3 0.909 0.977 0.337 Albumin/globulin雄性 Male14 1.951 1±0.306 8 1.970 7±0.331 9 0.925 0.268 0.791总蛋白 雌性 Female8 61.861 2±2.879 1 61.859 0±2.695 5 0.868 0.003 0.998 Totalprotein雄性 Male8 63.248 4±2.021 5 62.856 2±2.834 6 0.914 0.375 0.713白蛋白 雌性 Female8 40.267 1±2.315 6 40.667 9±2.024 0 0.910 0.880 0.394成年Albumin雄性 Male8 41.452 9±1.965 7 41.102 1±2.017 4 0.883 0.625 0.542 Adult8 group球蛋白 雌性 Female21.594 1±2.427 6 21.189 3±2.891 3 0.911 0.353 0.729 Globulin雄性 Male8 21.795 5±1.758 9 21.754 1±1.807 9 0.897 0.073 0.943白球比 雌性 Female8 1.925 4±0.385 1 1.919 6±0.384 7 0.863 0.046 0.964 Albumin/globulin雄性 Male8 1.976 3±0.151 3 1.933 7±0.209 7 0.917 1.297 0.216总蛋白 雌性 Female8 57.262 7±2.712 5 58.072 8±2.437 8 0.910 1.165 0.263 Totalprotein雄性 Male8 58.134 8±2.682 1 59.823 6±1.603 7 0.914 3.064 0.080白蛋白 雌性 Female8 37.125 7±2.682 1 36.925 7±2.986 3 0.924 0.173 0.865老年Albumin雄性 Male8 37.876 0±2.568 4 38.535 3±1.375 4 0.880 1.714 0.108 Elderly8 group球蛋白 雌性 Female20.137 0±2.859 6 21.147 1±2.546 2 0.884 1.221 0.242 Globulin雄性 Male8 20.168 8±2.253 5 21.288 3±2.482 5 0.892 1.519 0.141白球比 雌性 Female8 1.892 2±0.381 1 1.817 2±0.285 5 0.921 0.938 0.364 Albumin/globulin雄性 Male8 1.913 8±0.198 5 1.905 3±0.206 1 0.875 0.201 0.844
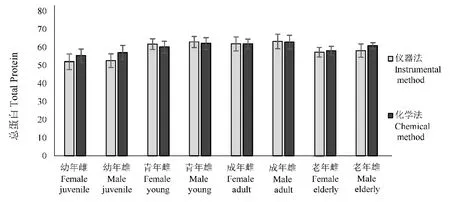
图1 各年龄阶段总蛋白浓度Fig.1 Total protein concentrationat various ages
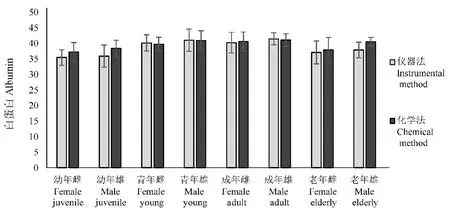
图2 各年龄阶段白蛋白浓度Fig.2 Albumin concentrationat various ages
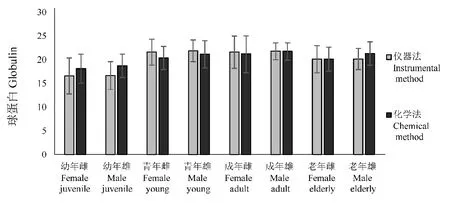
图3 各年龄阶段球蛋白浓度Fig.3 Concentration of globulinat various ages

图4 各年龄阶段白球比值Fig.4 Albumin/globulinat various ages
3.2 本研究结果与报道结果对比
2种方法测定的各年龄段各血清蛋白数据的变化趋势基本一致(图5~图8.),与报道中采用全自动生化分析仪测定血清中总蛋白、白蛋白和球蛋白的研究结果、趋势也近乎一致(表2)。
麋鹿在幼年阶段血清总蛋白、白蛋白和球蛋白含量最低,随着年龄增长,当麋鹿在青年期和成年期时,其血液中的血清白蛋白、球蛋白和总蛋白含量达到最大值,2个阶段之间蛋白含量相近(P>0.05),但显著高于幼年和老年阶段,差异具有统计学意义(P<0.05)。随着年龄进一步增长,麋鹿进入老年期,蛋白含量显著下降[3]。
在健康麋鹿的各个年龄阶段,雄性血清总蛋白、白蛋白和球蛋白含量的平均值均高于雌性个体,但差异不具有统计学意义(P>0.05)。
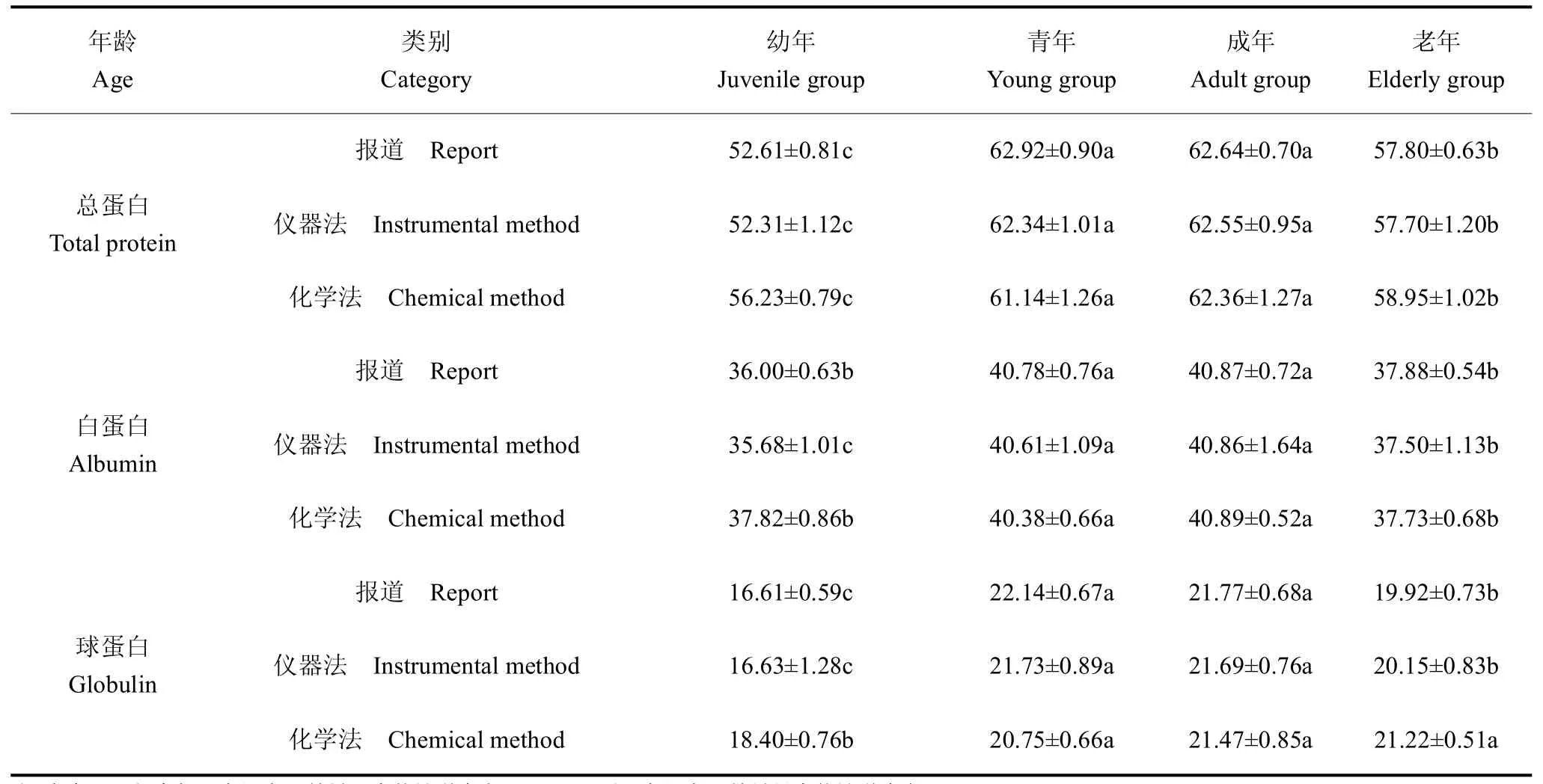
表2 报道与本次检测结果比较Table 2 Comparison of previous reports date with the date of this test
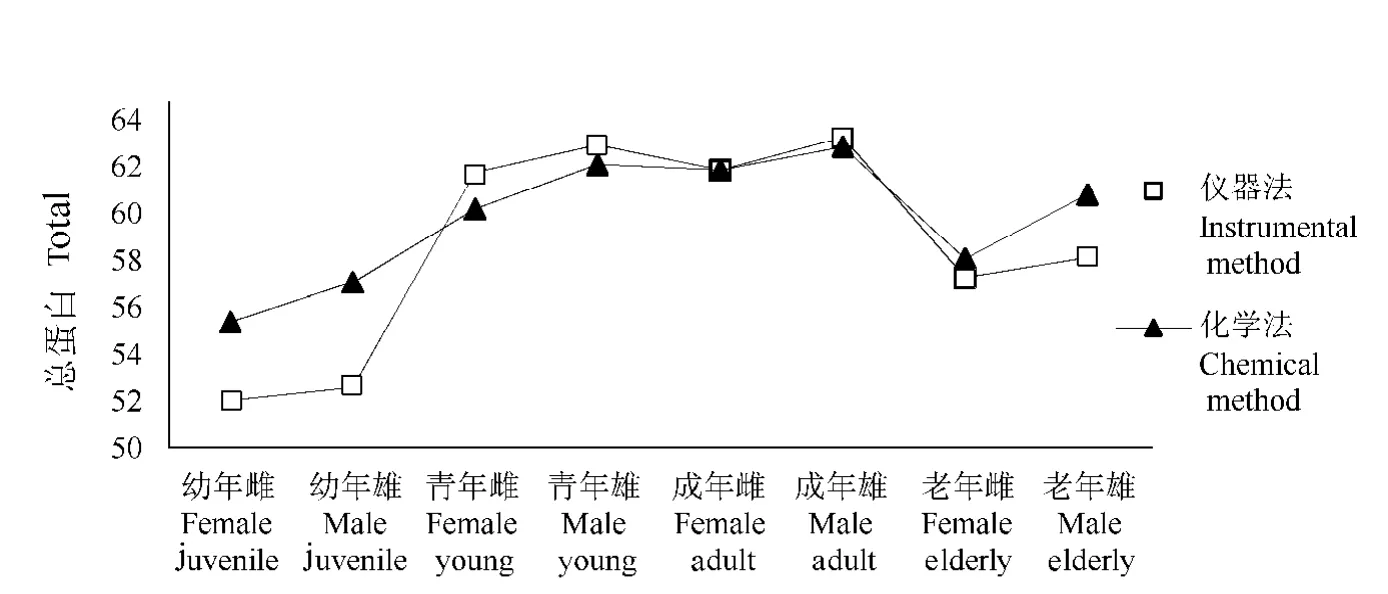
图5 各年龄阶段总蛋白变化趋势Fig.5Trends in total protein at various ages
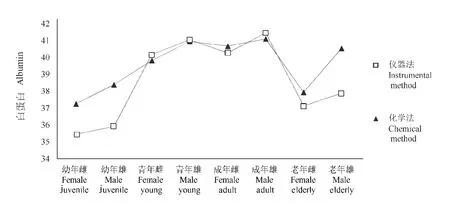
图6 各年龄阶段白蛋白变化趋势Fig.6 Trends in albumin at various ages

图7 各年龄阶段球蛋白变化趋势Fig.7 Trends in globulin at various ages
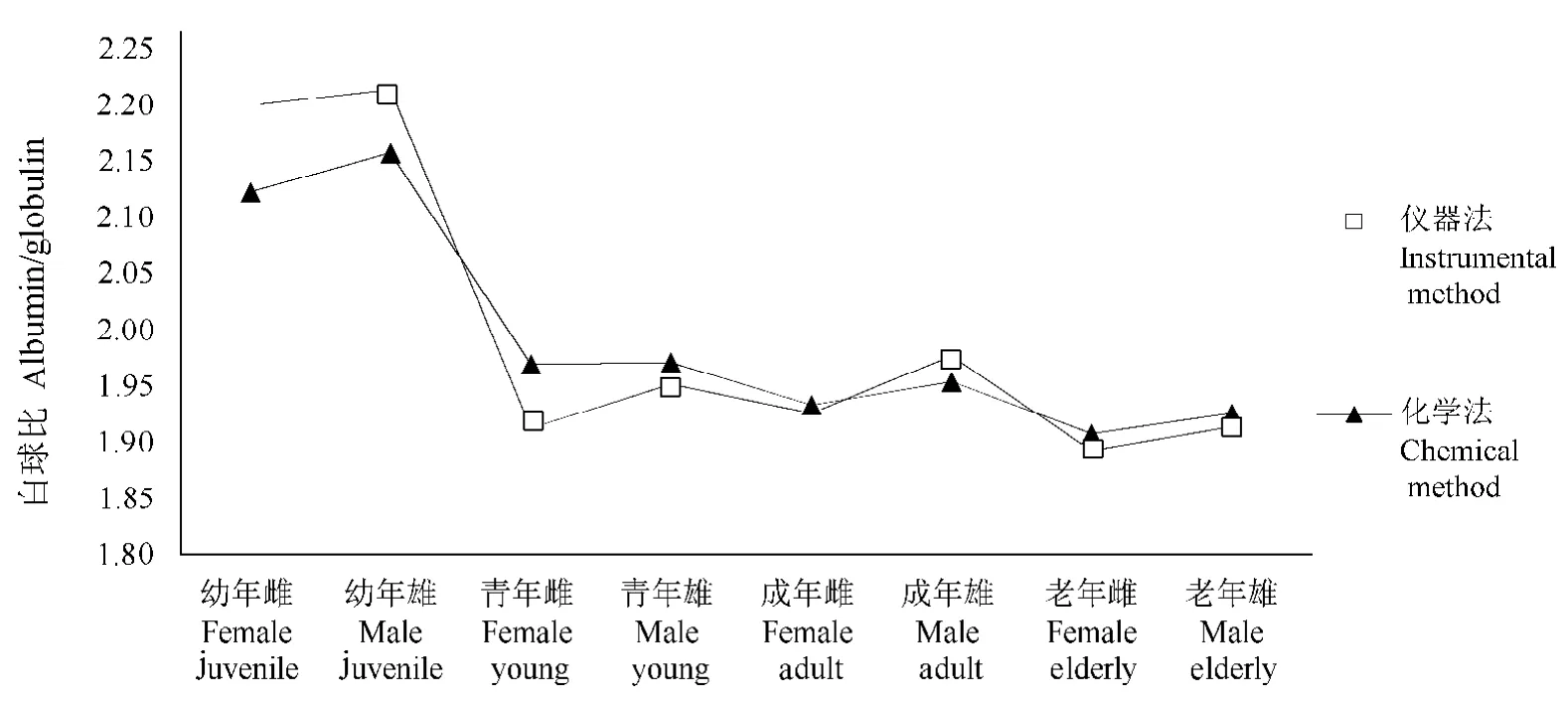
图8 各年龄阶段白球比值变化趋势Figure 8Trends in albumin/globulinat various ages
4 讨论
4.1 本次研究与报道的一致性
通过对80份健康麋鹿血清使用仪器法测定血清蛋白与化学法检测血清蛋白,进一步验证了张树苗等[3]的结论:年龄与总蛋白、球蛋白和白/球比的相关性具有统计学意义(P<0.05),青年及成年阶段血清总蛋白、白蛋白及球蛋白间不存在显著差异(P>0.05),但显著高于幼年及老年血清总蛋白、白蛋白及球蛋白(P<0.05);性别与三者相关性较小,说明同一年龄段雌、雄个体间的蛋白含量相近,各年龄阶段雄性血清总蛋白、白蛋白和球蛋白均高于雌性,但差异不显著(P>0.05)。究其原因,张树苗等[3]报道中也有过论述。白蛋白水平的高低能够反映麋鹿的营养状况,麋鹿在幼年阶段由于消化和吸收功能尚未完善,营养状态较差;随着年龄增长,进入青年和成年期后,营养状态最好;而后随着年龄的衰老,其牙齿及各消化器官功能退化,摄入营养的能力下降;球蛋白水平的高低反映机体的免疫能力,表中数据说明麋鹿在青年和成年期的免疫力最好,幼年麋鹿由于免疫功能尚未发育完全,免疫能力较低,而老年麋鹿的衰老也导致免疫功能下降;雄性个体的蛋白水平普遍高于雌性个体,这可能与雄性麋鹿的摄食量大和雄激素促进蛋白合成有关[3]。
4.2 2种方法检测结果的一致性及化学方法的有效性
仪器法测定血清蛋白与化学法检测血清蛋白,2种方法间除幼年总蛋白测得数据存在显著差异之外,(2种方法间幼年总蛋白存在差异的原因可能与个体间差异有关,某些幼年个体血清蛋白浓度偏高,某些偏低,标准差相较其他组大。再者,化学法受限于人工操作,难免会存在操作误差),其余各年龄阶段各蛋白成分测得数据均不存在显著差异(P>0.05);且2种方法间具有良好的相关性(r>0.80),能科学客观地体现各年龄阶段的血清蛋白各成分的变化趋势。
4.3 实际应用中2种方法应注意事项
4.3.1 实验操作中仪器、试剂、样本来源以及实验操作技能的差异等因素均有可能影响实验结果。当血清中蛋白成分相对正常时候,严格按照实验操作,把握好反应时间,2种方法检测血清白蛋白浓度结果相一致或接近。因此,实际操作中,不同方法应根据方法采用相应参考值。
4.3.2 溴甲酚绿反应时间长短对读数也有影响[4],同时溴甲酚绿染料浓度的增加可导致结果评价光密度值相应增大,影响检测结果[5]。这是由于溴甲酚绿能与非血清白蛋白类蛋白质产生非特异性结合反应,使得其检测特异性一直以来不是很理想。化学法测定蛋白存在的非特异性反应一直是生化检验的难点,缩短反应时间固然可减少非特异性反应,但反应时间过短亦可使反应不充分[3]。双缩脲法对各种蛋白质呈色基本相同,虽然灵敏度不高,但对血清总蛋白定量是较为适合的方法[6]。
4.3.3 全自动生化分析仪器测定法是依据物理性分离蛋白,测得的各组分较真实地反应了白蛋白和球蛋白的含量,其中白蛋白较接近真值[7],使测定结果更具客观性,具有快速、准确、重复性好的优点,但如果不能及时用标准液校正,结果有可能造成同一倾向的偏高或偏低,造成较大的系统误差,所以每次测定前要进行校正,以确保检验结果的准确性[8]。
5 结论
麋鹿在幼年时期的血清白蛋白和球蛋白含量相对较低,进入青年期后血清总蛋白、白蛋白和球蛋白含量都达到最大值,老年期后,血清总蛋白、白蛋白和球蛋白含量逐渐下降;雌性个体与雄性个体比较,雄性个体的血清蛋白含量略高于雌性个体。
