微生物来源CpG免疫增强剂筛选与动物安全试验
2018-12-11刘艳环李海涛朱言柱常彤肖家美苗利光
刘艳环,李海涛,朱言柱,常彤,肖家美,苗利光
(中国农业科学院特产研究所,长春 130112)
特异性免疫是含有病原相关分子模式(PAMP)的反应物与天然免疫细胞上的模式识别受体(PRR)相结合,激活天然免疫应答,从而活化抗感染途径的过程[1]。高度纯化的新型疫苗因缺少PAMP成分,不能被天然免疫细胞的PRR很好地识别,不足以产生引起免疫应答的有效信号。CPG-DNA作为佐剂可以克服新型疫苗PAMP不足的缺陷,通过模拟感染过程诱导强烈的免疫应答[2]。本项研究为筛选适合亚单位疫苗免疫的CpG佐剂,通过淋巴细胞增殖试验筛选出对羊、小鼠淋巴细胞都有较强细胞增殖作用的序列,为CpG佐剂的研制与应用提供理论依据.
CpG-DNA是一些具有免疫激活功能的以未甲基化的CpG基序为核心的DNA序列,它包括含CpG基序的人工合成的寡聚脱氧核苷酸(Oligodeoxynucleotides,ODN)和自然界中细菌、病毒、无脊椎动物等低等生物的基因组DNA。长期以来,DNA被认为只具有较弱的免疫原性,难以引起机体强烈的免疫反应。虽然早在1965年Braw等发现,用寡聚脱氧核苷酸与绵羊红细胞一起注射小鼠,可明显提高小鼠对绵羊红细胞的免疫应答水平,并首先提出寡聚脱氧核苷酸具有免疫佐剂的观点。但是,DNA的免疫调节作用被广泛认识和重视是在20年后,人们研究结果表明,DNA是刺激免疫反应的重要成分之一,特别是具有特定序列的细菌 DNA或经化学修饰的DNA能刺激机体产生极为强烈的免疫应答。这类DNA可以导致一些免疫细胞的增殖和分化,具有重要的免疫调节作用。1984年,Tokunaga等[3]报道了牛分支结核杆菌(Mycobactetium Bouis,BCG)提取物中的DNA片段可增强NK细胞的活性,具有抗肿瘤效应。
本试验通过淋巴细胞增殖试验,筛选出对羊、小鼠淋巴细胞都具有较强细胞增殖作用的序列,并进行相应的动物安全性试验,为进一步开展CpG免疫增强剂免疫效力试验奠定了基础。
1 试验材料、仪器与试剂
1.1 试验仪器
厌氧手套培养箱(美国Forma Scientific公司),825A厌氧罐(沈阳第五人民医院),高速冷冻离心机ST-21(美国 Sorvall公司),96孔细胞培养板(Greiner公司)。
1.2 化学试剂[4,5,6]
限制性内切酶 EcoR1、Marker 2 000(Promega公司),EY培养基、营养肉汤培养基、TE缓冲液、质粒提取液、RPMI1640、胎牛血清(HyClone公司),淋巴细胞分离液(中国医学科学院血液研究所)。
1.3 试验动物
体重为16g~20g昆明小白鼠52只,雌、雄各半,购于长春生物制品研究所。
1.4 试验材料
1.4.1 非致病性微生物来源 CpG-DNA的设计与合成 根据CpG-DNA特性,从非致病性的4种食品酿造菌〔枯草芽孢杆菌、乳酸菌(gi:16124244)、黄色短杆菌、双歧杆菌〕基因组中找出27条CpG-DNA序列(见表1),由北京华大中生科技发展有限公司合成,聚丙烯酰氨凝胶电泳纯化,纯度>99%,不含有脂多糖和内毒素。
1.4.2 致病性微生物来源 CpG-DNA的筛选 从节瘤拟杆菌、坏死梭杆菌基因组中找出5条富含CpGDNA的序列,分别命名为 CFNCpG1、CFNCpG2、CFNCpG3、CFNCpG4、Cp6。序列如下:

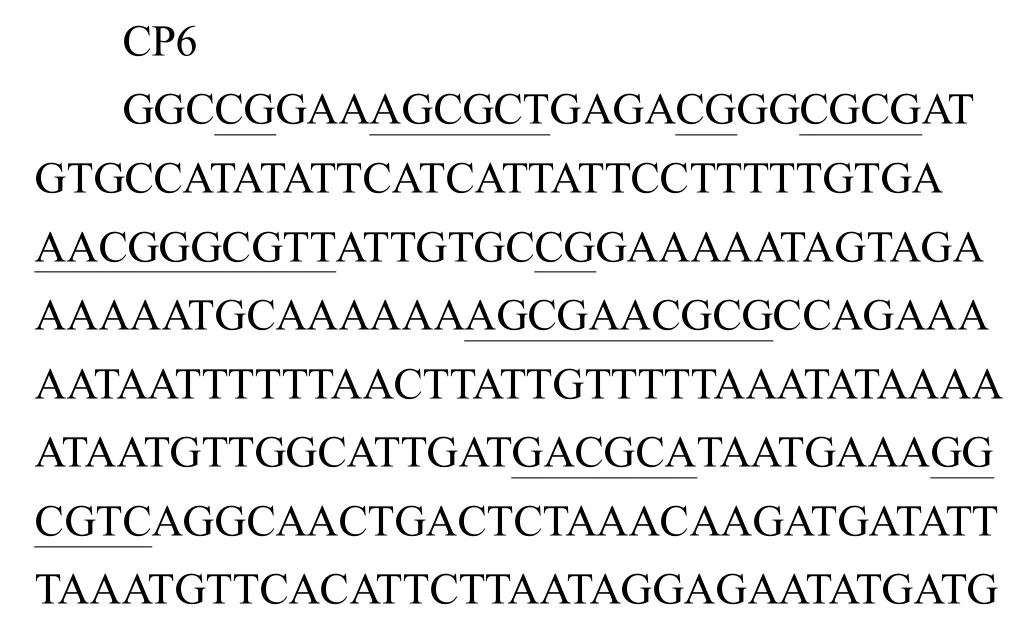
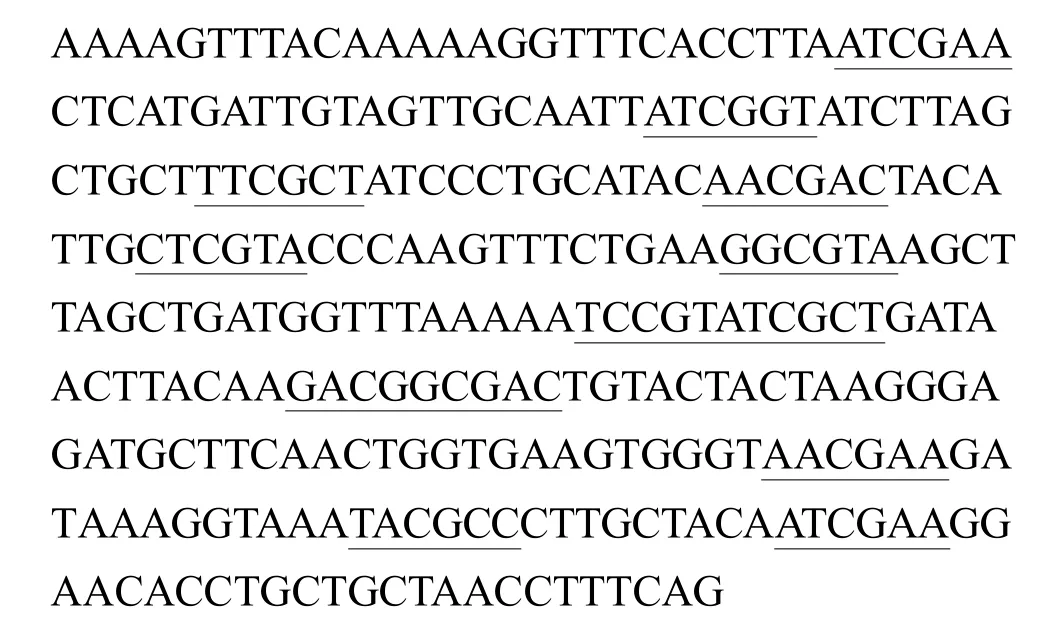
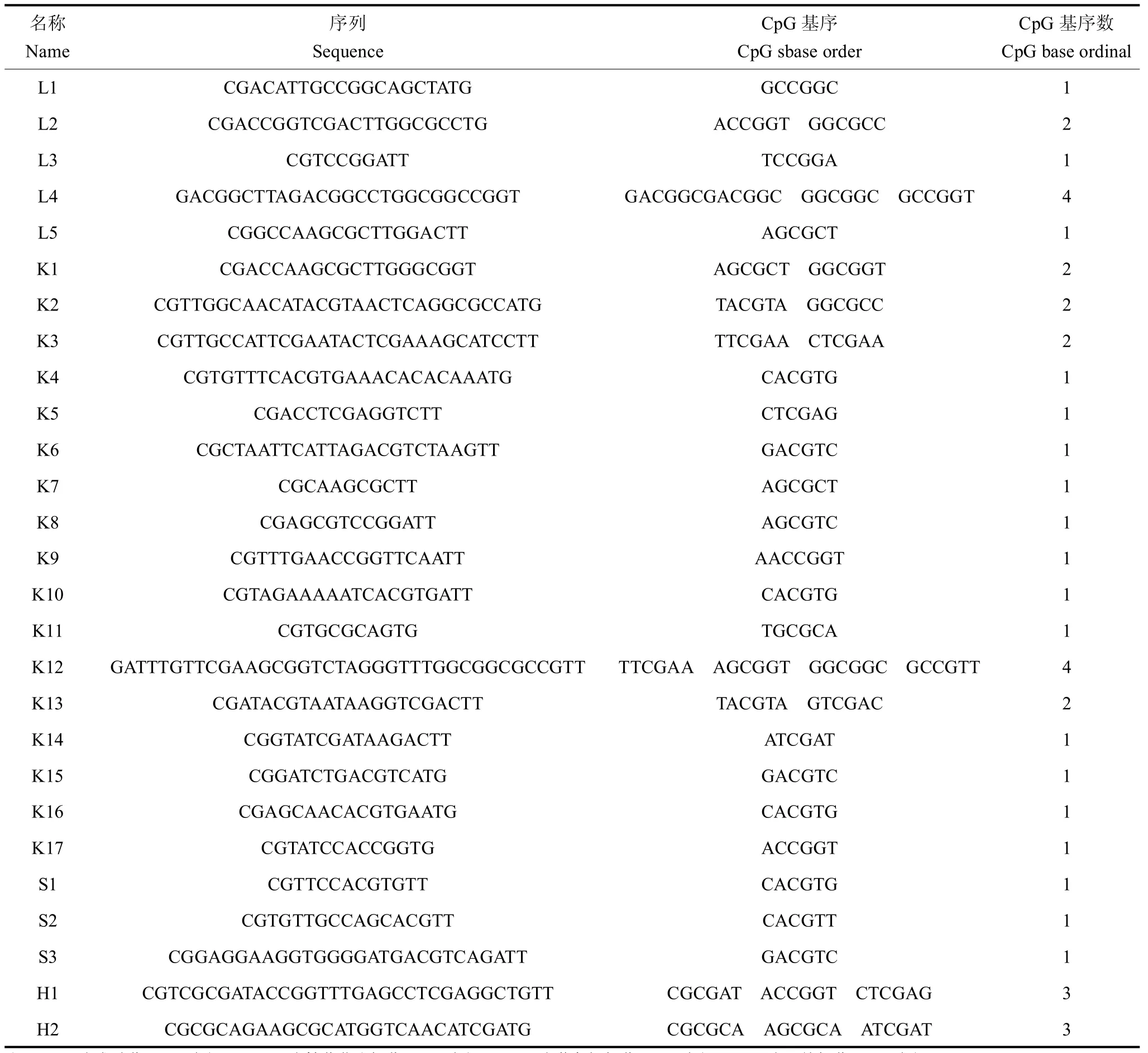
表1 CpG-DNA序列Tab.1 CpG-DNA Sequence
2 方法
2.1 含CpG-DNA序列质粒菌株的培养与质粒提取以及CpG-DNA序列片段的回收
将菌株接种于含Amp的LB液体培养基,37℃摇床培养24h。用碱裂解法提取质粒,在1%琼脂糖凝胶上进行电泳,鉴定提取结果;用EcoRI酶切质粒,1%低熔点胶回收目的片段。
2.2 淋巴细胞增殖实验
2.2.1 羊、小鼠淋巴细胞分离 羊颈静脉、小鼠去眼球无菌采血,肝素钠抗凝。取抗凝血1份,与Hank’s液1∶1混匀后,加于1份细胞于分离液面之上;1500r/min离心10min;收集界面上的细胞,放入含Hank’s液4mL试管中,充分混匀;1500r/min,离心10min;吸去上清液,沉淀洗涤2次;用无血清的RPMI-1640培养液悬浮细胞,取少量于镜下检查分离效果。
2.2.2 淋巴细胞增殖实验 细胞计数后,用RPMI-1640培养液将淋巴细胞稀释为1 106个/mL。将稀释好的淋巴细胞加入96孔培养板中,每孔加100细胞悬液。每孔加入1001640完全培养基。加入终浓度为15的CpG,同时设空白对照,混匀。37℃温箱中培养48h。细胞计数。
2.3 CpG-DNA及CpG-DNA安全性实验
免疫试验前将淋巴细胞增殖试验选出的CpG进行动物安全性试验,保证CpG实际应用时的安全。
2.3.1 质量控制 主要检测有无细菌、真菌等病原物质。
2.3.2 异常毒性试验 试验组昆明小白鼠2只,雌、雄各1只,每只小鼠腹腔注射20CpG;阴性对照组昆明小白鼠2只,雌、雄各1只,每只小鼠腹腔注射相同剂量的生理盐水,观察1周。
2.3.4 亚急性毒性试验 按给药方式将实验动物分为低剂量、中剂量、高剂量3个组及1个对照组,每组10只小鼠,雌、雄各半。3个剂量组分别于双侧后肢胫前肌肌肉注射CpG-DNA只,对照组给无菌生理盐水。每周2次,连续4周,共给药8次,每次注射体积均为以上各组于末次给药后24h摘眼球放血,处死。试验期间每日观察小鼠的外表特征和行为活动、神经症状、呼吸症状、粪便性状等,并每周测1次体重,小鼠处死后进行病理学检查。
3 试验结果
3.1 淋巴细胞增殖反应
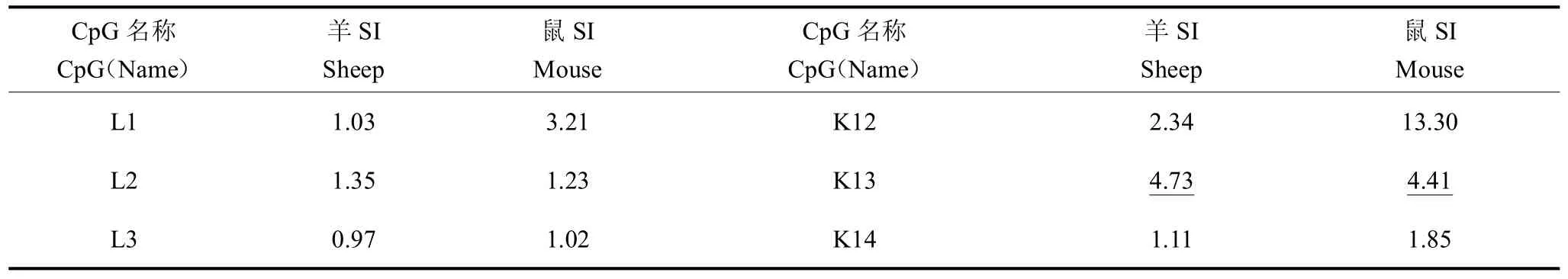
表2 CpG序列对淋巴细胞增殖效应Tab.2 The effect of CpG sequence on lymphocyte proliferation
3.2 CpG-DNA及CpG-DNA安全性试验
3.2.1 质量控制 以无菌生理盐水稀释合成的CpGDNA及提取的质粒和酶切回收的CpG-DNA,未检出细菌、真菌等病原体。
3.2.2 CpG异常毒性实验 实验期内所有动物均未出现异常反应,实验结束后所有昆明小鼠全部健存且体重增加,说明试验用CpG无异常毒性。
3.2.3 CpG超敏反应 昆明小鼠在超敏试验过程中未出现蜷缩、抽搐、被毛立起及休克等超敏反应。
3.2.4 临床表现 试验期间各组动物活动状态、被毛体态、饮食欲未见异常。
3.2.5 病理学检查 末次给药后24h,处死并剖检小鼠,检查小鼠脏器有无异常变化。结果,试验组和对照组小鼠无明显区别,各脏器均正常。

续表2
4 讨论
自从20世纪20年代以来,研究者们均尝试以各种物质作为疫苗的佐剂从而使疫苗更有效。迄今为止,只有氢氧化铝胶佐剂被食品药品监督管理局(FDA)获准了在人类和动物疫苗中应用,但它不能诱导产生Thl型反应,且干扰细胞免疫,使得疫苗的免疫保护不全面、不持久,也存在轻度局部反应、形成肉芽肿、局部无菌性脓肿等副作用,同时,有可能对人、畜神经系统有影响等[7]。因此,研制新型的可诱导Thl型免疫反应,且安全、有效、无毒副作用的佐剂成了众多学者研究的热点。
CpG-DNA可诱导Thl型免疫应答或调节免疫应答向Thl型免疫应答转换,使机体特异性体液免疫反应增强。另外,CPG-DNA刺激淋巴细胞产生的细胞因子可作用于相同或不同类型的免疫细胞,从而组成复杂的免疫网络,并具有免疫调节作用。其免疫增强活性较氢氧化铝胶等常规佐剂高得多,既可用于灭活疫苗,也可用于活疫苗,而且与其他佐剂有强烈的协同作用,可增强一些弱抗原的免疫原性。CPG-DNA几乎作为所有蛋白质抗原和灭活疫苗的佐剂,而且在与其他佐剂合用时还可弥补其他佐剂诱导Th2性免疫应答的缺陷,此外,一些不能与铝盐佐剂混合的减毒活疫苗或多价疫苗,CpG-DNA则可作为佐剂单独使用。
本试验依据CpG-DNA特性,制备出32条CpG序列,通过淋巴细胞增殖试验筛选出4个对羊、小鼠淋巴细胞都有较强细胞增殖作用的序列,分别为L4、K13、CFNCpG3、CP6。
通过对选出的CpG进行无菌试验、超敏试验和异常毒性试验的结果初步的研究分析表明,实验筛选出的CpG-DNA无菌、无异常毒性、无超敏反应。小鼠的亚急性毒性试验结果显示,各剂量组未见明显的毒性反应,解剖检查均无明显异常,说明该试验已取得较为满意的结果,为CpG佐剂的研制与应用提供了理论依据。
