直接肽反应试验及其研究进展
2018-12-11梅承翰庄慧敏刘师卜牛厚菊刘婷
梅承翰,庄慧敏,刘师卜,牛厚菊,刘婷
直接肽反应试验及其研究进展
梅承翰,庄慧敏,刘师卜,牛厚菊,刘婷
550016 贵阳,贵州省分析测试研究院应用基础研究室(梅承翰、牛厚菊);550004 贵阳,贵州医科大学附属医院医务处统计室(庄慧敏);100050 北京,中国食品药品检定研究院食品检定所毒理功效实验室(梅承翰、刘师卜、牛厚菊、刘婷)
变应性接触性皮炎(allergic contact dermatitis,ACD)是人类最常见的免疫毒性疾病之一。据估计 15% ~ 20% 的人会对一到多个市场中的化学品皮肤过敏[1]。支持皮肤致敏过程并最终导致 ACD 的关键机理事件已被阐释清楚。经济与合作发展组织(Organization for Economic Cooperation and Development,OECD)报告中将其定义为有害结局通路(adverse outcome pathway,AOP)[2]。皮肤致敏性评价作为物质安全性评价的重要组成部分并代表了化学品的技术标准。近年来,特别是欧洲国家,发展替代方法用以取代动物试验的社会、科学和经济的压力显著增加。为此,众多研究者开发基于肽或蛋白反应活性的方法用以筛选并鉴定潜在皮肤致敏物质,其中包括直接多肽反应试验(direct peptide reactivity assay,DPRA)。DPRA 立足于 AOP 中的分子起始事件,通过监测待测物对半胱氨酸和赖氨酸多肽的消除从而评估待测物的致敏性,其准确度和灵敏度较高,并易于操作。2013 年欧洲替代方法研究中心将 DPRA 推荐为皮肤致敏试验的方法,今已被 OECD 接受并公布[3]。该文将从 DPRA 的原理、局限性、优化发展和与其他替代方法的整合等方面作详细介绍。
1 基本原理
化学品与皮肤中蛋白的亲核中心共价结合,此即为皮肤致敏有害结局通路中的分子起始事件,若无该事件,则皮肤致敏一般不会发生[4]。因此如化学品可直接或经适当生物转化后与蛋白反应,便具有潜在皮肤致敏性。上述反应产物刺激朗格罕细胞从表皮向局部皮肤引流淋巴结转移,并将抗原呈递至初始型 T 细胞,导致抗原特异性记忆 T 细胞克隆增殖,最终导致 ACD 临床表征[5]。皮肤致敏物或其代谢产物的亲电子性,使其可与含亲核位点的蛋白反应。DPRA 利用含半胱氨酸和赖氨酸的多肽作为亲核试剂。待测物与上述多肽共孵育后,以高效液相色谱法检测多肽的消除程度并以此来评估待测物的反应能力。将多肽反应数据与已有的局部淋巴结分析(local lymaph node assay,LLNA)数据作对比,并用递归区分方法建立分类树,从而将反应程度分为极小、低、中和高四等[6]。最后将极小反应性归为非致敏物,其他为致敏物。
2 直接肽反应试验的局限
尽管直接肽反应试验准确度高、灵敏度高,且便于批量化检测,但仍存在局限。这些局限一定程度上限制了其广泛应用,当然这也是 DPRA 需要重点关注的地方。DPRA 以及许多其他用于皮肤致敏性评价的化学方法不能反映代谢活化或非生物转化[7],此为 DPRA 的主要缺陷之一。Pro-半抗原(pro-hapten)需要经过酶介导活化后,才可形成蛋白反应抗原,激发皮肤致敏。因而 DPRA 对于 pro-半抗原的致敏性预测存在困难,甚至无法预测。
直接肽反应试验对反应的估计依赖于对未反应多肽的检测,并可能受到不同亲水亲核试剂和疏水致敏物的影 响[8]。大多数皮肤过敏原水溶性较差,因而在与另一溶液混合时,可能析出沉淀,从而影响对肽反应的定量和结果分 级[9]。可见 DPRA 对待测物溶解性要求较高,此外溶剂的选择也需考量并经实验验证。同时 DPRA 对待测物浓度要求较高,在基于赖氨酸多肽(25 mmol/L)的检测方法中尤为明显,因而限制了高疏水性待测物的应用[10]。DPRA 检测中要求将待测物配制成 100 mmol/L 溶液,这在一定程度上限制了溶解性差的待测物的应用。
DPRA 对于混合物特别是含未知成分混合物的致敏性预测存在困难。DPRA主要是针对单一化学品,而对复杂组分致敏性预测未有详细界定和全方位评估。当然 DPRA 也并非完全不能用于混合物,OECD TG442C 写明了在针对成分已知的多组分时,需要根据各自组分的含量计算所需物质的重量(单一纯度);或计算混合物表观分子量,以评价混合物致敏性。另外对于无法确定分子量的聚合物,可考虑通过其单体分子量计算配制 100 mmol/L 溶液所需的量。有文献报道,研究人员应用 DPRA 对中药注射剂和植物提取物进行致敏性评价[11-12]。该方法将中药注射剂原液直接与多肽进行孵育,并未考虑混合物成分及其对应浓度。一方面这是对 DPRA 应用拓展的有益尝试,另一方面也提示研究人员需要对 DPRA 应用于复杂组分混合物作进一步评估。
3 直接肽反应试验的优化
直接肽反应试验一经推出,便受到广大研究人员和相关产业人员的关注。虽然 DPRA 优点明显,潜力巨大,但仍有其局限。为此研究人员立足于肽反应试验的本质,从多肽、代谢体系、检测方法等方面进行探索和优化,力图建立高准确度、高灵敏度、特异性强和检测快捷的肽反应试验方法。
HTS-DYCA(high throughput screening-dansyl cysteamine assay)是基于荧光半胱氨酸衍生物-新型化学高通量筛选方法对潜在皮肤亲电子致敏剂进行快速识别的方法[8]。DYCA 直接在多孔微反应板中对形成的半抗原-硫醇类蛋白质加合物进行荧光检测[8]。研究表明,在限定的致敏剂测试中,DYCA 和 DPRA 在准确度方面分别达到 81.8% 和 92.8%[8]。此外 DYCA 和 DPRA 均不能检测出公认的 pre/pro-半抗原,如对苯二酚、间苯二酚和羟基酪醇[8]。此外,DYCA 对溶解度和氧化副反应进行了优化,并采用高通量化检测以大幅缩短检测时间[8]。
过氧化物酶肽反应法(peroxidase peptide reactivity assay,PPRA)融合了剂量响应分析、肽消除质谱检测和辣根过氧化物酶-过氧化氢酶(HRP/P)体系[13],强化了对 pro/pre-半抗原的识别,调整和优化了 DPRA。HRP/P 加入多肽孵育体系后,使 DPRA 检测 pro-半抗原成为了可能。Troutman 等[7]研究表明,与 DPRA 相比,HRP/P 与 pre/pro-半抗原、半胱氨酸多肽共孵育,显著增强了 4-羟基苯甲酸、苯甲酸和对羟基苯甲酸丙酯的肽消除。酶介导激活 pro-半抗原后导致半胱氨酸多肽消除增加,最大消除值增加 20% ~ 100% 不等。然而对于 pre-半抗原,有无 HRP/P 加入,半胱氨酸多肽消耗无明显差异。应用 PPRA 对 70 个待测物进行评估,其准确度、灵敏度和特异性分别达到 83%、93% 和 64%[7]。然而待测物的溶解性和合适的测试浓度仍是 PPRA 面临的难题和挑战。替代方法对于识别致敏危害和提供正确的效力分级(弱、中等、强)都很重要。DPRA 和 PPRA 均可能有助于致敏效力评估,如提供整合方法、根据致敏物 GHS(Globally Harmonized System)分类或根据评估目的来确定致敏效力等[4]。此外也有研究人员将 PPRA 用于预测呼吸道致敏物。研究发现,PPRA 对具有内在活性的呼吸道致敏物的预测与 DPRA 类似,但未能将呼吸道 pre/pro-半抗原双氯苯双胍己烷、乙二胺和二乙烯二胺准确识别[14]。
Fujita 等[15]通过对氨基酸衍生物进行优化,使用 N-(2-(1-naphthyl)acetyl)-L-cysteine(NAC)和 α-N-(2-(1- naphthyl)acetyl)-L-lysine(NAL)取代 DPRA 中的半胱氨酸多肽或赖氨酸多肽,开发出了氨基酸衍生物反应法(amino acid derivative reactivity assay,ADRA)。研究人员应用 ADRA 对 88 个待测物进行检测,准确度达 88%,与 DPRA 类似。后续研究人员又对氨基酸衍生物溶液的 pH、待测物/氨基酸衍生物比率等进行了优化。ADRA 灵敏度高,因而待测物的浓度可由 100 mmol/L 降低至 1 mmol/L,这使得易于制备一些溶解性差的待测物。此外 NAC/NAL 因其对待测物浓度要求较低,待测物不太可能出现沉淀和产生浑浊,预计定量更加准确[15]。ADRA 方法优化后,准确度高达 90%(82 个待测物)[15]。
4 与其他替代实验方法的联合运用
单一的非动物替代试验不足以完全覆盖皮肤致敏有害结局通路,也不能完全取代动物试验,因而越来越多研究倾向于联合各替代方法以弥补各自的局限,并争取覆盖尽可能多的皮肤致敏有害结局通路事件。最少两个关键事件的组合,如蛋白结合和树突状细胞(dendritic cells,DC)激活,使其在皮肤致敏中相关性更强,增强互补,因而提升了预测能力。

表 1 整合测试策略致敏性预测
注:*LLNA 致敏物(102),LLNA 非致敏物(37);#LLNA 致敏物(76),LLNA 非致敏物(25);&LLNA 致敏物(77),LLNA 非致敏物(26)。
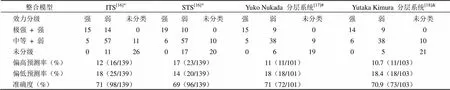
表 2 整合测试策略致敏效力预测
注:*LLNA:极强 + 强致敏(29),中等 + 弱致敏(73),未分级(37);#LLNA:极强 + 强致敏(24),中等 + 弱致敏(52),未分级(25);&LLNA:极强 + 强致敏(23),中等 + 弱致敏(54),未分级(26)。
4.1 集成检测策略
研究人员通过组合 139 个化学品的物理化学信息、LLNA、h-CLAT(human cell line activation test)、DPRA、DEREK 数据构建了一个具有综合性、多样性、高质量特点的数据集[16]。基于上述数据集,研究人员精炼了集成检测策略(integrated testing strategy,ITS)和次序检测策略(sequential testing strategy,STS)。如表 1 和表 2 所示,就预测而言集成检测策略与 LLNA 相比,危害识别准确高达 84%,效力分类准确度达 71%。与之类似,STS 准确度分别达到 81% 和 69%[16]。当排除 low Kow > 3.5 的待测物后,ITS 和 STS 的预测表现进一步提升。ITS 和 STS 与单用 h-CLAT 或 DPRA 相比,准确度更高,分别为 84% 和 81%[16]。Jaworska 等[19]基于贝叶斯网络构建了 ITS-3,并拓展了应用范围。ITS-3 可用于危害性识别、GHS 分级、定量风险评估等。该方法相较于 ITS-2 提高了准确度、精密度,优化了预测性。
4.2 分层测试策略
研究人员将 QSARs(quantitative structure-activity relationships)、DPRA、KeratinoSens、Gene signature、h-CLAT等按图 1 所示分成 3 个层次,并按照图示规则进行评估[20]。该策略有效弥补了各单一方法的不确定性,并正确地区分出所测 41 个待测物。然而该法可能无法识别出其他未参与测试的 pro-半抗原。因为该策略仅第二层的 HaCaT 细胞有一些代谢能力,而其他层面的代谢能力不足甚至缺失[20]。Pro-半抗原仅能在第二层被识别,因而可能无法正确区分这类物质的致敏性。未来可将 DPRA 更换成具有代谢能力的 PPRA 或在 KeratinoSens 中加入 S9 代谢部分以弥补该缺陷。此外,分层测试策略的另一局限是无法评估化学品的致敏效力。效力可通过高级统计方法,如定量机械模型、贝叶斯统计法进行评估。分层测试策略一方面可能减少假阴性结果,另一方面却可能提升假阳性结果,此外其灵敏度较高,特异性较低。
Kimura 等[18]将 IL-8 Luc 法与 DPRA 组合成分层预测法,并对 103 个待测物进行了评估。IL-8 Luc 法灵敏度高、适合于强致敏剂的检测,故作为第一层次。而对于 IL-8 Luc 检测不出的弱和中等致敏剂则采用 DPRA 评估。如表 1 所示,该层次预测法灵敏度高达 96.1%(74/77),准确度高达 87.4%(90/103)[18]。更重要的是 IL-8 Luc 和 DPRA 层次预测法可区分出 54 个 LLNA 中定义为弱或中等致敏剂中的 51 个(表 2)。在另一项研究中,研究人员将 h-CLAT 和 DPRA 组合成分层系统,该预测系统灵敏度高达 96%,准确度达 86%(表 1)[17]。
4.3 人工神经网络预测模型
神经网络预测分析是一种非线性数据统计建模工具,用于建模输入和输出的复杂关系,并且具有类似神经的学习能力。该模型运用多个由体外致敏实验而来的参数进行组合,旨在进一步提升预测性能。参数涵盖 h-CLAT、DPRA、SH test 以及抗氧化反应元件测定法(antioxidant response element assay)等[21]。研究表明,在两两组合中,应用 h-CLAT/DPRA 的人工神经网络预测模型比 DPRA/抗氧化反应元件测定法或 SH test/抗氧化反应元件测定法,LLNA 阈值相关性更好[21]。此外模型参数的增加有助于减少假阴性结果。三参数模型相较两参数模型,值更好,RMS error 更低[21]。化妆品成分复杂多样,其组分物理性质不尽相同,如水溶性、脂溶性、硅溶性、分子量、多聚物、植物提取物等。人工神经网络模型有望发展成一个非动物皮肤致敏性评价系统以覆盖尽可能多的化妆品。
4.4 基于分数的预测系统
研究人员同样基于贝叶斯网络集成测试策略将已见报道的 h-CLAT、DPRA 和 DEREK 数据整合成一个含 101 个化学品的数据集,并将各类试验数据折算成 0 ~ 2 分后进行分数加和[17]。如表 1 和表 2 所示,该方法与 LLNA 相比,对化学品致敏性和效力的预测准确度分别达到 85% 和 71%[17]。Kimura 等[18]基于致敏性分类,将 IL-8 Luc 数据和 DPRA 数据转换成 0 ~ 2 分,整合了一套基于分数的预测系统。该系统识别出了 23 个 LLNA 法中强致敏剂中的 14 个并划分为强致敏剂,另外也识别出了 54 个 LLNA 法中弱或中等致敏剂中的 38 个并归类为弱致敏剂。该系统准确度达 70.9%(表 2)。
2/3 预测模型:Urbisch 等[22]将 DPRA、KeratinoSens 和 h-CLAT 的各单项试验结果整合成 2/3 预测模型:即任何两个试验结果相同,则模型整体评价与该结果相同。以该预测模型对 213 种化学品进行评估,与人试验数据相比准确度高达 90%,与动物 LLNA 数据相比,准确度达 79%。
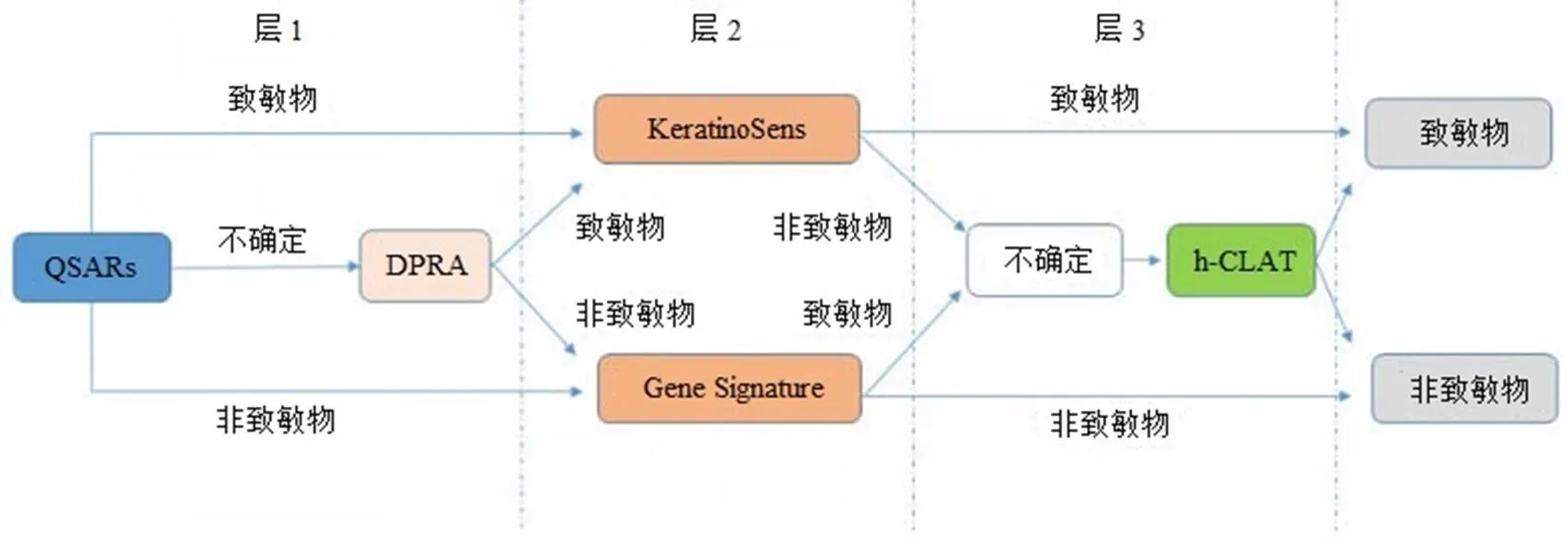
图 1 分层测试策略
整合不同试验数据可有效克服单一试验的不足[23]。Strickland 等[24]通过对 120 个化学品 LLNA、DPRA、h-CLAT 和 KeratinoSens 数据的编制,并将可能影响物质致敏的物理化学因素考虑在内,构建了一系列预测模型。其中 7 个模型准确度较高,并将 3 个 pre-半抗原和 6 个 pre/pro-半抗原准确识别为致敏物。此外,4 个表现最优的模型在模型训练和测试中均准确识别出 16 个 pro-半抗原。
5 小结
直接肽反应试验具有高准确度、高灵敏度和操作相对简便等优点,经过研究者们不断优化和发展,已具备了一定的生物转化能力,可用于对 pre/pro-半抗原进行致敏性评价,并降低了对待测物的浓度要求,从而进一步拓展了其应用范围。然而各类致敏试验替代方法均有其内在局限,目前均不能完全替代动物试验,而各类替代方法的整合成为趋势。直接肽反应试验在各类整合替代试验方案中,不可或缺。我们相信随着皮肤致敏体外试验方法的不断完善和计算机致敏评估模型的持续优化和升级,皮肤致敏试验替代方法的应用将越来越广。
[1] Thyssen JP, Linneberg A, Menné T, et al. The epidemiology of contact allergy in the general population--prevalence and main findings. Contact Dermatitis, 2007, 57(5):287-299.
[2] Casati S, Griesinger C, Whelan M. EURL ECVAM recommendation on the direct peptide reactivity assay (DPRA) for skin sensitisation testing. Luxembourg: Publications Office of the European Union, 2013.
[3] Chen N, Wang P, Xian JW, et al. Research progress of alternative in vitro methods to evaluate skin sensitization. Chin J Comp Med, 2016, 26(12):85-90.(in Chinese)
陈宁, 王平, 冼静雯, 等. 皮肤致敏试验替代方法的研究进展. 中国比较医学杂志, 2016, 26(12):85-90.
[4] Gerberick GF. The use of peptide reactivity assays for skin sensitisation hazard identification and risk assessment. Altern Lab Anim, 2016, 44(5):437-442.
[5] Ryan CA, Hulette BC, Gerberick GF. Approaches for the development of cell-based in vitro methods for contact sensitization. Toxicol In Vitro, 2001, 15(1):43-55.
[6] Gerberick GF, Vassallo JD, Foertsch LM, et al. Quantification of chemical peptide reactivity for screening contact allergens: a classification tree model approach. Toxicol Sci, 2007, 97(2):417-427.
[7] Troutman JA, Foertsch LM, Kern PS, et al. The incorporation of lysine into the peroxidase peptide reactivity assay for skin sensitization assessments. Toxicol Sci, 2011, 122(2):422-436.
[8] Avonto C, Chittiboyina AG, Rua D, et al. A fluorescence high throughput screening method for the detection of reactive electrophiles as potential skin sensitizers. Toxicol Appl Pharmacol, 2015, 289(2):177-184.
[9] Natsch A, Gfeller H. LC-MS-based characterization of the peptide reactivity of chemicals to improve the in vitro prediction of the skin sensitization potential. Toxicol Sci, 2008, 106(2):464-478.
[10] Yamamoto Y, Tahara H, Usami R, et al. A novel in chemico method to detect skin sensitizers in highly diluted reaction conditions. J Appl Toxicol, 2015, 35(11):1348-1360.
[11] Zhang JS, Sang J, Sun YD, et al. The application of direct peptide reactivity assay for sensitization prediction of Chinese medicine injection. Drug Standards China, 2016, 17(4):268-271. (in Chinese)
张劲松, 桑晶, 孙叶丹, 等. 直接肽段结合方法在中药注射剂过敏反应预测中的应用. 中国药品标准, 2016, 17(4):268-271.
[12] Ke YH, Chen Y, Cheng SJ, et al.Preliminary study for integrating DPRA with h-CLAT to predict skin sensitizers. Acta Lab Anim Scientia Sinica, 2016, 24(6):611-617.(in Chinese)
柯逸晖, 陈彧, 程树军, 等. 直接多肽结合试验组合人细胞系活化试验预测皮肤致敏物的探讨. 中国实验动物学报, 2016, 24(6):611- 617.
[13] Gerberick GF, Troutman JA, Foertsch LM, et al. Investigation of peptide reactivity of pro-hapten skin sensitizers using a peroxidase- peroxide oxidation system. Toxicol Sci, 2009, 112(1):164-174.
[14] Lalko JF, Dearman RJ, Gerberick GF, et al. Reactivity of chemical respiratory allergens in the peroxidase peptide reactivity assay. Toxicol In Vitro, 2013, 27(2):651-661.
[15] Fujita M, Yamamoto Y, Tahara H, et al. Development of a prediction method for skin sensitization using novel cysteine and lysine derivatives. J Pharmacol Toxicol Methods, 2014, 70(1):94-105.
[16] Takenouchi O, Fukui S, Okamoto K, et al. Test battery with the human cell line activation test, direct peptide reactivity assay and DEREK based on a 139 chemical data set for predicting skin sensitizing potential and potency of chemicals. J Appl Toxicol, 2015, 35(11): 1318-1332.
[17] Nukada Y, Miyazawa M, Kazutoshi S, et al. Data integration of non-animal tests for the development of a test battery to predict the skin sensitizing potential and potency of chemicals. Toxicol In Vitro, 2013, 27(2):609-618.
[18] Kimura Y, Fujimura C, Ito Y, et al. Optimization of the IL-8 Luc assay as an in vitro test for skin sensitization. Toxicol In Vitro, 2015, 29(7):1816-1830.
[19] Jaworska JS, Natsch A, Ryan C, et al. Bayesian integrated testing strategy (ITS) for skin sensitization potency assessment: a decision support system for quantitative weight of evidence and adaptive testing strategy. Arch Toxicol, 2015, 89(12):2355-2383.
[20] van der Veen JW, Rorije E, Emter R, et al. Evaluating the performance of integrated approaches for hazard identification of skin sensitizing chemicals. Regul Toxicol Pharmacol, 2014, 69(3):371-379.
[21] Hirota M, Fukui S, Okamoto K, et al. Evaluation of combinations of in vitro sensitization test descriptors for the artificial neural network-based risk assessment model of skin sensitization. J Appl Toxicol, 2015, 35(11):1333-1347.
[22] Urbisch D, Mehling A, Guth K, et al. Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul Toxicol Pharmacol, 2015, 71(2):337-351.
[23] Kleinstreuer NC, Hoffmann S, Alépée N, et al. Non-animal methods to predict skin sensitization (II): an assessment of defined approaches. Crit Rev Toxicol, 2018, 48(5):359-374.
[24] Strickland J, Zang Q, Kleinstreuer N, et al. Integrated decision strategies for skin sensitization hazard. J Appl Toxicol, 2016, 36(9):1150-1162.
中国食品药品检定研究院中青年发展研究基金课题(2017C6)
刘婷,Email:lutyliu@126.com
2018-09-12
10.3969/j.issn.1673-713X.2018.06.014
