长链非编码RNA H19和转录因子SIRT6在口腔鳞癌中的表达及其与预后的关系
2018-12-11王海业张艳靖麻颖宜
王海业,张艳靖,麻颖宜
长链非编码RNA H19和转录因子SIRT6在口腔鳞癌中的表达及其与预后的关系
王海业,张艳靖,麻颖宜
450052 河南,郑州大学第一附属医院口腔科
研究长链非编码 RNA H19(LncRNA H19)和转录因子去乙酰化酶 6(SIRT6)在口腔鳞癌中的表达及临床意义。
纳入 2014 年 11 月 – 2015 年 5 月我院收治的 89 例口腔鳞癌患者作为研究对象,并以手术切除的口腔鳞癌组织为口腔鳞癌组,以癌旁组织作为正常组。采用实时定量 PCR 检测 LncRNA H19 与 SIRT6 表达水平,免疫组化法检测 SIRT6 蛋白表达,收集患者临床病理资料,根据口腔鳞癌组检测结果中位值将 LncRNA H19 分为高表达组与低表达组,观察 LncRNA H19、SIRT6 表达与患者临床病理特征的关系。采用 Kaplan-Meier 生存曲线、Log-Rank 检验分析 LncRNA H19 与 SIRT6 相对表达量对患者预后的影响。
与正常组相比,口腔鳞癌组 LncRNA H19 表达水平显著升高(< 0.05),而SIRT6 mRNA 与蛋白表达显著降低(< 0.05);LncRNA H19、SIRT6 均与淋巴结转移、TNM 分期、分化程度显著相关(< 0.05);Kaplan-Meier 分析结果显示,LncRNA H19 低表达组无进展生存期、总体生存时间显著高于高表达组(< 0.05),SIRT6 阳性表达组无进展生存期、总体生存时间显著高于阴性表达组(< 0.05)。
口腔鳞癌组织中 LncRNA H19 高表达,而 SIRT6 低表达,两者均与口腔鳞癌的发生发展及预后有关,且均可成为临床早期诊断与治疗的潜在靶标。
口腔鳞癌; 长链非编码 RNA H19; 去乙酰化酶 6
口腔鳞癌是常见于口腔颌面部的一种恶性肿瘤,发病率极高且严重影响人们生命安全,其常发生于口腔黏膜或皮肤的鳞状上皮,发病过程涉及多种癌基因的激活、抑癌基因失活及信号通路的异常改变等过程[1]。由于发病早期患者会出现癌细胞对周围组织的浸润及扩散导致临床治疗效果不佳,因而寻找早期诊断与治疗口腔鳞癌的靶点具有重大意义。长链非编码 RNA(long non-coding RNA,LncRNA)可参与基因转录及基因表达的调控过程,可在多种类型的癌症发展过程中发挥重要作用[2]。有研究表明,LncRNA H19 在胃癌中高表达并促进肿瘤细胞的增殖及迁移,且与患者预后不良密切相关[3]。去乙酰化酶 6(sirtuin 6,SIRT6)是一种抑癌蛋白并可通过参与 DNA 修复、调节基因转录等过程而抑制肿瘤细胞的发生、发展[4]。目前关于LncRNA H19 与 SIRT6 是否参与口腔鳞癌的临床进展及其与患者临床病理特征的关联性研究尚未见报道,因此本研究探讨口腔鳞癌及癌旁组织中 LncRNA H19 与 SIRT6 的表达水平及其与患者临床病理特征、预后的关系,为进一步探究 LncRNA H19 与 SIRT6 对口腔鳞癌的具体作用机制与临床应用提供参考依据。
1 材料与方法
1.1 材料
1.1.1 一般资料 选择 2014 年 11 月 – 2015 年 5 月我院收治的口腔鳞癌患者 89 例为口腔鳞癌组,其中男 57 例,女 32 例,年龄 21 ~ 65 岁,平均(43.36 ± 4.27)岁。患者均于手术留取距癌肿边缘 5 cm 处的癌旁组织标本为正常组。收集患者的临床病理资料,包括 TNM 分期、分化程度、浸润深度等,其中 TNM 分期分为I期 17 例、II期 23 例、III期 21 例、IV期 28 例[5]。分化程度:高分化 18 例、中分化 31 例、低分化 40 例。纳入标准:①口腔鳞癌患者符合相关诊断标准[6];②未进行放疗或化疗者;③未接受非甾体类消炎药治疗者;④患者知情且签署同意书。排除标准:①患有其他恶性肿瘤者;②肝、肾、心脏等重要器官严重损伤者;③临床资料不全者。
1.1.2 主要试剂及仪器 Trizol 试剂盒、反转录试剂盒及 PCR 试剂盒均购自美国 Invitrogen 公司;引物均由生工生物工程(上海)股份有限公司合成;ABI 7900HT 实时荧光定量 PCR 仪购自上海实维实验仪器技术有限公司;BX51 光学显微镜购自日本奥林巴斯公司。

表 1 qRT-PCR 引物序列
1.2 方法
1.2.1 实时定量 PCR 检测 LncRNA H19 与 SIRT6 表达水平 取冻存的各组织标本并按照 Trizol 试剂盒说明书提取总 RNA,将 RNA 反转录为 cDNA 并以其为模板分别对 LncRNA H19 与 SIRT6 进行实时定量 PCR 检测。反应体系为25 μl:SYBR Green I qPCR Master Mix 12 μl、上下游引物各 1 μl、cDNA 模板 1 μl、ddH2O 10 μl。其中引物合成见表 1。反应程序为:95 ℃ 10 min;95 ℃ 15 s,48 ℃ 30 s,72 ℃ 30 s,共 40 个循环。反应结束后收集数据,并对所得数据 Ct 值进行分析,LncRNA H19 以 U6 为内参基因,SIRT6 以 GADPH 为内参基因,采用 2-ΔΔCt法计算 LncRNA H19 与 SIRT6 mRNA 的相对表达量。
1.2.2 免疫组化法检测 SIRT6 蛋白表达 取冻存的口腔鳞癌组织切片,分别于二甲苯、无水乙醇、乙醇及 PBS 溶液中脱蜡,3% 过氧化氢处理切片后取出,PBS 溶液洗涤 3 次,之后采用微波修复法修复抗原并将其置于枸橼酸钠缓冲液中,微波炉加热至沸腾后进行冷却,重复一次后用 PBS 清洗,取出切片后封闭 10 min。在切片组织中加入一抗,4 ℃孵育 12 h,洗涤后加入二抗并置于 4 ℃下孵育 20 min,洗涤后加入 DAB 显色液,采用苏木素复染并将其在不同梯度乙醇中脱水,中性树脂封片,置于显微镜下观察。
在 400 倍光镜下观察,选取 5 个高倍视野并对染色细胞数量进行统计[7]。按染色强度计分:无色为 0 分,淡黄色为 1 分,棕黄色为 2 分,棕褐色为3 分;按阳性细胞所占的百分比计分:< 5% 为 0 分,5% ~ 25% 为 1 分,26% ~ 50% 为 2 分,50% ~ 75% 为 3 分,≥ 75% 为 4 分。取上述两项乘积:≤ 3 分为阴性,> 3 分为阳性。
1.2.3 随访 术后通过打电话、门诊复查的方式对所有患者进行 3 年随访,电话随访以连续3 次随访失败归为失访并统计无进展生存期(PFS)与总体生存时间(OS),其中 PFS 是指患者开始治疗到肿瘤进展或死亡这一段时间,OS 是指从随机化分组开始至因任何原因引起死亡的时间。
1.3 统计学处理

2 结果
2.1 两组 LncRNA H19 与 SIRT6 表达水平的检测结果
两组 LncRNA H19 与 SIRT6 表达水平存在明显差异,口腔鳞癌组 LncRNA H19 表达水平高于正常组,而SIRT6 表达水平低于正常组,差异均具有统计学意义(< 0.05)(表 2)。

表 2 LncRNA H19 与SIRT6表达水平的检测结果(,*P < 0.05)
2.2 口腔鳞癌组织及癌旁组织中 SIRT6 蛋白表达
免疫组化结果显示 SIRT6 定位于细胞核,染色呈淡黄色、棕黄色、棕褐色(图1)。口腔鳞癌组 SIRT6 蛋白阳性率显著低于正常组(< 0.05)(表 3)。
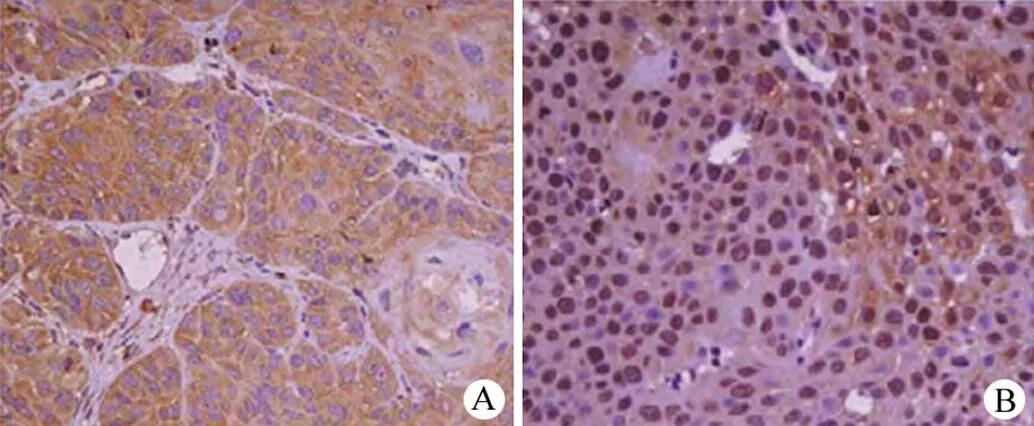
图 1 鳞癌组(A)和正常组(B)SIRT6 蛋白表达(× 400)
Figure 1 Squamous cell carcinoma (A) and normal group (B) SIRT6 protein expression (× 400)
2.3 LncRNA H19、SIRT6 表达与患者临床病理特征的关系
根据口腔鳞癌组 LncRNA H19 表达水平的中位值将其分为高表达组共 68 例,低表达共 21 例,SIRT6 阴性表达组 65 例,阳性表达组 24 例。观察LncRNA H19、SIRT6 表达与口腔鳞癌患者临床病理特征的关系,结果显示 LncRNA H19 与淋巴结转移、TNM 分期、分化程度相关,SIRT6 与淋巴结转移、TNM 分期、分化程度及浸润深度相关,差异均具有统计学意义(< 0.05)(表 4)。
2.4 口腔鳞癌组织中 LncRNA H19、SIRT6 表达与患者预后的关系
Kaplan-Meier 分析结果显示,LncRNA H19、SIRT6 表达与口腔鳞癌患者 PFS、OS 明显相关,LncRNA H19 低表达组 PFS(55.26%)、OS(61.28%)高于高表达组 PFS(36.15%)、OS(38.23%),SIRT6 阳性表达组 PFS(51.23%)、OS(63.57%)高于阴性表达组 PFS(30.46%)、OS(44.25%),差异均具有统计学意义(< 0.05)(图 2 和图 3)。
3 讨论
口腔鳞癌是一种常见的恶性肿瘤,主要是由于基因表达异常并导致细胞内代谢紊乱、细胞结构及功能等发生改变进而促使细胞异常增殖最终形成恶性肿瘤[8]。目前临床主要采用手术结合放化疗的方法治疗口腔鳞癌,但效果不佳,因而需寻找早期诊断口腔鳞癌的标志物并提高治疗效果。近年来研究发现 LncRNA 与肿瘤的形成、侵袭密切相关,且 LncRNA 可通过调控侵袭及上皮间质转化蛋白(EMT)表达进而影响口腔鳞癌细胞的增殖与侵袭过程[9]。相关研究表明,SIRT6 表达异常与癌症的发生有关,SIRT6 下调可促进癌细胞的增殖与迁移[10]。目前 LncRNA 与 SIRT6 在口腔鳞癌中的研究相对较少,因此探究 LncRNA 与 SIRT6 在口腔鳞癌中的表达及其临床意义可为治疗口腔鳞癌新靶点的寻找提供理论依据。

表 3 口腔鳞癌组及正常组 SIRT6 蛋白表达
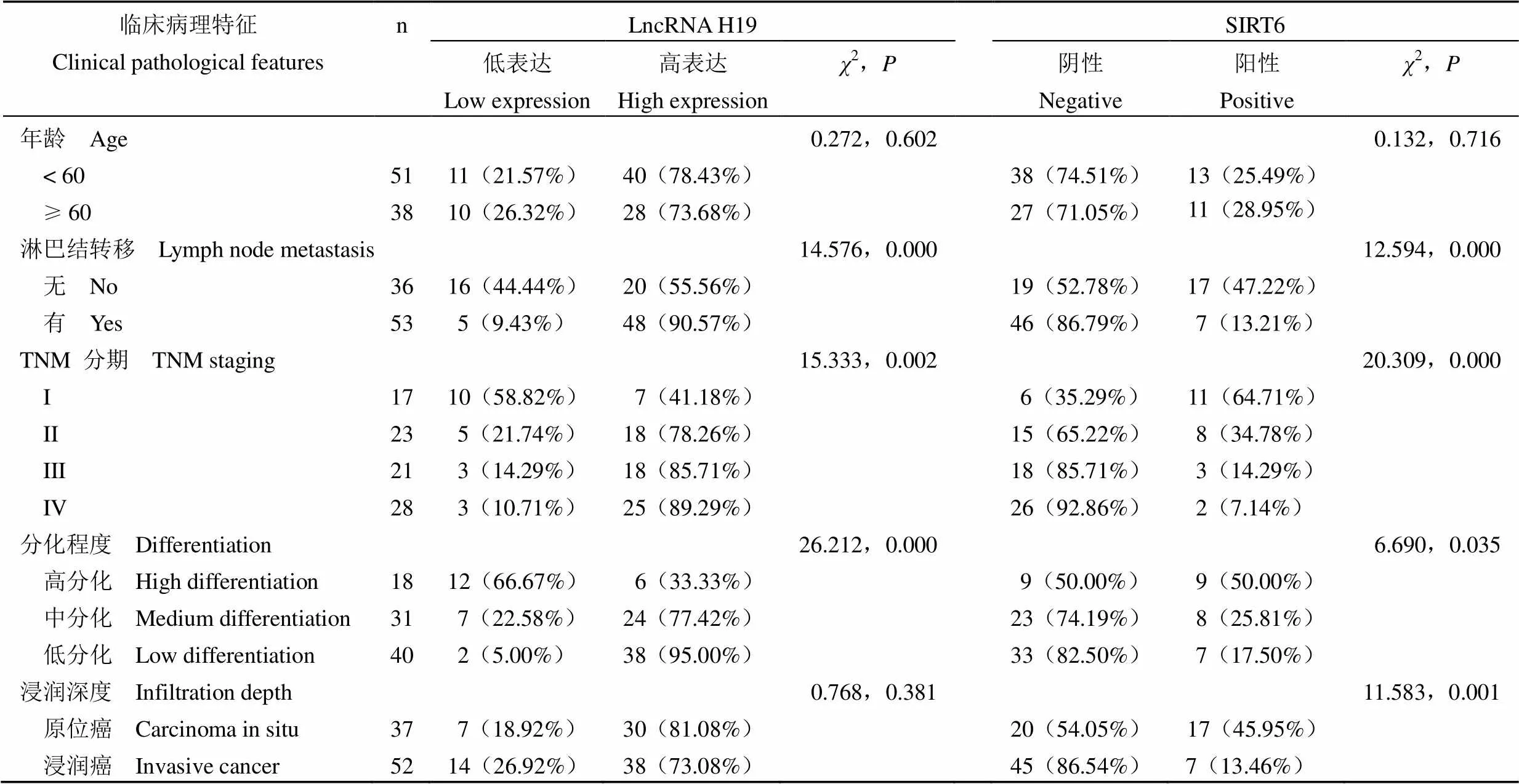
表 4 LncRNA H19、SIRT6 表达与患者临床病理特征的关系
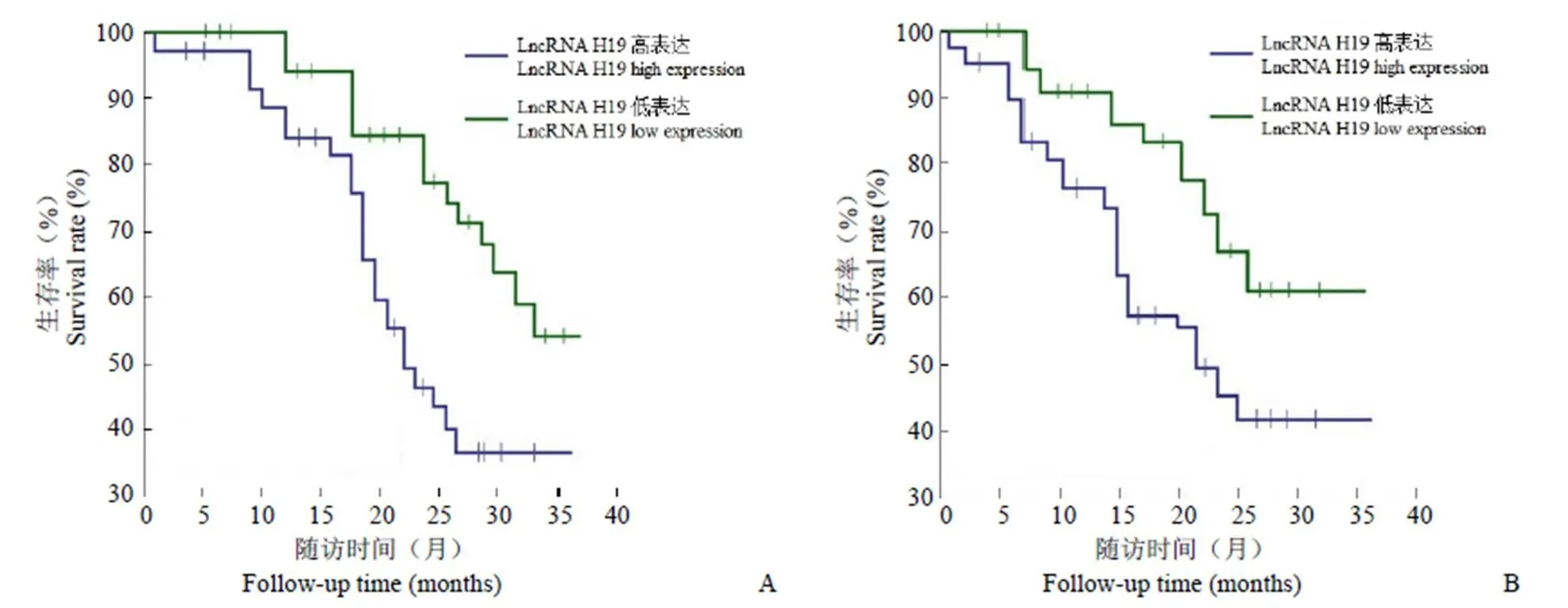
图 2 口腔鳞癌患者 LncRNA H19 表达与 PFS(A)、OS(B)的关系
Figure 2 Relationship between expression of LncRNA H19 and PFS (A) and OS (B) in patients with oral squamous cell carcinoma
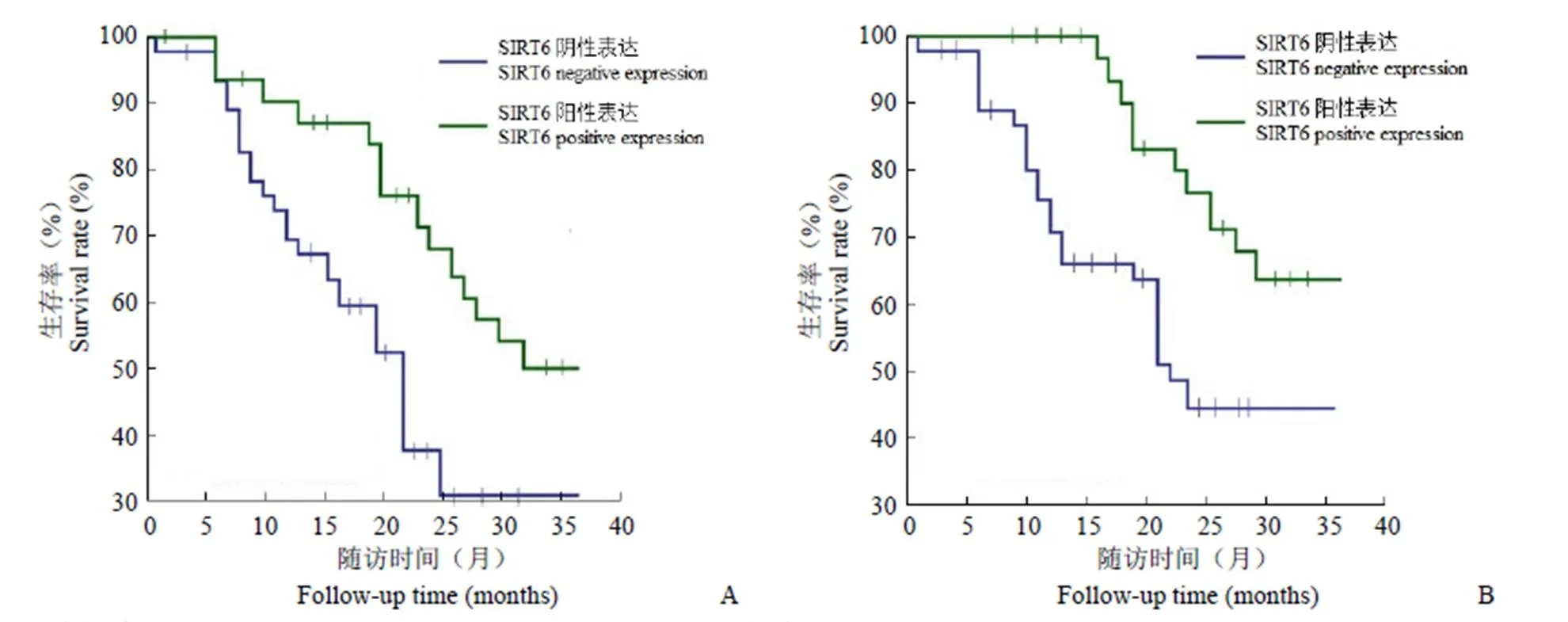
图 3 口腔鳞癌患者 SIRT6 表达与 PFS(A)、OS(B)的关系
Figure 3 Relationship between SIRT6 expression and PFS (A) and OS (B) in patients with oral squamous cell carcinoma
LncRNA H19 位于人类染色体 11P15.5,研究表明 LncRNA H19 可与其他调节基因相互作用并参与肿瘤的发生发展[11]。LncRNA H19 可在胃癌组织中高表达,可通过调控 ISM1、miR-675 的表达进而在胃癌进展中发挥作用[12]。研究表明,LncRNA H19 的印迹控制区中第 6 个 CTCF 结合位点高度甲基化可引起胰岛素样生长因子2(IGF2)基因的印迹缺失并提高其表达水平从而导致食管鳞状细胞癌的出现及浸润转移[13]。相关研究通过 RT-PCR 实验发现,LncRNA H19 在非小细胞肺癌组织中表达水平显著高于癌旁组织,并与肿瘤 TNM 分期、肿瘤大小及患者预后密切相关[14]。口腔鳞癌组织中 LncRNA H19 是否同样呈现高表达并同样发挥癌基因的功能呢?本研究通过实时定量 PCR 检测口腔鳞癌组织及癌旁组织中 LncRNA H19 的表达水平,结果显示口腔鳞癌组 LncRNA H19 表达水平显著高于正常组,说明口腔鳞癌组织中存在 LncRNA H19 的高表达。根据检测结果将 LncRNA H19 分为高表达组与低表达组,并观察其与口腔鳞癌患者临床病理特征的关系,结果显示 LncRNA H19 与淋巴结转移、TNM 分期、分化程度显著相关,说明 LncRNA H19 异常高表达在口腔鳞癌的发生与转移过程中发挥重要作用,且与病情进展程度密切相关。进一步分析发现,LncRNA H19 低表达组 PFS、OS 高于高表达组,说明口腔鳞癌组织中 LncRNA H19 高表达与患者预后不良有关。揭示检测 LncRNA H19 对预测口腔鳞癌的生物学行为与评估预后均具有重要的参考价值。
SIRT6 属于沉默配型信息调节蛋白家族,具有单核糖基转移酶与去乙酰化酶活性,不仅可参与炎症反应及多种代谢性相关疾病的发生过程,同时可参与癌症发生过程并可调控肿瘤生长[15]。研究表明 SIRT6 可通过与抑癌因子(泛素特异性蛋白酶 10)协同作用进而抑制肿瘤细胞的增殖分化,同时还 可调控肿瘤细胞中基因的表达及 DNA 修复等过程[16]。耿长辉等[17]研究发现,SIRT6 在结肠癌组织中蛋白表达水平显著降低,并对疾病进展具有抑制作用且与肿瘤分期密切相关。有报道显示 SIRT6 可调节 HIF-1ɑ 表达并启动 H3K9 去乙酰化进而延缓肿瘤进展[18]。本研究通过实时定量 PCR 与免疫组化法检测 SIRT6 在口腔鳞癌患者中的表达水平,结果显示口腔鳞癌组 SIRT6 mRNA 与蛋白表达水平均显著低于正常组,说明口腔鳞癌组织中 SIRT6 表达水平降低并可能发挥抑癌基因的作用。本研究比较分析 SIRT6 表达与患者临床病理特征的关系,结果显示 SIRT6 阴性表达与淋巴结转移、TNM 分期、分化程度及浸润深度显著相关,说明随着淋巴结转移、TNM 分期进展及浸润深度的恶化,SIRT6 蛋白表达被抑制。将口腔鳞癌患者与 SIRT6 表达的关系进行分析,结果显示阳性表达组 PFS、OS 高于阴性表达组,说明SIRT6 表达水平与患者预后密切相关。本研究结果揭示 LncRNA H19、SIRT6 异常表达与口腔鳞癌发生进展及患者预后不良有关,两者均可能成为早期诊断与治疗口腔鳞癌的研究靶点。
综上所述,口腔鳞癌LncRNA H19、SIRT6 表达水平与患者临床病理特征具有显著相关性,两者表达水平可成为预测患者肿瘤进展情况与评估预后的重要指标,可为提高口腔鳞癌的诊疗效果提供新的研究思路。关于 LncRNA H19、SIRT6 在口腔鳞癌中的具体作用机制有待进一步研究。
[1] He W, Xiao Y, Chen H, et al. Expression and significance of TGF-β1 and Smad4 in oral squamous cell carcinoma. Guangdong Med J, 2015, 36(8):1208-1210. (in Chinese)
何伟, 肖严, 陈欢, 等. TGF-β1与Smad4在口腔鳞癌组织中的表达及意义. 广东医学, 2015, 36(8):1208-1210.
[2] Pang K, Ran MJ, Zou FW, et al. Long non-coding RNA LINC00857 promotes gastric cancer cell proliferation and predicts poor patient survival. Oncol Lett, 2018, 16(2):2119-2124.
[3] Zhou X, Ye F, Yin C, et al. The interaction between MiR-141 and lncRNA-H19 in regulating cell proliferation and migration in gastric cancer. Cell Physiol Biochem, 2015, 36(4):1440-1452.
[4] Qi J, Cui CH, Chen RH, et al. Expression and clinical significance of SIRT6 in colorectal cancer. Acta Univ Med Anhui, 2017, 52(2):281- 285. (in Chinese)
齐佳, 崔春晖, 陈日红, 等. SIRT6在结直肠癌组织中的表达及其临床意义. 安徽医科大学学报, 2017, 52(2):281-285.
[5] Seki S, Fujiwara M, Matsuura M, et al. Prognostic value of podoplanin expression in oral squamous cell carcinoma--a regression model auxiliary to UICC classification. Pathol Oncol Res, 2014, 20(3): 521-528.
[6] Xiong GZ, Li HL, Sun XR, et al. Diagnosis and prediction of oral squamous cell carcinoma and precancerous lesions using DNA ploidy system. J Clin Stomatol, 2012, 28(7):446-447, after insert 1. (in Chinese)
熊贵忠, 李红丽, 孙小蓉, 等. 运用DNA倍体系统对口腔鳞癌及癌前病变进行诊断及预测. 临床口腔医学杂志, 2012, 28(7):446- 447, 后插1.
[7] Zhao ZJ, Yuan HW, Wei X, et al. Relations of epithelial-mesenchymal transition-related gene and their correlations with clinicopathological fea-tures in oral squamous cell carcinoma. J Clin Stomatol, 2014, 30(9):515-519. (in Chinese)
赵志娟, 袁宏伟, 韦玄, 等. 上皮间质转化相关基因在口腔鳞癌中的相关性及其与临床病理特征的关系研究. 临床口腔医学杂志, 2014, 30(9):515-519.
[8] Zhao SY, Wang J, Ouyang SB, et al. Salivary circular RNAs Hsa_Circ_0001874 and Hsa_Circ_0001971 as novel biomarkers for the diagnosis of oral squamous cell carcinoma. Cell Physiol Biochem, 2018, 47(6):2511-2521.
[9] Liu S, Zhou X, Wang XF, et al. Metastasis-associated lung adenocarcinoma transcript 1 modulates oral squamous cell carcinoma invasion in vitro and in vivo. Chin J Clin Oncol, 2015, 42(9):460-465. (in Chinese)
刘速, 周旋, 王晓非, 等. 长链非编码RNA MALAT1影响口腔鳞状细胞癌侵袭的实验研究. 中国肿瘤临床, 2015, 42(9):460-465.
[10] Kuqel S, Sebastián C, Fitamant J, et al. SIRT6 suppresses pancreatic cancer through control of Lin28b. Cell, 2016, 165(6):1401-1415.
[11] Liang WC, Fu WM, Wong CW, et al. The lncRNA H19 promotes epithelial to mesenchymal transition by functioning as miRNA sponges in colorectal cancer. Oncotarget, 2015, 6(26):22513-22525.
[12] Li H, Yu B, Li J, et al. Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer. Oncotarget, 2014, 5(8):2318-2329.
[13] Gao T, He B, Pan Y, et al. H19 DMR methylation correlates to the progression of esophageal squamous cell carcinoma through IGF2 imprinting pathway. Clin Transl Oncol, 2014, 16(4):410-417.
[14] Zhang E, Li W, Yin D, et al. c-Myc-regulated long non-coding RNA H19 indicates a poor prognosis and affects cell proliferation in non-small-cell lung cancer. Tumour Biol, 2016, 37(3):4007-4015.
[15] Lerrer B, Gertler AA, Cohen HY. The complex role of SIRT6 in carcinogenesis. Carcinogenesis, 2016, 37(2):108-118.
[16] Lee N, Ryu HG, Kwon JH, et al. SIRT6 depletion suppresses tumor growth by promoting cellular senescence induced by DNA damage in HCC. PLoS One, 2016, 11(11):e0165835.
[17] Geng CH, Zhang CL, Cao ZZ, et al. The correlation between SIRT6 expression and pathological features in patients with colon cancer. Chin J Colorec Dis (Electronic Ed), 2018, 7(1):52-56. (in Chinese)
耿长辉, 张春玲, 曹珍珍, 等. 结肠癌患者SIRT6表达与病理特征的相关性. 中华结直肠疾病电子杂志, 2018, 7(1):52-56.
[18] Liu C, Huang Z, Jiang H, et al. The sirtuin 3 expression profile is associated with pathological and clinical outcomes in colon cancer patients. Biomed Res Int, 2014, 2014:8171263.
The expressions and clinical significances of long non-coding RNA H19 and transcription factor SIRT6 in oral squamous cell carcinoma
WANG Hai-ye, ZHANG Yan-jing, MA Ying-yi
Department of Stomatology, The First Affiliated Hospital of Zhengzhou University, Henan 450052, China
To investigate the expressions and clinical significances of long non-coding RNA H19 (LncRNA H19) and transcription factor Sirtuin 6 (SIRT6) in oral squamous cell carcinoma.
89 cases of oral squamous cell carcinoma patients admitted to our hospital from November 2014 to May 2015 as the research objects, the surgical excised oral squamous cell carcinoma tissues were used as the oral squamous cell carcinoma group, and the para cancerous tissues were used as the normal group. Real time quantitative PCR was used to detect the expression levels of LncRNA H19 and SIRT6. The expression of SIRT6 protein was examined by immunohistochemical method and clinical and pathological data were collected. LncRNA H19 was divided into high expression group and low expression group according to the median value of test results. The relationships between LncRNA H19 and SIRT6 expressions with clinicopathological characteristics were observed. Kaplan-Meier survival curve and Log-Rank test were used to analyze the influences of the relative expressions of LncRNA H19 and SIRT6 on the prognosis of the patients.
Compared with the normal group, the expression level of LncRNA H19 in oral squamous cell carcinoma group was significantly higher (< 0.05) and the expression of SIRT6 mRNA and protein decreased significantly (< 0.05). LncRNA H19 and SIRT6 were significantly correlated with lymph node metastasis, TNM stage and degree of differentiation (< 0.05). Kaplan-Meier analysis showed that PFS and OS in LncRNA H19 low expression group were significantly higher than those in high expression group (< 0.05), PFS and OS in SIRT6 positive expression group were significantly higher than those in negative expression group (< 0.05).
LncRNA H19 is highly expressed in oral squamous cell carcinoma tissues, while SIRT6 is low expressed. Both of these two factors are related to the occurrence, development and prognosis of oral squamous cell carcinoma, and they can be potential targets for early diagnosis and treatment of oral squamous cell carcinoma.
Oral squamous cell carcinoma; Long non-coding RNA H19; Sirtuin 6
MA Ying-yi, Email: mayingjiao@126.com
麻颖宜,Email:mayingjiao@126.com
2018-07-26
10.3969/j.issn.1673-713X.2018.06.007
