高产花生四烯酸的高山被孢霉菌株发酵条件优化
2018-12-11顾晓颖王文思赵丹丹李凌飞
顾晓颖,王文思,陈 家,赵丹丹,李凌飞*
(1.云南农业大学食品科学技术学院,云南昆明 650201;2.云南省农业科学院农业经济与信息研究所,云南昆明 650205)
【研究意义】花生四烯酸(Arachidonic acid,ARA或 AA),即全顺-5,8,11,14-二十碳四烯酸,属于 ω-6系列PUFAs,是人体三大必需脂肪酸之一,具有卓越的药用价值和营养保健功能,目前已广泛应用于医药、食品、饲料等领域[1]。传统来源的ARA非常有限,还需面对资源枯竭、环境污染和提取成本高等现实问题[2],已无法满足日益增长的市场需求。微生物发酵生产ARA可以克服传统来源的缺点,是制备ARA的新途径[3]。高山被孢霉(Mortierlla alpina)是发酵生产ARA的商业菌株,其菌丝中含有大量PUFAs,以ARA为主,占 PUFAs总量的68.5% ~78.8%[4]。此外,安全性评估认定 M.alpina及其发酵产品是安全可食用的[5]。优化发酵条件是提高M.alpina ARA产量最简单有效的方法,但菌株间的差异导致最佳发酵条件普适性差。因此,优化发酵条件仍是目前M.alpina的研究热点,亦是M.alpina高产ARA的瓶颈。【前人研究进展】M.alpina生长可用碳源有葡萄糖、木糖、乳糖、可溶性淀粉、蔗糖、甘油等,可用有机氮源有尿素、豆粕粉、酵母浸粉等,可用无机氮源有硝酸钾、硝酸钠、硫酸铵、氯化铵等。一些研究对M.alpina的培养基及发酵条件进行了优化,菌体生物量和ARA产量都有不同程度的提高[6-8]。【本研究切入点】生物量的积累是以养分的吸收为基础的,其能反映养分的吸收状况[9]。ARA属于M.alpina的胞内代谢物,生物量和ARA产量密切相关,项目前期研究结果,M.alpina菌丝中ARA含量与菌体生物量呈显著正相关(r=0.609,n=180,P <0.001)。本试验以前期筛选出的3株ARA高产菌株为对象,以菌体生物量为主要考核指标,对M.alpina的发酵条件进行优化研究。【拟解决的关键问题】以期获得较高的菌体生物量和ARA产量,为利用M.alpina工业化生产ARA奠定基础。
1 材料与方法
1.1 菌种
高山被孢霉(M.alpina):项目前期筛选出的3株高产ARA的菌株(D1、N24和11f01)。
1.2 培养基
斜面培养基:PDA培养基;种子培养基:葡萄糖30 g/L,酵母提取物 6 g/L,KH2PO43 g/L,NaNO33 g/L,MgSO4·7H2O 0.5 g/L,pH 自然;基础发酵培养基:葡萄糖80 g/L,酵母提取物11 g/L,KH2PO43.8 g/L,NaNO33.4 g/L,MgSO4·7H2O 0.5 g/L,pH 自然。
以上培养基均经过121℃灭菌20 min。
1.3 培养方法
1.3.1 菌种活化 将常温石蜡油封存的菌株转接于PDA斜面培养基,室温培养7 d。
1.3.2 种子培养 挑取少量活化后的菌丝于装有50 mL种子培养基的250 mL三角瓶中,150 r/min,25℃摇瓶培养3 d。
1.3.3 发酵培养 从种子培养液中挑取10~15个直径为1~2 mm的菌球,接种于装有100 mL发酵培养基的500 mL三角瓶中,25℃,150 r/min培养7 d,每个样做3个重复。
1.3.4 碳源种类优化 控制基础发酵培养基其他条件不变,分别以葡萄糖80 g/L、乳糖80 g/L、蔗糖80 g/L为碳源进行单因素实验。
1.3.5 氮源种类优化 在确定最佳碳源基础上,分别以酵母浸粉、NaNO3、(NH4)2SO4、KNO3、NH4NO3、NH4Cl(按相同总氮量计算)为氮源进行单因素实验。
1.3.6 发酵培养基的优化 根据优化出的最佳碳氮源种类,按表1设计4因素3水平正交试验。
1.3.7 生长温度优化 最佳培养基配方确定后,分别于15、20、25、30 ℃条件下发酵 M.alpina以确定最佳生长温度。
1.4 实验方法
1.4.1 菌体生物量的测定 将发酵获得的菌丝体真空抽滤后,用去离子水洗涤菌体3次,菌体置-20℃预冻过夜后真空冷冻干燥3 d,测得菌体生物量(干重)。
1.4.2 ARA含量分析 准确称取50 mg干菌体粉末于具盖试管中,加入1 mL甲苯,2 mL 1%的硫酸甲醇,1 mL C17∶0正己烷标样(浓度为 1 mg/mL;十七烷酸标品纯度为99%,购自Sigma公司),混匀后置于50℃水浴过夜。冷却后加入5%NaCl水溶液,混匀后加入正己烷萃取2次,合并上清液(正己烷)。再加入2%KHCO3水溶液清洗,收集上清液氮气吹干。获得的脂质复溶于1 mL含0.05%BHT的正己烷溶液中,过滤后待测。
采用气相色谱-质谱连用仪(GC-MS)进行脂肪酸的定性和定量分析(安捷伦5975C-7890A)。设置参数:色谱柱Hp-5Max(30 m×0.25 mm),载气为氦气,流速1 mL/min;色谱条件:进样口温度为250℃,分流进样,进样体积 1 μl,分流比 50∶1,柱起始温度80℃,保持3 min,然后以20℃/min升至180℃,保持1 min,再以1℃/min升至210℃保持5 min,最后以5℃/min升至240℃保持8 min。按照标准谱库对菌体中脂肪酸进行定性分析,以C17∶0为参照内标,根据峰面积对ARA进行定量分析。
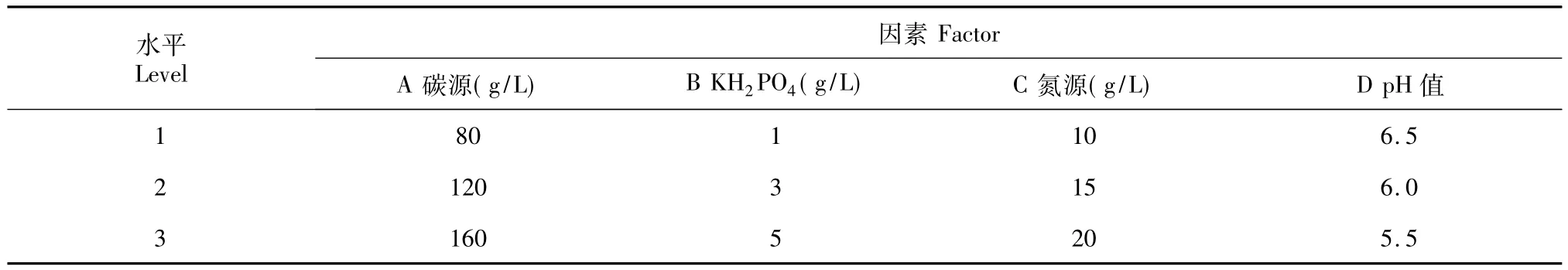
表1 L9(34)正交优化设计Table 1 Orthogonal design

表2 高山被孢霉菌丝中脂肪酸含量Table 2 Fatty acid contents in mycelia of M.alpina
1.4.3 统计分析 利用SPSS 19.0统计软件对同一菌株不同碳源/氮源之间,以及同种碳源/氮源不同菌株之间的菌体生物量进行单因素方差分析,并进一步采用SNK法进行两两比较。
2 结果与分析
2.1 3株高产ARA的高山被孢霉菌株脂肪酸含量分析
如表2所示,3株M.alpina菌丝中均含大量脂肪酸,总脂肪酸含量可达菌丝干重的45%,且所含脂肪酸种类丰富,组成合理。菌丝中脂肪酸包括饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。单不饱和脂肪酸主要为 C16∶0和 C18∶0,是合成各个不饱和脂肪酸的前体;单不饱和脂肪酸作为PUFAs合成过程的中间体,主要以 C18∶1为主;PUFAs(C18∶2,C18∶3,C20∶3和 C20∶4) 是菌丝中的主要脂肪酸种类,其含量可高达总脂肪酸含量的50%,而 ARA(即C20∶4)作为主要的 PUFAs,在 D1、N24 和 llf01 菌丝中分别为 141.39、152.01 和 111.71 mg/g,在 PUFAs中所占比例可达64%。

图1 不同碳源对高山被孢霉菌体生物量的影响Fig.1 Effect of different carbon sources on the biomass of M.alpina

表3 不同碳源发酵时高山被孢霉菌体生物量的单因素方差分析Table 3 One-way ANOVA of the biomass of M.alpina with different carbon sources
2.2 3种碳源对3株高山被孢霉菌体生物量的影响
3株菌的最佳碳源均为葡萄糖(图1),同一菌株3种碳源发酵时菌体生物量统计分析的结果表明,3种碳源对每株菌的生物量均有显著影响(表3)。D1菌株以葡萄糖为碳源时,所获生物量显著高于蔗糖,且蔗糖显著大于乳糖;N24菌株与11f01菌株一样,以葡萄糖为碳源,所获生物量显著大于蔗糖和乳糖,但蔗糖和乳糖间无显著差异(图1)。同一种碳源3个菌株之间生物量的统计分析结果表明,每一种碳源对3株菌的生物量也都具有显著影响(表3)。以葡萄糖为碳源,D1和N24菌株的生物量显著高于11f01;以蔗糖为碳源,N24和llf01生物量显著高于D1菌株;而以乳糖为碳源,N24生物量显著高于llf01,且llf01显著高于D1(图1)。

图2 不同氮源对M.alpina生物量的影响Fig.2 Effect of different nitrogen sources on the biomass of M.alpina
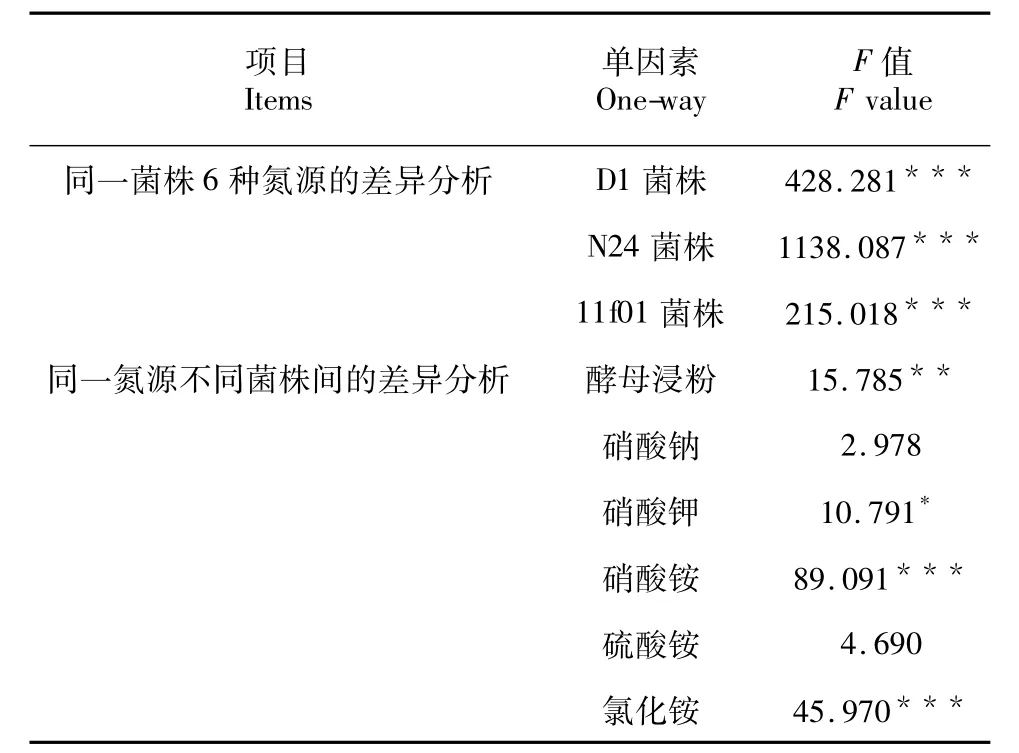
表4 不同氮源发酵时M.alpina生物量的单因素方差分析Table 4 One-way ANOVA of the biomass of M.alpina with different nitrogen sources
2.3 6种氮源对3株高山被孢霉菌体生物量的影响
3株菌的最佳氮源均为酵母浸粉(图2),同一菌株6种氮源发酵时菌体生物量统计分析表明:6种氮源对每株菌的生物量均有显著影响(表4),D1菌株以酵母浸粉为氮源时,其生物量显著高于硝酸铵,硝酸铵显著高于硝酸钾、硫酸铵、氯化铵,以硝酸钠为氮源时生物量最低;N24菌株以酵母浸粉为氮源时其生物量显著高于硝酸铵,硝酸铵显著高于硝酸钠、硝酸钾、硫酸铵(后3种氮源所获生物量无显著差异),以氯化铵为氮源时生物量最低;11f01菌株以酵母浸粉为氮源所获生物量最高,其次为硝酸铵,硝酸钾和氯化铵无显著差异,以硝酸钠为氮源时生物量最低(图2)。同一种氮源3个菌株之间生物量的统计分析结果表明,每一种氮源对3株菌的生物量均有显著影响(表4),以酵母浸粉为氮源,N24菌株生物量显著大于D1,且D1显著大于llf01;以硝酸钠和硫酸铵为氮源,3株菌生物量无统计学差异;以硝酸钾和氯化铵为氮源,llf01菌株生物量显著大于D1和N24;以硝酸铵为氮源,D1菌株生物量显著大于N24,且N24显著大于llf01(图2)。
2.4 培养基的优化
上述单因素实验结果表明,不同碳、氮源对M.alpina菌体生长有较大影响。据报道,KH2PO4浓度及发酵液初始pH值对菌株生长也有较大影响,因此本试验在上述最佳碳源葡萄糖、最佳氮源酵母浸粉的基础上,再选取初始pH值及KH2PO4进行L9(34)正交试验。
2.4.1 D1菌株的培养基优化 表5为D1菌株培养基优化L9(34)正交实验结果。数据分析显示:4个因素对D1菌株生物量影响大小依次为酵母浸粉>KH2PO4>初始 pH值 >葡萄糖。最佳组合为A2B1C2D3,即D1菌株的最佳培养基配方:葡萄糖120 g/L;KH2PO41 g/L;酵母浸粉15 g/L;初始pH 5.5。其中葡萄糖浓度为基础培养基的1.5倍,KH2PO4浓度由原先的3.8下降至1。
2.4.2 N24菌株的培养基优化 表6为N24菌株培养基优化L9(34)正交实验结果。数据分析显示:4个因素对N24菌株生物量影响大小依次为初始pH值>酵母浸粉>KH2PO4>葡萄糖。最佳组合为A2B1C3D2,即N24菌株的最佳培养基配方:葡萄糖120 g/L;KH2PO41 g/L;酵母浸粉20 g/L;初始pH6.0。于最优配方条件下发酵M.alpina进行验证,所获菌体生物量为26.70 g/L,相比表6中最高值(25.96 g/L)提高了 2.9%。
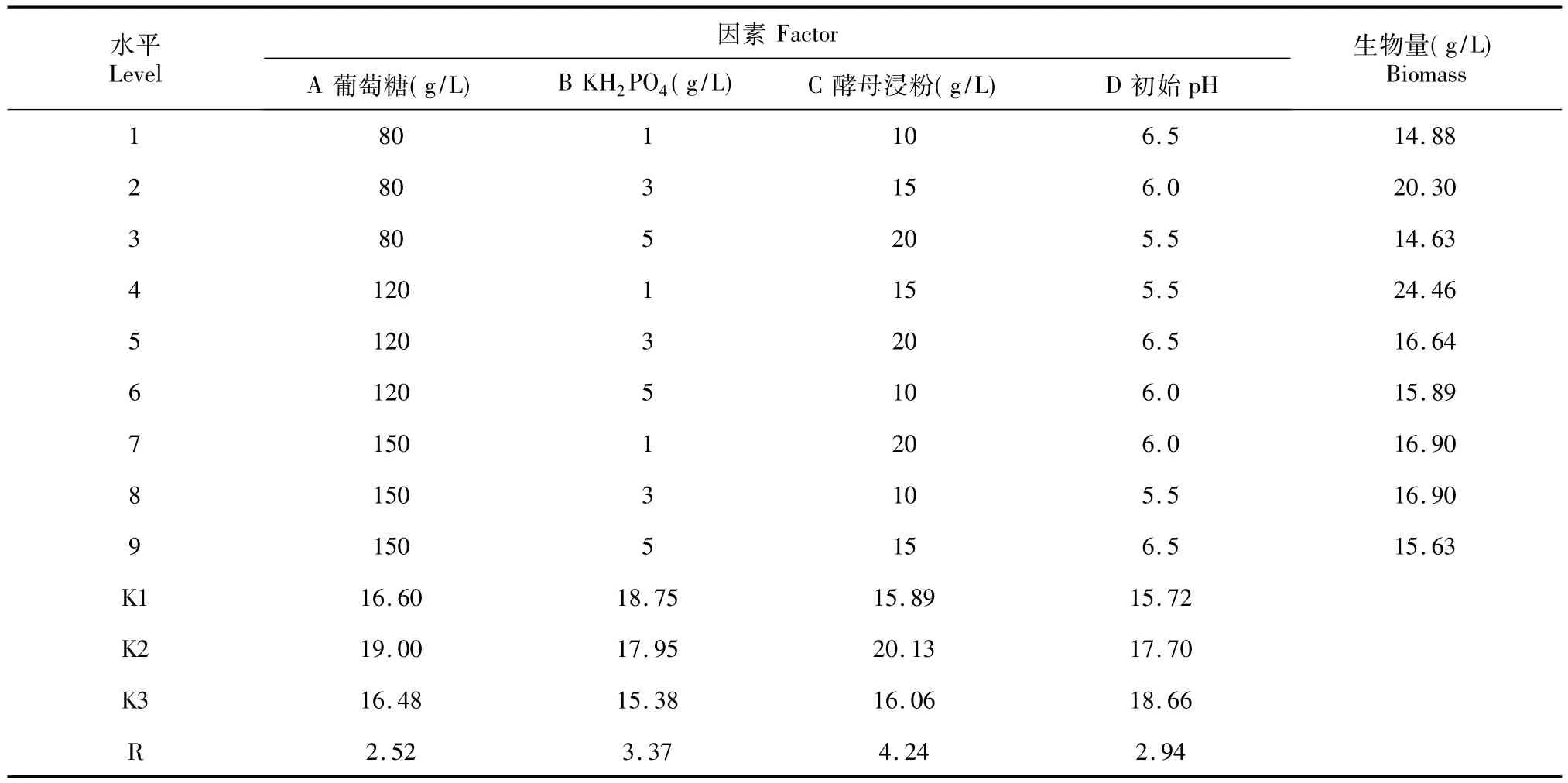
表5 D1菌株培养基优化L9(34)正交实验Table 5 The orthogonal experiment L9(34)for optimization of culture medium of D1 strain

表6 N24菌株培养基优化L9(34)正交实验Table 6 The orthogonal experiment L9(34)for optimization of culture medium of N24 strain
2.4.3 11f01菌株的培养基优化 表7为11f01菌株培养基优化L9(34)正交实验数据和结果。数据分析显示:4个因素对11f01菌株生物量影响大小依次为KH2PO4>酵母浸粉>初始pH值>葡萄糖。最佳组合为A2B1C2D2,即11f01菌株的最佳培养基配方:葡萄糖120 g/L;KH2PO41 g/L;酵母浸粉15 g/L;初始pH 6.0。于最优配方条件下发酵M.alpina进行验证,所获菌体生物量为22.20 g/L,相比表7中最高值(21.30 g/L)提高了4.2%。
2.5 发酵温度优化
基于上述最优培养基配方,于不同温度下发酵M.alpina。结果表明发酵温度对菌株生物量影响显著。各菌株的生物量均随温度的升高呈现先升高后降低的趋势,不同温度所获生物量大小顺序为20℃ >25℃ >15℃ >30℃(图3)。统计分析结果表明,同一温度下,3株菌的生物量均有显著差异(P值均小于0.001,表8)。同一温度下不同菌株的生物量方差分析结果表明,当温度为15、20和25℃,D1、N24菌株生物量均显著大于llf01;而温度为30℃时,3株菌的生物量无统计学差异(图3,表8)。
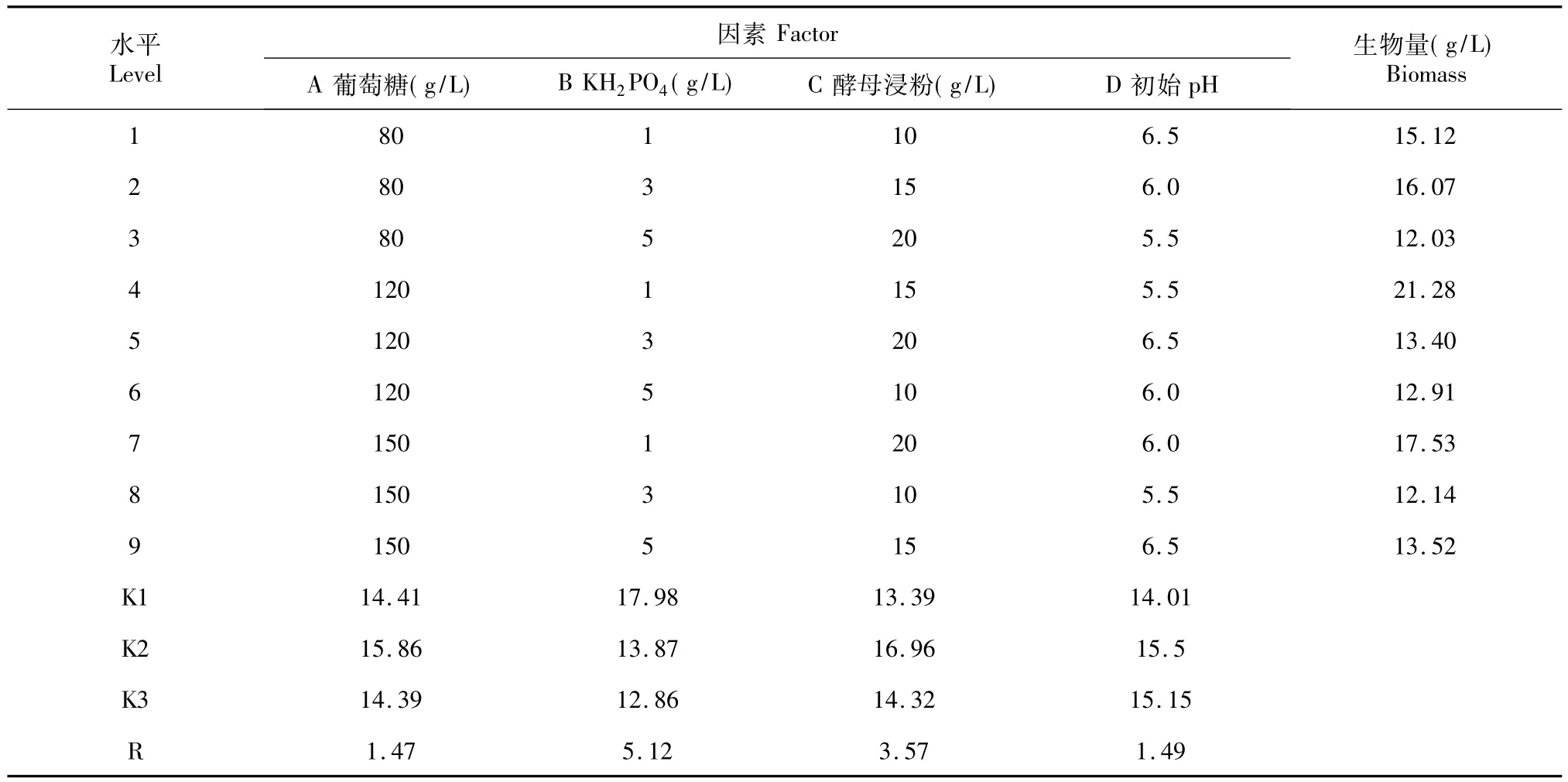
表7 11f01菌株培养基优化L9(34)正交实验Table 7 The orthogonal experiment L9(34)for optimization of culture medium of 11f01 strain
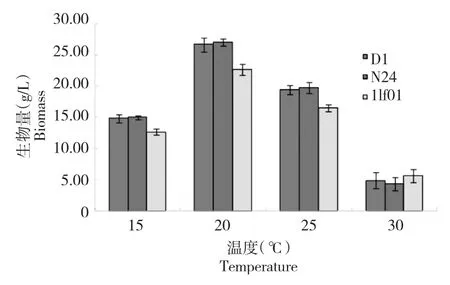
图3 不同温度对M.alpina菌体生物量的影响Fig.3 Effect of different temperature on the biomass of M.alpina
2.6 最优发酵条件验证
于最优条件下发酵M.alpina,3株菌的生物量均与模型理论值接近。D1菌株生物量由21.86 g/L增加至26.67 g/L,增加了22.0%;N24菌株生物量由 23.46 g/L 增加至 27.07 g/L,增加了 15.39%;11f01菌株生物量由18.75 g/L增加至23.20 g/L,增加了23.73%。
GC-MS测定脂肪酸含量,3株菌菌丝中ARA产量变化如下:D1菌株ARA产量由3.09 g/L增至4.29 g/L,增长率为38.79%;N24菌株ARA产量由3.57 g/L 增至 4.39 g/L,增长率为 23.16%;11f01菌株ARA产量由 2.09 g/L增至3.45 g/L,增长率为 64.59%。
3 讨论
3.1 碳源对高山被孢霉菌体生物量的影响
霉菌可利用的碳源很多,如葡萄糖、蔗糖、乳糖、淀粉糖化液、糖蜜、果糖等。本研究结果表明M.alpina生长的最适碳源为葡萄糖,此结果与Nisha[10]和 Chatzifragkou[11]的研究结果一致。M.alpina 能较好地利用葡萄糖而非其他碳源进行菌丝增殖生长,其原因可能是葡萄糖相比其他碳源更易被直接利用,这增加了菌株对葡萄糖的同化效率以至获得更高的菌体生物量。
3株菌发酵生产的最适葡萄糖浓度均为120 g/L。当葡萄糖浓度过高时(160 g/L),培养液渗透压增大,粘度升高,不利于氧气和营养物质的传递;当葡萄糖浓度过低时(80 g/L),细胞生长可能受到抑制过早进入衰退期。
3.2 氮源对高山被孢霉菌体生物量的影响
氮源分为无机氮源和有机氮源,不同种类和不同浓度的氮源都能影响代谢产物合成的方向和产量[8]。Lu[12]等在不同氮源条件下发酵 M.alpina,发现以酵母提取物为氮源时,获得最高生物量和总脂肪酸产量,以硝酸钠为氮源有利于ARA积累,但所获生物量较低。M.alpina可利用的氮源有硝酸盐、铵盐、豆粕粉、氨基酸、酵母浸粉、尿素等。本研究结果表明酵母浸粉是发酵M.alpina的最适氮源,此结果与一些研究一致[13-14],其原因可能是酵母浸粉作为较复杂的有机氮源,其不仅为M.alpina的生长提供氮元素,还可能提供维生素、无机盐等微量元素。
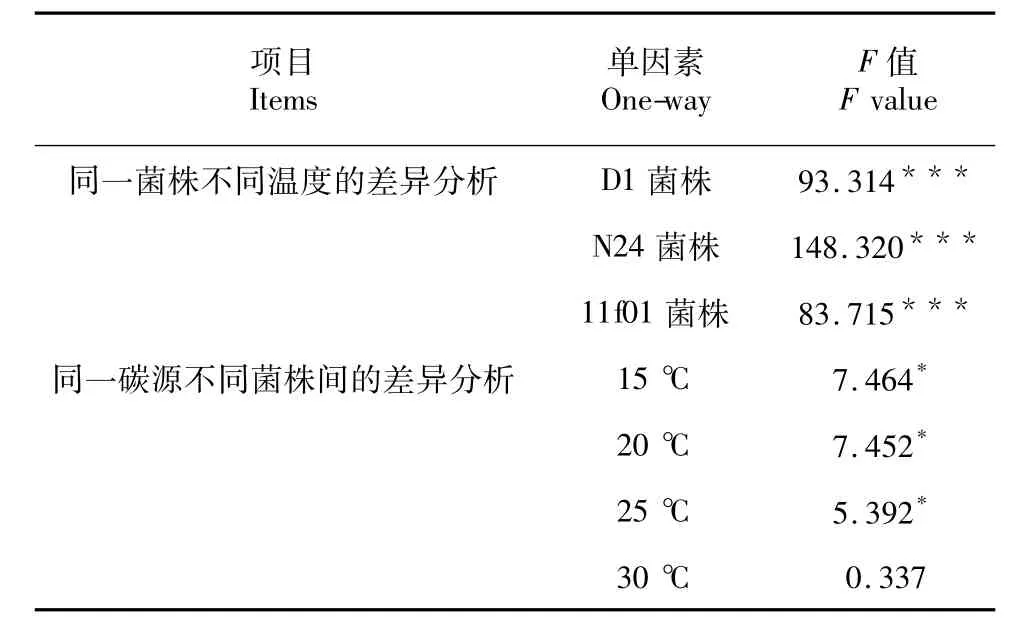
表8 不同温度发酵时高山被孢霉菌体生物量的单因素方差分析Table 8 One-way ANOVA of the biomass of M.alpina with different temperature
3.3 KH2PO4对高山被孢霉菌体生物量的影响
矿物盐主要影响细胞壁的电荷,会造成菌丝形态的改变[15],而菌丝形态与菌株生长状况密切相关。Higashiyama[16]等研究了矿物盐对ARA产量的影响,发现当培养基中含有Na2SO4、CaCl2、MgCl2而无KH2PO4时,主要菌体形态成2~3 mm的大球型,颗粒壁的传质限制导致菌球中心菌丝的自溶,生物量降低。这可能是因为菌株能利用KH2PO4中的磷合成结构组织和大量聚合磷酸盐。本研究选择了3个 KH2PO4浓度(1、3、5 g/L)对培养基进行优化,结果表明3株菌均是KH2PO41 g/L为最佳浓度。范益春[17]等发现在磷限制条件下发酵 M.alpina,发酵周期缩短、生物量和总脂肪酸含量增加,这进一步验证了本研究结果。
3.4 初始pH对高山被孢霉菌体生物量的影响
发酵pH对M.alpina的生长具有较大影响。郑志达[18]等研究发现在pH 6.0时所获菌体生物量最大,其次为pH 5.5,pH对油脂中ARA比例无影响,弱酸性有利于菌株生长和油脂积累。邓中涛[19]等研究发现在pH 5.5~6.5时所获菌株生物量和油脂含量差异不显著,当pH 7.5时会抑制菌株对葡萄糖的吸收,菌体生物量和油脂含量最低,弱酸性有利于菌株生长和油脂积累。Li[20]等的研究认为pH为5.5时有利于菌株生长,而pH 6.5时有利于油脂的积累。本研究的结果表明,pH 5.5或pH 6.0是菌株生长的最适pH,不同菌株间的最佳pH值存在细微差别。
3.5 温度对高山被孢霉菌体生物量的影响
一些研究表明低温能促进产油微生物积累更多的PUFA,但会抑制微生物的生长。本研究结果20℃是M.alpina生长的最适发酵温度。当发酵温度低于20℃时,菌丝生长受到抑制。其原因可能是较低温度不利于菌株吸收利用葡萄糖,导致整个发酵过程中菌株生长缓慢;此外,菌株在低温条件下存在更长的延滞期,这也是生物量降低的因素之一[21]。M.alpina生长是一个高需氧的过程,发酵液溶氧能力会随着温度的升高缓慢降低,当温度达到25℃或高于25℃时,发酵液中低的溶氧量会抑制菌株生长,导致菌体生物量降低。
3.6 优化后获得的M.alpina生物量与ARA产量
在本研究中,优化后3株M.alpina菌株的生物量分别为 26.67、27.07 和 23.02 g/L,增幅达 22.0%、15.39% 和 23.73%;ARA 含量分别为 4.29、4.39 和 3.45 g/L,增幅达 38.79%、23.16% 和64.59%。与有些研究相比,生物量和ARA含量增加幅度不高[6-7],其原因主要是这 3株菌株是从151株菌中筛选出的高产ARA的菌株,生物量和ARA含量提升的空间有限。沈以凌[8]等对M.alpina发酵生产ARA的培养基配方及发酵条件进行优化,获得较高的菌体生物量和ARA产量,分别为26.95和4.86 g/L,本研究优化后 M.alpina的生物量和ARA含量与之相当。
4 结论
通过研究M.alpina的发酵条件,发现碳源、氮源、KH2PO4、pH值、发酵温度均对菌体生物量有重要影响。M.alpina发酵的最佳碳源为葡萄糖,最佳氮源为酵母浸粉,较低浓度的KH2PO4和弱酸性(pH 5.5~6.0)有利于菌株生长,最适发酵温度为20℃。3株菌的最佳发酵培养基配方仅酵母浸粉和pH值存在细微差别。通过发酵条件的优化,3株菌的菌体生物量和ARA含量均有明显提高。
