以HIV-1 IN-LEDGF/p75相互作用为靶点的抑制剂筛选
2018-12-11许晓双张大为
许晓双,张大为
以HIV-1 IN-LEDGF/p75相互作用为靶点的抑制剂筛选
许晓双,张大为
213001 常州,江苏理工学院生物信息与医药工程研究所
晶状体上皮源性生长因子 p75 蛋白(LEDGF/p75)与 HIV-1 整合酶(IN)之间的蛋白-蛋白相互作用是开发抗 HIV-1 药物的有效靶点,本文旨在寻找以 HIV-1 IN-LEDGF/p75 相互作用为靶点的小分子抑制剂。
采用均相时间分辨荧光技术(HTRF)筛选了 799 个化合物,比对 IN-LEDGF/p75 相互作用的抑制活性。
发现 5 个化合物——肾上腺酮、6-溴-1,2-二氢萘-1,2-二酮、头孢噻吩、根皮含柘树呫吨酮 L 和迷迭香酸对该相互作用表现出不同程度的抑制作用,其 IC50值分别为 12.3、22.7、26.2、18.5 和 1.13 μmol/L。
为 HIV-1 IN-LEDGF/p75 相互作用抑制剂的发现以及新的抗 HIV-1 药物的开发提供了重要基础。
HIV 整合酶; HIV 整合酶抑制剂; LEDGF/p75; 均相时间分辨荧光技术; 蛋白-蛋白相互作用
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是引起获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)的病原体。HIV 属于逆转录病毒科()慢病毒属(),是一类潜伏期很长的病毒。人群中流行的 HIV 病毒主要有 2 种亚型:HIV-1 和 HIV-2。HIV-1 具有较高的毒力,更容易传播同时也导致了全球大多数国家的 HIV 感染[1]。目前,针对该病毒缺乏有效的疫苗或者治愈手段,而针对病毒复制不同阶段开发的化学治疗药物仍然是防治艾滋病的有效途径[2]。
HIV-1 整合酶(integrase,IN)介导逆转录后形成的病毒 DNA 与宿主细胞基因组的整合,是病毒复制所必需的关键酶,也是研究抗艾滋病药物的重要靶标[3]。目前,经美国 FDA 批准上市的 IN 抑制剂有 3 个,包括雷特格韦(raltegravir,RAL)、埃替格韦(elvitegravir,EVG)和度鲁特韦(dolutegravir,DTG),均为 IN 链转移反应抑制剂(integrase strand transfer inhibitors,INSTIs)[4-5]。随着 3 种 INSTIs 在临床的应用,针对它们的耐药性突变病毒株已经出现[6]。因此,寻找新的作用机制靶点以开发新的 IN 抑制剂显得尤为迫切和重要。
HIV-1 自身编码的蛋白质数量有限,需要依赖宿主细胞蛋白及其信号通路完成自身复制。其中参与整合的宿主蛋白称为整合辅因子(integration cofactors,INCFs)[7]。目前,研究最为清楚的 INCF 为晶状体上皮源性生长因子 p75 蛋白(lens epithelium-derived growth factor,LEDGF/p75)[8]。LEDGF/p75 也是首个被发现的能与 HIV-1 IN 发生蛋白-蛋白相互作用(protein-protein interaction,PPI)的宿主蛋白。该 PPI 主要由 LEDGF/p75 蛋白 C 端 IN 结合区(integrase-binding domain,IBD)与 HIV-1 IN 催化核心区(catalytic core domain,CCD)作用形成,研究表明该蛋白-蛋白相互作用是开发抗 HIV-1 药物的有效靶点[8]。
目前,尽管文献已经报道了许多 HIV-1 IN-LEDGF/p75 相互作用抑制剂,但还没有一个该类抑制剂上市用于抗病毒治疗。因此,积极寻找和设计新的 HIV-1 IN-LEDGF/p75 相互作用抑制剂,具有重要的临床意义和广阔的应用前景。本文以 HIV-1 IN-LEDGF/p75 相互作用为靶点,采用均相时间分辨荧光(homogeneous time resolved fluorescence,HTRF)技术,筛选了 799 个化合物抑制相互作用的活性,旨在寻找更多的 HIV-1 IN-LEDGF/p75 相互作用的抑制剂,为开发新的抗 HIV-1 药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 大肠杆菌()菌株 BL21(DE3)购自北京全式金生物技术有限公司;pMD-18-T 载体购自宝生物工程(大连)有限公司;表达载体 pET28a、pGEX-4T-1、重组质粒 pET28a-IN-dm(表达 N 端融合 6 × His 标签含有 F185K/C280S 可溶型双突变 IN)和 pGEX-4T-p75(表达 N 端融合 GST 标签的 p75 蛋白)由本实验室保存。
1.1.2 试剂与仪器 小分子化合物购自国家小分子化合物资源中心,其中399 个来自 InterBioScreen 公司(简称IB)的活性化合物库,400 个来自 BioBioPha 公司(简称BBP)的结构类型多样的天然产物库;Ni-NTA 与 GST 纯化柱填料购自常州天地人和生物科技有限公司;Anti-6His-XL665 受体磁珠和 Anti-GST-Cryptate 供体磁珠购自法国 Cisbio 公司;384 孔聚丙烯浅孔微孔板和 Envision 2102 multilabel reader 多功能酶标仪购自美国Perkin Elmer 公司;BE-9008 微孔板恒温振荡器购自其林贝尔仪器制造有限公司。
1.2 方法
1.2.1 GST-IBD 的表达纯化 以构建好的重组质粒 pGEX-4T-p75 为母本质粒,PCR 扩增 p75 IBD 结构域(第 347-429 为氨基酸残基)表达序列,克隆至表达载体 pGEX-4T-1 的H I-I 位点。正确构建的含 p75 IBD 编码基因的重组表达质粒命名为 pGEX-4T-IBD,然后转化至BL21(DE3),培养过夜挑取单个克隆,37 ℃振荡培养过夜,按 1:100 的比例扩大培养至对数中期,0.5 mmol/L IPTG 30 ℃诱导表达 3 h,收集菌体。裂解液[50 mmol/L Tris-HCl(pH 7.2),500 mmol/L NaCl,1 mmol/L DTT,1 mmol/L EDTA,1 mmol/L PMSF]重悬菌体,超声破菌,离心收集上清。利用GST 琼脂糖凝胶 FF 亲和色谱柱纯化 LEDGF/p75融合蛋白。用洗脱 buffer[50 mmol/L Tris-HCl(pH 8.0),500 mmol/L NaCl,1 mmol/L DTT,20 mmol/L 还原型谷胱甘肽]洗脱目的蛋白,具体纯化步骤参考文献[9]。采用 SDS-PAGE 检测蛋白表达纯化,BCA 法测定蛋白质含量。
1.2.2 IN-HIS 的表达纯化 以重组质粒 pET28a-N-IN-dm 为母本质粒,PCR 扩增 IN CCD 结构域(第 50-212 为氨基酸残基)表达序列,克隆至表达载体 pET28a 的I-I 位点。正确构建的含 IN CCD 编码基因的重组表达质粒命名为 pET28a-IN-CCD,然后转化至BL21(DE3),培养过夜挑取单个克隆,37 ℃振荡培养过夜。按照 1:100 的比例扩大培养至对数中期,1 mmol/L IPTG 30 ℃诱导表达 4 h,收集菌体。裂解液[20 mmol/L HEPES(pH 7.3),1 mol/L NaCl,2 mmol/L β-ME,10% 丙三醇,0.1% NP-40]重悬菌体,超声破菌,离心收集上清。利用 Ni-琼脂糖凝胶 6FF 亲和色谱柱纯化 IN-HIS 融合蛋白。用洗脱 buffer[20 mmol/L HEPES(pH 7.3),1 mol/L NaCl,2 mmol/L β-ME,10% 丙三醇,250 mmol/L 咪唑]洗脱目的蛋白,检测方法同 1.2.1。
1.2.3 基于 HTRF 的 IN-IBD 相互作用抑制剂的筛选方法 当 C-端带有 His标签的 HIV-1 IN(IN-HIS)和 N 端带有 GST 标签的 IBD(GST-IBD)蛋白相互作用时(空间距离小于10 nm),Anti-6His-XL665 受体磁珠和Anti-GST-Cryptate 供体磁珠也会相应靠近,从而发生共振能量转移(FRET)现象[10]。供体磁珠荧光分子的激发将诱发受体分子发出荧光,同时供体荧光分子自身的荧光强度衰减。当抑制剂分子阻断 IN-HIS 和 GST-IBD 的相互作用时,FRET 现象减弱。因此 FRET 现象的强弱可以反映抑制剂分子对两个蛋白相互作用抑制作用的强弱,从而该方法可以用于 IN 与 IBD 相互作用抑制剂的筛选。
HTRF 实验在 384 孔板进行,所用蛋白和化合物均用反应 buffer[25 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,1 mg/ml BSA,0.1% NP40,2 mmol/L MgCl2]稀释。将以下成分加入 384 孔板中:4 μl 50 nmol/L IN、4 μl 25 nmol/L IBD、2 μl 化合物,混匀后 25 ℃、200 r/min 反应 30 min。然后加入 5 μl 0.8 nmol/L 的 GST-Cryptate 供体磁珠和 5 μl 4 nmol/L 的 Anti-6His-XL665 受体磁珠(含 100 mmol/L KF),混匀后 25 ℃,200 r/min 反应 1 h。使用多功能酶标仪,以 320 nm 为激发光,读取 665 nm 和 620 nm 处的发射光。以 BI-224436 作为阳性对照。
1.2.4 Z 因子的测定 为了评价所构建的 HTRF 筛选 GST-IBD 与 IN-HIS 相互作用抑制剂方法的质量与稳定性,分别测定了 Z 因子、信号窗(signal window,SW)和 CV 等主要参数。当 Z 因子> 0.5、SW > 2、CV < 20% 时,该筛选方法的结果正确可信。此外,高通量筛选方法的信号噪音比(signal-to-ratio,S/N)> 10,信号背景比(signal-to-background,S/B)值> 3,该高通量筛选方法才具有高灵敏度和高特异性。Z 因子、S/N、S/B 的计算公式如下:
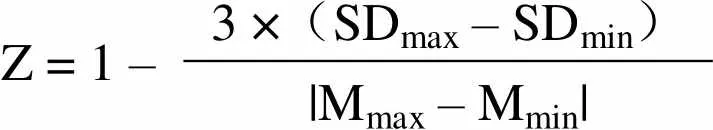
Z = 1 –3 ×(SDmax– SDmin) |Mmax– Mmin|

S/N =Mmax– Mmin SDmin

S/B =Mmax Mmin
Mmax:最大信号值的平均值;Mmin:最小信号值的平均值;SDmin:最小信号值的标准偏差;SDmax:最大信号值的标准偏差。
1.3 数据处理
分别计算各孔 665 nm 和 620 nm 处荧光强度的比值(Ration 665/620),并计算各孔的相对抑制率。活性样品进行浓度稀释后检测相对抑制率,使用软件 Graphpad 6.0 作图计算半数抑制浓度 IC50值。
2 结果
2.1 GST-IBD 与 IN-HIS 的表达纯化结果
图 1A 为 GST-IBD 在大肠杆菌 BL21(DE3)中的表达结果,GST-IBD 在经 0.5 mmol/L 的 IPTG 诱导后,目的蛋白(36.89 kD)蛋白量明显增多,通过 GST 柱纯化,并用 20 mmol/L 谷胱甘肽洗脱检测得到 GST-IBD 蛋白,蛋白条带清晰可见,没有非特异性条带,以 BSA 作为标准品,使用 BCA 法测得 GST-IBD 蛋白的浓度约为 0.28 mg/ml。
图 1B 为IN-HIS 在大肠杆菌 BL21(DE3)中的表达结果,IN-HIS 在经 1 mmol/L 的 IPTG 诱导后,蛋白(32.96 kD)表达量明显增多,通过 Ni-NTA 柱纯化,并用 250 mmol/L 咪唑洗脱检测得到 IN-HIS 蛋白,蛋白条带清晰可见,没有非特异性条带,以 BSA 作为标准品,使用 BCA 法测得 IN-HIS 蛋白的浓度约为 0.37 mg/ml。
2.2 HTRF 方法稳定性分析
Z 因子、信号窗(SW)和 CV 是评价药物筛选方法均一性和稳定性的重要参数。如图 2 所示,Z 因子、SW 值、CV 值分别为 0.89、21.05、4.09%,符合 Z 因子 > 0.5、SW > 2、CV < 20%,说明筛选结果是正确可信的;S/N 与 S/B 的值分别为 172.07 与 3.83,符合 S/N > 10,S/B > 3,说明该筛选方法具有高灵敏度和高特异性。
2.3 IB 库中 IN-LEDGF/p75 抑制剂筛选结果
将 IB 库中 399 个化合物进行抑制 IN-LEDGF/p75 活性筛选,每个化合物初筛体系终浓度为 50 μmol/L,重复 2 次。初筛结果显示,化合物肾上腺酮(adrenalone)、6-溴-1,2-二氢萘-1,2-二酮(bonaphton)、头孢噻吩(cefalotin)对 IN-LEDGF/p75 抑制活性均达到 90% 以上。将这 3 个化合物在反应体系中的终浓度以 50 μmol/L 作为起始浓度进行倍比稀释,测定3 个化合物对 IN-LEDGF/p75 的抑制百分率,通过非线性拟合得到 IC50值(图 3 ~图 5)。结果显示,肾上腺酮、6-溴-1,2-二氢萘-1,2-二酮、头孢噻吩的 IC50值分别为 12.3、22.7和 26.2 μmol/L。
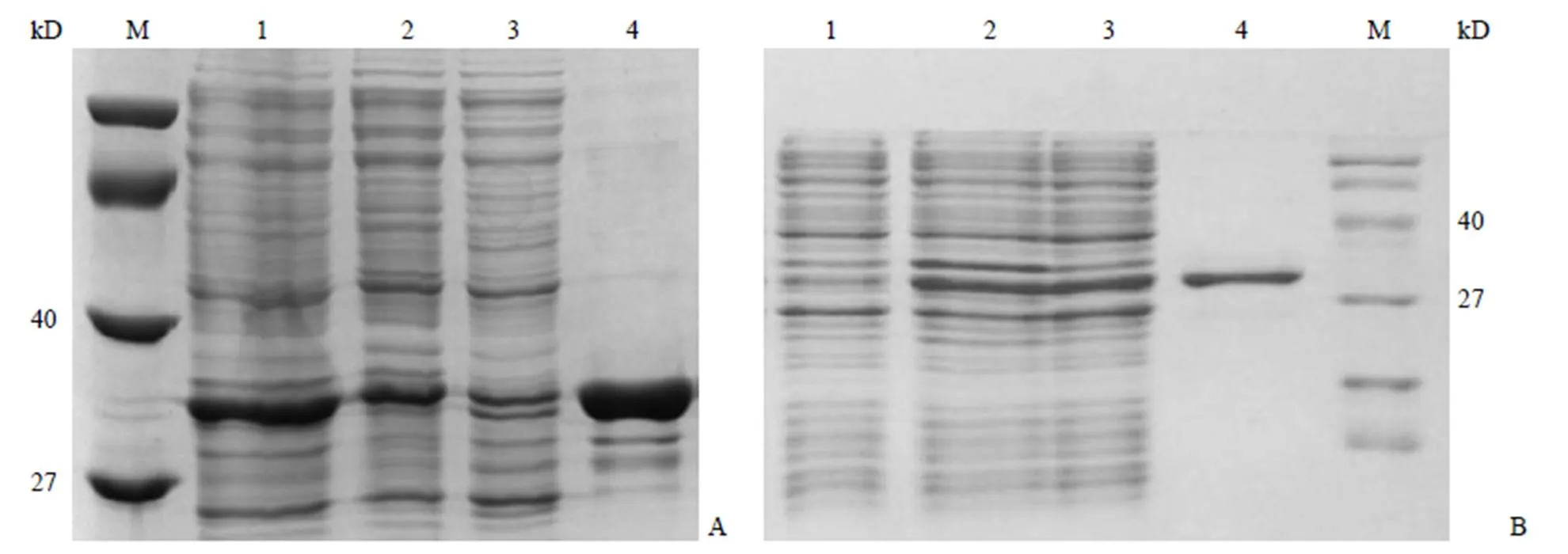
图 1 SDS-PAGE 检测 GST-IBD 与 IN-HIS 的表达纯化结果[A:GST-IBD(M:分子量标准;1:上清;2:诱导后;3:诱导前;4:20 mmol/L GSH洗脱);B:IN-HIS(1:诱导前;2:诱导后;3:上清;4:250 mmol/L 咪唑洗脱;M:分子量标准)]
Figure 1 Expression and purification results of GST-IBD and IN-HIS were detected by SDS-PAGE [A: GST-IBD (M: Marker;1: Supernatant; 2: After induction; 3: Before induction; 4: 20 mmol/L GSH elution); B: IN-HIS (1: Before induction; 2: After induction; 3: Supernatant; 4: 250 mmol/L imidazole elution; M: Marker)]
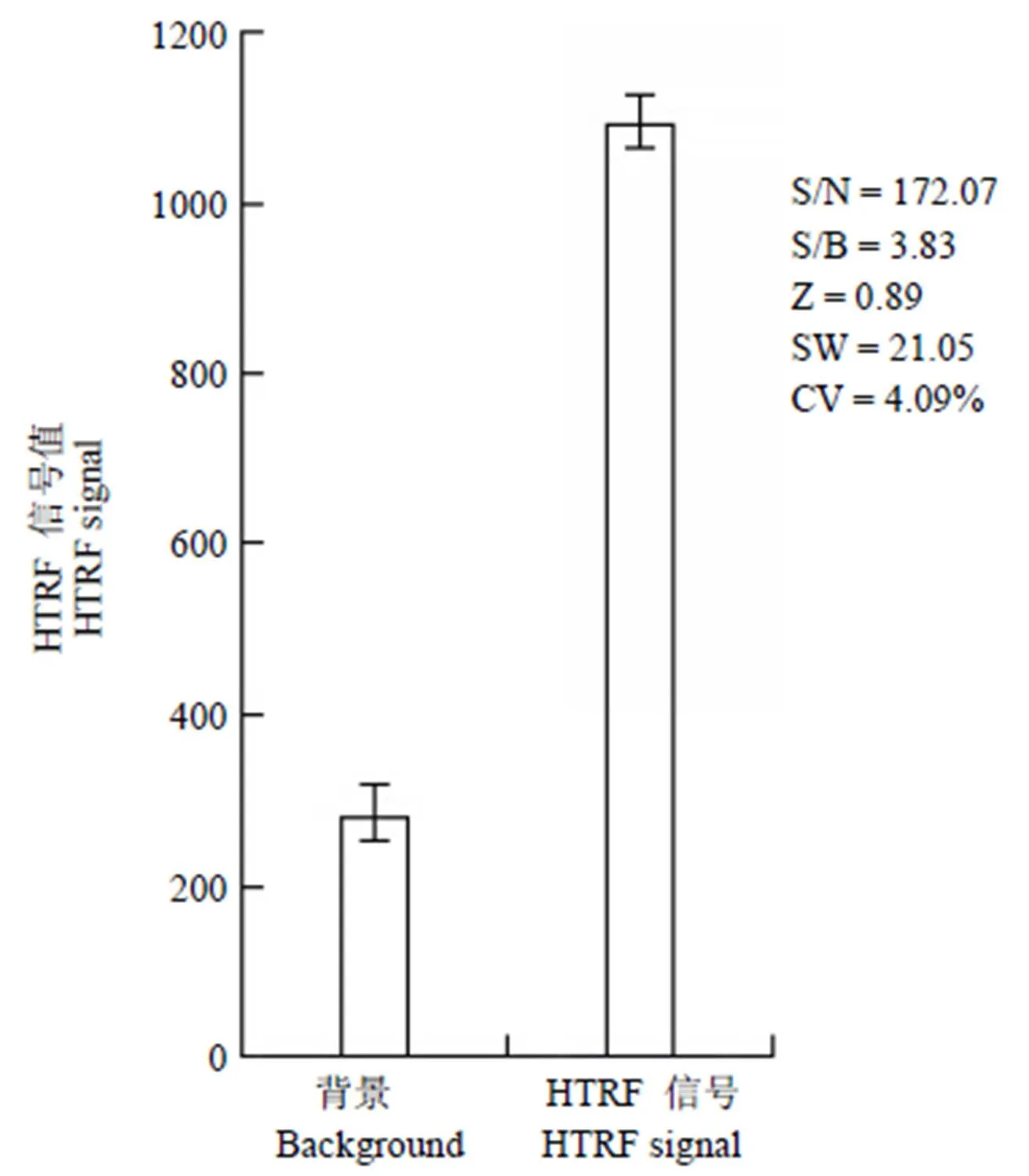
图 2 HTRF 测试 GST-IBD 与 IN-HIS 相互作用方法评价结果
Figure 2 Evaluation results of GST-IBD and IN-HIS interaction by HTRF
2.4 BBP 库中 IN-LEDGF/p75 抑制剂筛选结果
同样,将 BBP 库中 400 个化合物进行抑制 IN-LEDGF/p75 活性筛选,每个化合物初筛体系终浓度为 50 μmol/L,重复 2 次。初筛结果显示,化合物根皮含柘树呫吨酮 L(cudraxanthone L)与迷迭香酸(rosmarinic acid)对 IN-LEDGF/p75 抑制活性均达到 90% 以上。将这 2 个化合物在反应体系中的终浓度以 50 μmol/L 作为起始浓度进行倍比稀释,测定 2 个化合物对 IN-LEDGF/p75 的抑制百分率,通过非线性拟合得出 2 个化合物对 IN-LEDGF/p75 抑制的 IC50值(图 6 和图 7)。结果显示,根皮含柘树呫吨酮 L 和迷迭香酸的 IC50值分别为 18.5 和 1.13 μmol/L。

图 3 化合物肾上腺酮的 IC50(A)与化学结构式(B)
Figure 3 IC50(A) and chemical structure formula (B) of compound adrenalone
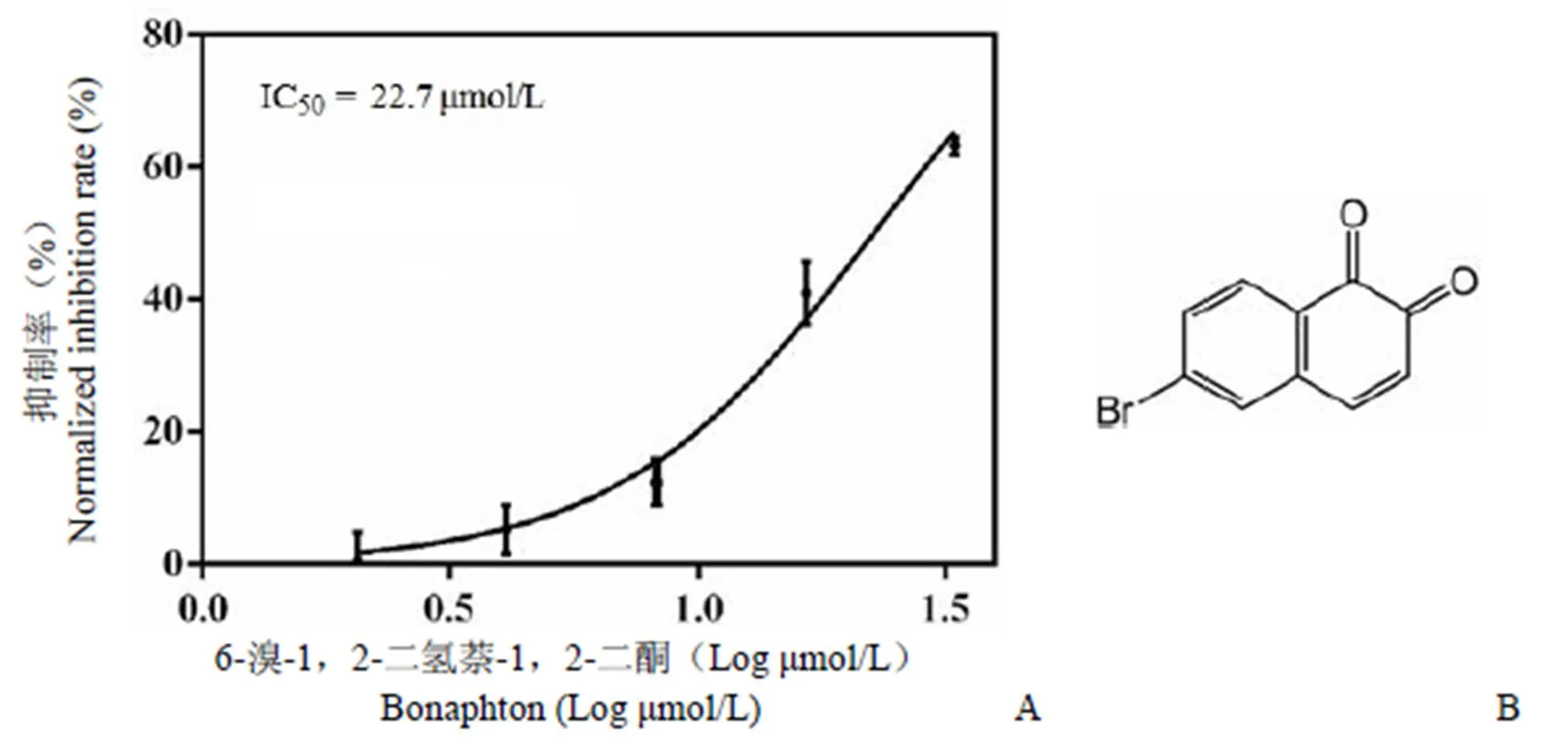
图 4 化合物6-溴-1,2-二氢萘-1,2-二酮的 IC50(A)与化学结构式(B)
Figure 4 IC50(A) and chemical structure formula (B) of compound bonaphton

图 5 化合物头孢噻吩的 IC50(A)与化学结构式(B)
Figure 5 IC50(A) and chemical structure formula (B) of compound cefalotin

图 6 化合物根皮含柘树呫吨酮 L 的 IC50(A)与化学结构式(B)
Figure 6 IC50(A) and chemical structure formula (B) of compound cudraxanthone L

图 7 化合物迷迭香酸的 IC50(A)与化学结构式(B)
Figure 7 IC50(A) and chemical structure formula (B) of compound rosmarinic acid
3 讨论
HIV-1 IN-LEDGF/p75 蛋白之间的相互作用对于 IN 进入细胞核以及染色体定位是必需的,是筛选抗病毒药物的重要靶点[8]。晶体结构显示,二聚化的整合酶 CCD 形成的结合口袋与 LEDGF/p75 的 IBD 发生了相互作用。研究表明,抑制 CCD-IBD 相互作用的小分子化合物也能够抑制它们各自全长蛋白,即 IN 和 LEDGF/p75 之间的相互作用。因此,本文采用全长的 IN 与 IBD 之间的相互作用来进行 IN-LEDGF/p75 之间的相互作用筛选。
肾上腺酮是两栖纲、爬行纲、鸟纲和哺乳类中的啮齿目动物的主要糖皮质激素,具有调节应激反应、免疫反应的功能。此外,肾上腺酮还是目前公认的心脏复苏首选药的合成前体[11]。6-溴-1,2-二氢萘-1,2-二酮是一种新的抗病毒化疗药物。研究表明,6-溴-1,2-二氢萘-1,2-二酮能明显降低鼻内接种 A2 型流感(香港)68 病毒的小鼠的严重致死率[12]。头孢噻吩临床上作为耐青霉素金葡菌(耐甲氧西林者除外)所致的呼吸道感染、软组织感染、尿路感染、败血症等的选用药物[13],可用于 AIDS 引起的细菌感染。根皮含柘树呫吨酮 L 为氧杂蒽酮类化合物,广泛存在于一些天然中草药中,具有利尿、抗微生物、抗病毒、强心、抗结核、抗癌、抗肝毒等药理活性[14]。目前未见关于这 4 个化合物具有抑制 IN-LEDGF/p75 相互作用的活性的报道。因此,本研究首次报道了这 4 个化合物具有抑制IN-LEDGF/p75 相互作用的活性。
迷迭香酸广泛分布于唇形科、紫草科、葫芦科等植物资源中,具有抗菌消炎、抑制 HIV 整合酶、抑制透明质酸酶、抗抑郁、抗血栓、抗肿瘤等药理作用[15]。Tewtrakul 等[16]发现,提取于紫苏的迷迭香酸在体外抑制 HIV-IN 活性的 IC50值为5 μmol/L,而本文发现迷迭香酸在体外抑制 IN-LEDGF/p75 相互作用的 IC50为 1.13 μmol/L,表明迷迭香酸是一种蛋白-蛋白相互作用抑制剂,为发现 HIV-1 IN-LEDGF/p75 相互作用抑制剂提供了重要基础。
[1] Gilbert PB, Mckeague IW, Eisen G, et al. Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal. Stat Med, 2003, 22(4):573-593.
[2] Zhang X. Anti-retroviral drugs: current state and development in the next decade. Acta Pharm Sin B, 2018, 8(2):131-136.
[3] Dayam R, Al-Mawsawi LQ, Neamati DN. HIV-1 integrase inhibitors: an emerging clinical reality. Drugs R D, 2007, 8(3):155-168.
[4] Hazuda DJ. HIV integrase as a target for antiretroviral therapy. Curr Opin HIV AIDS, 2012, 7(5):383-389.
[5] Hazuda DJ, Felock P, Witmer M, et al. Inhibitors of strand transfer that prevent integration and inhibit HIV-1 replication in cells. Science, 2000, 287(5453):646-650.
[6] Métifiot M, Vandegraaff N, Maddali K, et al. Elvitegravir overcomes resistance to raltegravir induced by integrase mutation Y143. AIDS, 2011, 25(9):1175-1178.
[7] Van Maele B, Busschots K, Vandekerckhove L, et al. Cellular co-factors of HIV-1 integration. Trends Biochem Sci, 2006, 31(2):98- 105.
[8] Maertens G, Cherepanov P, Pluymers W, et al. LEDGF/p75 is essential for nuclear and chromosomal targeting of HIV-1 integrase in human cells. J Biol Chem, 2003, 278(35):33528-33539.
[9] De Rijck J, Vandekerckhove L, Gijsbers R, et al. Overexpression of the lens epithelium-derived growth factor/p75 integrase binding domain inhibits human immunodeficiency virus replication. J Virol, 2006, 80(23):11498-11509.
[10] Wang HJ, Zhou ZH, Xu JC, et al. HTRF-based method for determination of HSP90-HOP inhibition activity and its application. Acta Pharm Sinica, 2017, 52(4):592-597. (in Chinese)
王慧洁, 周子涵, 徐嘉辰, 等. 基于均相时间分辨荧光技术(HTRF)的HSP90-HOP相互作用抑制剂活性测试方法的构建及其应用. 药学学报, 2017, 52(4):592-597.
[11] Fotopoulou MA, Ioannou PC. Post-column terbium complexation and sensitized fluorescence detection for the determination of norepinephrine, epinephrine and dopamine using high-performance liquid chromatography. Anal Chimica Acta, 2002, 462(2):179-185.
[12] Nikolaeva IS, Kutchak SN, Bogdanova NS, et al. Pathomorphological study of antiviral chemotherapeutic effectiveness of bonaphthon under experimental conditions. Farmakol Toksikol, 1976, 39(3):336-341.
[13] Carranza-Torres JM, Vargas-Daza ER, Villarreal-Ríos E, et al. Effectiveness of the scheme reimpregnation maintenance schedule vs. ceftazidime/cephalothin in dialysis patients with peritonitis. Nefrologia, 2016, 36(4):448-450.
[14] Lian SS. Research progress on xanthones. Guangdong Chem Ind, 2014, 41(2):46-47. (in Chinese)
连双双. 氧杂蒽酮类化合物的研究进展. 广东化工, 2014, 41(2):46- 47.
[15] You R, Ma XQ, Wu BH, et al. Advance in pharmacological effects of Rosmarinic Acid. Sichuan J Physiol Sci, 2015, 37(2):93-96. (in Chinese)
尤茹, 马雪倩, 吴炳火, 等. 迷迭香酸药理作用研究进展. 四川生理科学杂志, 2015, 37(2):93-96.
[16] Tewtrakul S, Miyashiro H, Nakamura N, et al. HIV-1 integrase inhibitory substances from Coleus parvifolius. Phytother Res, 2003, 17(3):232-239.
Screening of inhibitors targeting HIV-1 IN-LEDGF/p75 interaction
XU Xiao-shuang, ZHANG Da-wei
Institute of Bioinformatics and Medical Engineering, Jiangsu University of Technology, Changzhou 213001, China
The protein-protein interaction between the cellular chromatin associated protein lens epithelium-derived growth factor (LEDGF/p75) and the HIV-1 integrase (IN) is an effective target for the development of anti-HIV-1 drugs. This work aims to find small molecular inhibitors targeting the HIV-1 IN-LEDGF/p75 interaction.
The inhibitory activity of 799 compounds (from 2 compounds libraries: InterBioScreen and BioBioPha) on the interaction of IN-LEDGF/p75 was screened by a homogeneous time resolved fluorescence (HTRF)-based assay.
It was found that five compounds, adrenalone, bonaphton, cefalotin, cudraxanthone L and rosmarinic acid, showed different inhibitory effect on the interaction of HIV-1 IN-LEDGF/p75, and their IC50values were 12.3, 22.7, 26.2, 18.5 and 1.13 μmol/L, respectively.
This work provides an important basis for the discovery of HIV-1 IN-LEDGF/p75 interaction inhibitors and the development of new anti-HIV-1 drugs.
HIV integrase; HIV integrase inhibitors; LEDGF/p75; Homogeneous time resolved fluorescence; Protein-protein interaction
ZHANG Da-wei, Email: zhangdw517@gmail.com
国家自然科学基金(31700297)
张大为,Email:zhangdw517@gmail.com
2018-07-09
10.3969/j.issn.1673-713X.2018.06.003
