microRNA 调控自噬在骨肉瘤化疗耐药中作用的研究进展
2018-12-11王鹏郭世炳
王鹏 郭世炳
作者单位:010059 呼和浩特,内蒙古医科大学研究生学院 ( 王鹏 );010030 呼和浩特,内蒙古医科大学第二附属医院 ( 郭世炳 )
骨肉瘤 ( osteosarcoma,OS ) 是青少年最常见的原发性恶性骨肿瘤,它好发于长骨的干骺端,而股骨远端和胫骨近端的发病率占其 50%。其每年发病率为 3 / 100 万,其中男女比例为 1∶1.4[1-2]。OS 易通过血液转移到其它器官,尤其肺部。少数情况下可转移到大脑、前列腺和其它组织[3-4]。新辅助化疗联合手术已成为治疗 OS 的主要治疗方式,常用的新辅助化疗药物包括顺铂 ( DDP )、阿霉素 ( ADM )、甲氨蝶呤 ( MTX ) 和异环磷酰胺 ( IFO )[5]。随着新辅助化疗的开展,OS 患者 5 年生存率已从 20% 提高至 75%,转移率和病死率已得到很大程度降低。但由于不同个体之间 OS 细胞对化疗药物的敏感性不同而使化疗效果并不理想,并且随着药物长时间的使用,OS 患者会产生化疗耐药[6]。由于化疗耐药的产生会导致疾病的复发和转移,这就对 OS 患者化疗之后的临床疗效提出了挑战。研究报道 OS 的化疗耐药是由多水平、多因素、多基因和多信号通路参与调控的复杂过程,其中包括线粒体改变、DNA 修复、细胞自噬、上皮间质转化 ( EMT )、miRNA 调控等[7]。近期研究发现自噬、microRNA 和 OS 化疗耐药性形成密切相关。因此笔者将通过“Osteosarcoma”、“Chemoresistance”、“Autophagy”、“microRNA”等作为关键词,利用计算机检索数据库 Pubmed 和 EMBASE,重点回顾关于自噬、microRNA 在 OS 发生及化疗中作用研究进展,以进一步揭示 OS 化疗耐药产生以及发展的潜在分子机制。现报告如下。
一、自噬
自噬是一种细胞自我吞噬的代谢途径,它通过降解和回收细胞内受损的细胞器、长期存在和错误折叠的蛋白质,来维持细胞内稳态和正常的细胞功能[8]。除了维持细胞再生的正常生理状态外,自噬也参与多种病理过程,包括肿瘤进展及耐药性、代谢紊乱、神经退变与肺部疾病等[9]。
1. 自噬过程概述:激活自噬过程的信号通常来自不同的应激条件,如饥饿、缺氧、氧化应激、蛋白质聚集等。这些信号通路的共同靶点是 ULK1 复合物 ( 包括 ULK1、ATG13、FIP200 和 ATG101 ),同时诱导 Beclin1 和 Bcl-2的磷酸化来促进 PI3K 复合物 III ( 包括 PI3K、VPS34、Beclin1、ATG14、AMBRA1、p115 ) 的形成。这两种复合物对于形成吞噬泡是必需的,该吞噬泡是一种双层膜结构,其可延伸成囊泡 ( 自噬体 )。接下来可以局部激活PI3P 中的 ER 结构,PI3P 进而通过其结合域可与 PI3P 受体蛋白 WD ( WIPI2 和 DFCP1 ) 结合[10]。最近研究表明WIPI2 可直接与 ATG16L1 结合,从而吸引 ATG12-ATG5-ATG16L1 复合物的形成,可增强了 ATG3 介导的 ATG8 家族蛋白 ( ATG8s ) 的表达,进而促进膜结合形成脂质体。ATG8 家族蛋白不但能够吸引合成自噬相关的因子而且满足了吞噬泡隔离膜的延长及关闭[11]。在 ATG4、ATG7 和ATG3 的作用下,LC3 转变为 LC3-II-PE 并紧密结合于吞噬泡隔离膜表面,吞噬泡隔离膜最终被封闭成双膜囊泡,形成自噬体。一些生物膜 ( 质膜、线粒体和高尔基复合物 ) 可促进自噬体膜的延伸,部分脂质双层由 ATG9 含有的囊泡提供,但其余脂质双层膜的来源目前尚不清楚。在大多数 ATGs 的清除和微管传递到溶酶体后,自噬体的外膜与溶酶体膜融合形成了自噬溶酶体。这种融合最终可将一个单膜自噬体释放到溶酶体腔内从而形成水解环境,然后通过这个环境自噬溶酶体可将自噬体与它的产物一起降解[12]。
2. 自噬与 OS 化疗耐药:目前,自噬在 OS 中的作用仍然存在争议。一方面,自噬可作为细胞管家清除受损的细胞器并且保护细胞防止癌变。另一方面,过度或持续的自噬被证明可通过增强诱导细胞凋亡的进程或形成“自噬性细胞死亡”来促进肿瘤细胞死亡[13]。自噬还可在应激反应中作为一种促进细胞存活的信号,例如在饥饿、缺氧和存在化疗或靶向治疗的条件下,它可能在中晚期肿瘤患者中介导化疗耐药。研究发现微管相关蛋白 1 轻链 3I、II ( LC3I、 LC3II ) 在化疗耐药 OS 细胞中的阳性表达率明显高于正常骨组织,Liu 等报道了高迁移率族蛋白 1( HMGB1 ) 可通过与自噬相关基因 Beclin1 结合参与了 OS细胞自噬和化疗药物耐药性形成,因此自噬与 OS 化疗耐药存在着明显的量效关系[14]。
( 1 ) 自噬诱导了 OS 化疗耐药:近年来,越来越多的证据表明,自噬在化疗耐药的发展中起着关键作用。当细胞遭受到化疗药物时,细胞自噬通过引发自噬体的形成来降解细胞受损细胞器或颗粒生成氨基酸和脂肪酸。细胞应激或代谢需求的增加可激活自噬,这样可促进肿瘤细胞存活,导致肿瘤生长和化疗耐药的产生[15]。研究表明紫杉醇可导致了骨肉瘤 U-2OS 细胞中 STMN1 表达的上调,导致了自噬的活化。研究者敲除 STMN1 发现紫杉醇诱导自噬明显减少,对于 OS 细胞的化疗敏感性明显增强[16]。已经有研究报道在 DDP 治疗 OS 中,耐药与增强保护自噬、减弱细胞凋亡呈正相关。对于 AMPK 依赖的自噬,DDP通过激活 NFKB1 / NF-κB 自噬通路来诱导 GFRA1 表达,进而导致 OS 耐药[17-18]。自噬相关基因 ATG4 是一种两共轭系统调节器,它可以诱导 ADM 介导自噬囊泡的形成,进而增强自噬而导致化疗耐药。而 miR-101 可通过下调ATG4 的表达,进一步抑制自噬来增强 OS 化疗药物的敏感性[19]。
( 2 ) 自噬增加了 OS 化疗敏感性:在人骨肉瘤 U-2OS细胞中,黄酮类化合物通过上调自噬相关基因 Beclin1 增强了 ADM 诱导自噬,导致 U-2OS 细胞死亡,从而揭示了协同细胞毒作用[20]。DSTD 是一种新型的雄烯二酮衍生物,在 MG-63 和 U-2OS 细胞中,它可以抑制巨噬细胞迁移抑制因子 ( MIF ) 表达。DSTD 通过诱导 Bcl-2 的下调和HMGB1 转运来抑制 MIF 的表达,从而增强自噬。DSTD还可通过下调 HMGB1 水平来增强化疗敏感性,进一步克服 OS 耐药[21]。此外,自噬中还调节着两共轭系统。VOA是从植物提取出来的生物碱,是一种自噬诱导剂。在野生型和多药耐药 ( MDR ) 肿瘤细胞中,它可以通过促进 LC3表达和转换来增强自噬,并通过促进肿瘤细胞凋亡来增加化疗敏感性[22]。在人 OS 细胞中,2-甲氧雌二醇 ( 2-ME )治疗与自噬体形成密切相关。它可以诱导 LC3-I 向 LC3-II 转换并调控着 Atg7 的表达。因此,自噬在 2-ME 介导的抗 OS 中发挥重要作用[23]。
二、microRNA 与 OS 化疗耐药
直到 21 世纪初,微小 RNA ( microRNAs ) 的功能作用还没有被完全阐明。在过去的 20 年中随着精确的 RNA 测序技术的出现,miRNA 已经被证明几乎可以调节所有细胞过程。它可以通过转录后调节大多数蛋白质编码基因与大量的非编码基因。在肿瘤中,miRNAs 已被证明在细胞分裂、自我更新、侵袭和 DNA 损伤中发挥关键作用[24]。microRNA ( miRNA ) 是一种含有 22~24 个核苷酸单链非编码 RNA,它存在于非编码区域[25]。作为一种 mRNA 的调节器,它参与调节细胞增殖、基因表达、甚至个体发育的整个过程[26]。miRNA 不仅在生物学上影响衰老的过程、能量供应、血管生成、EMT、增殖,迁移,侵袭,转移和细胞凋亡,而且在各种肿瘤中,它在遗传或表观遗传学发挥双重作用 ( 抑制 / 促进癌症 )。据报道,已经在人类的许多肿瘤中发现了 miRNAs 异常表达,包括肾癌、结肠癌、肺癌、恶性胶质瘤、胃癌[27]。最近的研究表明,在 OS 细胞中也发现许多 miRNAs 的异常表达,它在 OS 产生和发展过程中起到了一个原癌基因或者抑癌基因的作用[28-29]。最近研究发现在 OS 中 miR-498-3p 的缺失可刺激 PAX3-MET 表达引起肿瘤转移[30]。miR-491-5p 和miR-192 过表达能够抑制 OS 细胞增殖。此外,miRNAs 不仅对 OS 有直接的调节作用,而且也可以影响化疗的敏感性[31-32]。micRNA-140 是首先报道的与 OS 化疗药物敏感性有关的 miRNA 分子[33]。Song 等[34]通过研究证实:在携带 wt-p53 的 U2-OS 及 MG-63 骨肉瘤细胞系中,一方面,miRNA-140 的过表达可通过诱导 p53 和 p21 的表达导致G1 和 G2 期阻滞,抑制肿瘤细胞的增殖速度;另一方面,上调 miRNA-140 的表达可导致肿瘤细胞对 MTX 及 5-氟尿嘧啶等化疗药物的耐药性。因此,miRNAs 与 OS 化疗耐药密切相关。
1. microRNA 增加了 OS 化疗敏感性:化疗后 miRNAs的表达水平与正常骨细胞相比较可出现明显的增加或减少。目前已经发现 OS 细胞系相比较正常骨细胞中存在miR-21,miR-138,miR-33b,miR-29b-1,miR-143,miR-497 和 miR-15a 的低表达[35-41]。当这些 miRNAs 过表达时,OS 细胞将呈现出对化疗药物的高度敏感性。它主要是通过抑制肿瘤细胞增殖、自噬作用及促进细胞凋亡来促进药物抗肿瘤的作用。此外,在化疗后的 OS 细胞中可能会检测到 miR-22 和 miR-217 基因表达水平降低,它们的高表达会增加化疗药物的敏感性[42-44],这可能是由于化疗药物诱发 OS 细胞去抑制 miRNAs 在抗肿瘤作用的表达,进而导致 OS 细胞化疗耐药的产生。但化疗耐药可能由于这些 miRNAs 过表达而被反转。人们从这一观点出发,发现上调一些 miRNAs 之后可以增加 OS 化疗的敏感性,例如 miR-15a、miR-101、miR-33a、miR-301a、miRNA-202[19,41,45-47]( 表 1 )。
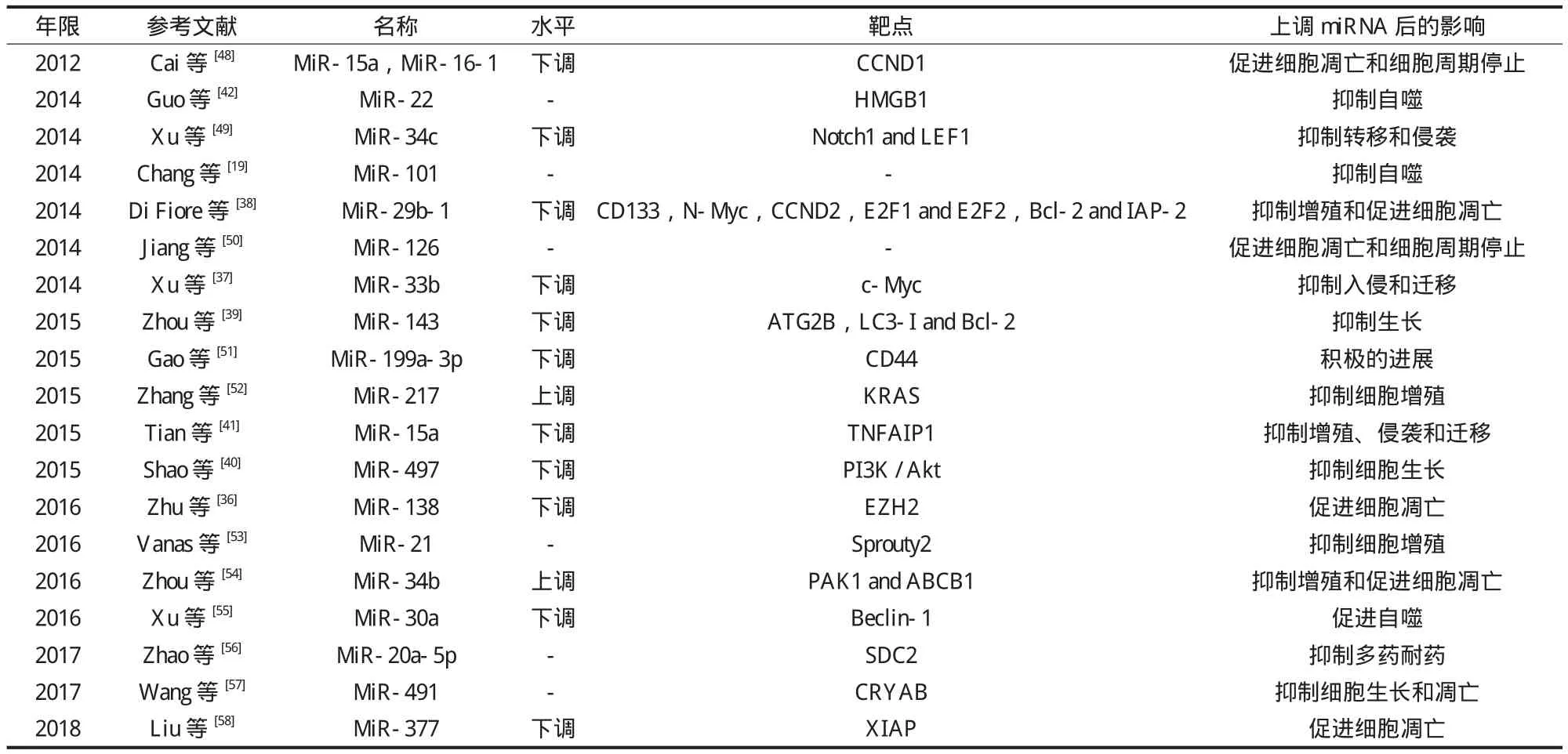
表1 miRNA 增加对化疗药物敏感性基础研究Tab.1 Increased miRNAs chemosensitivity to anti-tumor drugs
2. microRNA 诱导了 OS 化疗耐药:与正常骨细胞或化疗后的 OS 细胞相比,在 OS 中与化疗相关的 miRNA 水平是有突变的。与正常骨细胞或组织相比,OS 细胞中 miR-221、miR-33a、miR-301、miR-202、miR-488、miR-367和 miR-146b-5p 的水平更高,这表明这些 miRNAs 可能会对肿瘤的增殖有促进作用[59-61]。将这些 miRNA 转染入 OS细胞,可以通过促进增殖、侵袭和转移来保护细胞免受肿瘤药物的侵袭,进而导致化疗药物耐药的产生。在化疗耐药的 OS 细胞中,可见 miR-146b-5p 和 miR-184 表达水平的上调,进而抑制细胞凋亡来产生化疗耐药[61-62]。此外,OS 细胞中 miR-21 和 miR-193a-5p 的上调也显示 OS 化疗的耐药性[35,63]( 表 2 )。
三、microRNA 调控自噬相关因子与 OS 化疗耐药
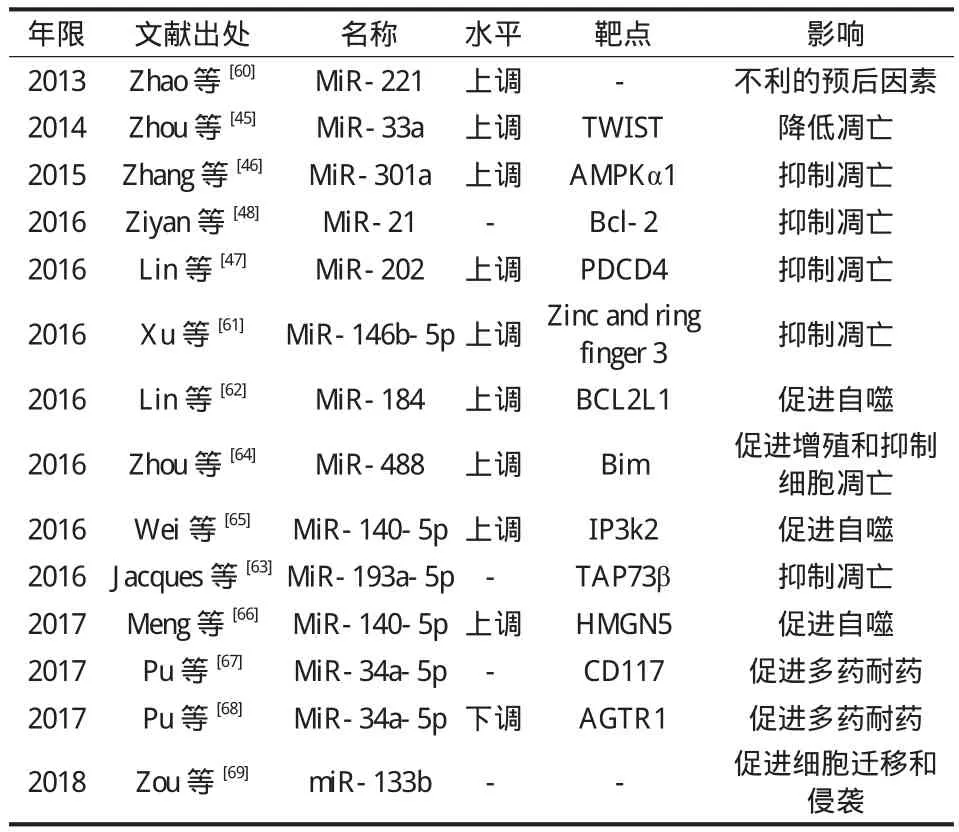
表2 miRNA 增加对化疗药物的耐药基础研究Tab.2 Decreased miRNAs chemosensitivity to anti-tumor drugs
1. 哺乳动物雷帕霉素靶蛋白 ( mTOR ):磷脂酰肌醇3-激酶 ( PI3K ) / 蛋白激酶 B ( Akt ) 是调控细胞自噬的重要信号通路 ( 以下简称 PI3K / Akt ) ( 图 1 )。这条通路可以激活许多下游目标,如 mTOR。mTOR 具有调节细胞生长和增殖作用,也是自噬启动阶段的关键调节因子,活化后可抑制自噬发生[70]。启动阶段的靶点主要为 mTOR 相关靶点,包括 TOR 复合体 1 和 I 型 PI3K,激活 I 型 PI3K 从而触发 mTOR 通路是必不可少的环节,因而通过调节 I 型PI3K 便可以调控自噬[71]。PTEN ( 磷酸酶和张力蛋白同源物 ) 是一种具有蛋白酶和磷酸酶双重活性的抑癌基因,可作为 PI3K / Akt 信号通路的主要负调控因子。近期有研究报道 MiR-155 通过靶向抑制 PTEN 的表达来增强 PI3K /Akt / mTOR 信号通路,抑制 ADM 诱导的 OS 细胞自噬和凋亡,降低对其的敏感性[72]。塞来昔布是一种环氧化酶-2 ( COX-2 ) 抑制剂,它在下调 PI3K / Akt 在多药耐药基因 MRP1,BCRP and Trkb,E-cadherin,β-catenin 的调节中起重要作用。在骨肉瘤 MG-63 细胞系中,它可通过下调 PI3K / Akt 诱导细胞凋亡,进而增强对 DDP 化疗的敏感性[73]。
2. 高迁移率族蛋白 ( HMGB ):HMGB 家族是一组高度保守并且包含 HMG 盒结构域的蛋白家族。HMG 盒是一种新型的 DNA 结合基序,其特征是三个α螺旋排列成L 形。HMGB1,位于人类染色体上 13q12-13,是一类具有两个串联的 HMG 盒域 ( A 盒和 B 盒 ) 和一个酸性 C-末端的非组蛋白染色体结合蛋白[74]。当受到各种内源性和外源性刺激时,HMGB1 会迅速地从细胞核向细胞质移动或被释放到细胞外,HMGB1 可作为信号分子竞争性结合Beclin-1,通过控制 Beclin1-Bcl-2 复合体解离调节自噬进程。HMGB1 也可结合到细胞表面受体,激活下游信号通路刺激细胞增殖迁移,进而诱导自噬的发生[75]。Huang等[76]发现 HMGB1 不仅会在 OS 化疗过程中呈高表达,而且在 OS 化疗过程中会调节自噬。HMGB1 被抑制会增加化疗敏感性。相反,HMGB1 过表达会增加对化疗的耐药性。这些发现都证实了 HMGB1 是自噬介导细胞存活的重要调节因子。事实上,Guo 等[42]已经提出在 OS 细胞中,HMGB1 作为 miR-22 的直接靶点,miR-22 可下调 HMGB1介导的自噬来进一步增强化疗的敏感性。HMGN5,是一种普遍存在的核蛋白,广泛表达于真核生物中。研究者在 OS 细胞中检测到了 HMGN5 基因 mRNA 和蛋白的高表达。研究表明,miR-140-5P 通过转录激活核小体上调HMGN5,导致 OS 细胞株 U2-OS 和 MG6319 产生耐药。因此,HMGB 诱导自噬对 OS 产生的耐药具有重要意义,是肿瘤治疗的新靶点[77]。

图1 miRNA 调控自噬相关因子在骨肉瘤化疗耐药的分子机制假说Fig.1 The molecular mechanism of miRNA regulating the autophagy related factors in chemotherapy resistance of osteosarcoma
3. 其它自噬相关因子:Beclin-1 是首个被发现的哺乳动物自噬基因,已经被确认可结合 VPS34 ( III 类磷酸肌醇 - 3 - 羟基激酶 ) 来驱动自噬体的形成。它通过结合 PI3KCIII / Vps34 调节自噬的产生。已经有研究表明Beclin-1 介导的自噬可以导致 OS 化疗耐药,miR-30a 可结合 Beclin-1 的 3’UTR 区。进一步研究在骨肉瘤 MG-63细胞中,miR-30a 的下调可增加 Beclin-1 介导的自噬,进而导致 ADM 耐药[78]。ATG16L1 是一个大蛋白复合体的组成部分,而这个大蛋白复合体又是产生自噬必不可少的。目前,研究表明在 OS 细胞系和组织中存在 miR-410 表达下调,ATG16L1 作为 mir-410 的一个潜在的靶基因。而miR-410 通过调节自噬相关基因 ATG16L1 表达来抑制自噬,进而增强 OS 化疗药物的敏感性[79]。
四、展望
本综述详细阐述了自噬、miRNA 与 OS 化疗耐药的相互关系,并且分别说明了自噬与 miRNA 的改变与 OS 化疗敏感性与耐药性的相互作用机制。在 OS 中,miRNA 已被证实参与自噬的各个阶段,包括吞噬细胞诱导、成核和扩增,自噬体和自体溶酶体成熟,并发挥调控作用以及介导着 OS 化疗敏感性。随着 miRNA、自噬在 OS 化疗耐药方面研究的逐步深入,许多抗肿瘤药物已被研制来进一步对抗化疗耐药,其中新型靶向治疗包括通过抑制 PI3K / Akt /mTOR 通路来逆转自噬并抑制化疗耐药。多项研究证实抑制 PI3K / Akt / mTOR 自噬通路是一种克服化疗耐药、增强抗肿瘤敏感性的方法,且该通路相关研究的有效性和临床试验的安全性已被证实。除了肿瘤活检外,miRNA 还可能在包括血液,尿液,唾液等在内的任何身体流体中检测到。因此,miRNA 在 OS 中的重要且直接的用途是利用其标记疾病。除了早期准确诊断疾病外,miRNA 还可以用于跟踪 OS 患者的化学治疗的预后及复发的情况。
然而,根据有限的文献报道,现阶段在 OS 化疗耐药的发展中对于细胞自噬、miRNA 始终存在着争议。OS 化疗耐药的研究尚处于起步阶段,许多具体的作用机制还需进一步深入研究。目前,化疗耐药性仍是影响 OS 患者的生存率的最大障碍。明确 OS 化疗耐药机制,并且能够找到相应的处理办法,这样才能提高 OS 患者的生存率。因此研究 OS 化疗耐药机制对于研发新型化疗药物和提高 OS患者的生存率都有着十分重要的价值。
