婴幼儿配方乳粉加工环境中蜡样芽孢杆菌多位点序列分型
2018-12-10,,,,,,,
,,,, ,, ,
(东北农业大学食品学院乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
婴幼儿配方乳粉作为母乳替代物,可为婴幼儿的生长发育提供所必需的物质[1]。近年来婴幼儿配方乳粉的销量在我国乳粉市场中占有重要比例,且需求量呈现逐年增加的趋势。婴幼儿配方乳粉的安全问题一直备受关注,而婴幼儿配方乳粉加工环境中的微生物也是潜在的污染来源[2-3]。蜡样芽孢杆菌(Bacilluscereussensulato)是一种能产生芽孢或生物膜的食源性致病菌,易引起食物中毒,也是污染婴幼儿配方乳粉的重要致病菌之一[4]。广义的蜡样芽孢杆菌群细菌(Bacilluscereusgroup)是由生理生化性质和基因特征高度相似的多种革兰氏阳性菌组成[5],包括蜡样芽孢杆菌(B.cereus)[4]、炭疽芽孢杆菌(B.anthracis)[4]、苏云金芽孢杆菌(B.thuringiensis)[5]、蕈状芽孢杆菌(B.mycoides)[5]、假蕈状芽孢杆菌(B.pseudomycoides)[6]、耐冷菌韦氏芽孢杆菌(B.weihenstephanensis)[7],以及近几年新发现的细胞毒素芽孢杆菌(B.cytotoxicussp.)[8]、图瓦永芽孢杆菌(B.toyonensis)[9]、B.gaemokensis[9]、B.manliponensis[10]和B.bingmayongensis[9-10]等。
由于蜡样芽孢杆菌与该菌群内的其他种细菌在形态特征、生理生化特征和基因序列等方面极为相似,部分新种定义可能存在争议,因此需结合国标GB 4789.14-2014中生理生化鉴定试验与其他分子生物学方法,对蜡样芽孢杆菌进行检测鉴定,从而减少食品中蜡样芽孢杆菌的误检与漏检[11]。
蜡样芽孢杆菌在基因特征的分析上可以借助分子分型技术来实现。多位点序列分型(Multilocus Sequence Typing,MLST)通过测定6~10个持家基因的核苷酸序列对细菌进行分型研究,实现了不同菌株之间等位基因多样性的比较[12]。与其他分型方法相比较,MLST技术建立了一个专门的数据库(PubMLST),有利于全球数据的共享,便于不同实验室间数据的比对[13]。同时,MLST可以对不同来源的菌株进行亲缘关系的探究,分析菌群的系统发育关系与遗传进化关系,弥补了传统分型方法的缺点,该技术已逐渐成为细菌分型的“金标准”[14-15]。
本文对分离自婴幼儿配方乳粉加工环境中的84株蜡样芽孢杆菌进行MLST分析,探究了婴幼儿配方乳粉加工生产环境中的分离株的多样性和系统进化关系,为其后续的溯源研究和有效防控提供了理论基础。
1 材料与方法
1.1 材料与仪器
供试菌株 84株蜡样芽孢杆菌 均分离自2014~2015年期间婴幼儿配方乳粉原辅料及各生产环节;根据GB 4789.14-2014中的菌落形态和生理生化试验结果,结合16S rRNA基因分析将分离菌株鉴定为蜡样芽孢杆菌。BHI固体培养基、LB肉汤培养基 青岛海博生物技术有限公司;2×Taq PCR MasterMix、细菌基因组DNA提取试剂盒 北京天根生化科技有限公司。
高压蒸汽灭菌锅 山东中泰有限公司医疗设备厂;高速冷冻离心机 上海通达机械研究所;9700 PCR扩增仪 美国Applied Biosystems公司;DYY-10C型电泳仪 北京市六一仪器厂;UVP凝胶成像系统 美国UVP公司;Bcn1360型生物超净工作台 苏州金大工程设备有限公司。
1.2 实验方法
1.2.1 蜡样芽孢杆菌分离株的活化与纯化培养 将冻存的菌株以2%的接种量接种于LB液体培养基37 ℃培养8~12 h。然后将活化后的菌液于BHI琼脂培养基划线培养12 h,再挑取BHI培养基上的单菌落于LB液体培养基中培养12 h。
1.2.2 DNA模版的提取 取2 mL分离菌株的LB培养基菌液,采用细菌基因组DNA提取试剂盒提取84株蜡样芽孢杆菌分离株的DNA,提取后于-20 ℃保存用于后续实验。
1.2.3 引物的设计与合成 根据蜡样芽孢杆菌MLST数据库(http://pubMLST.org/bcereus/)所提供的七对持家基因的序列设计引物,持家基因glpF、gmk、ilvD、pta、pur、pycA和tpi引物如表1所示,引物由北京诺赛生物科技有限公司合成。
1.2.4 持家基因PCR扩增及测序 PCR反应体系50 μL:正向引物和反向引物各1 μL,DNA模板5 μL,2×Taq PCR Mix 25 μL,ddH2O 18 μL。反应条件为:94 ℃预变性5 min,94 ℃变性1 min,56~59 ℃退火30 s,72 ℃延伸1 min,共30个循环,最后72 ℃延伸7 min,终产物4 ℃保存[16]。取5 μL PCR产物在1%琼脂糖凝胶(含EB)上进行电泳检测,电压和电流分别为 100 V和100 A,电泳时间为30 min。凝胶成像仪下观察并拍照,若出现清晰明亮的单一特异性条带,将产物送至北京诺赛生物科技有限公司纯化后进行双向测序。
1.2.5 多位点序列分型 将测序后的序列用 ContigExpress 软件进行拼接,登录蜡样芽孢杆菌MLST数据库(pubMLST),对每株菌的七个持家基因序列进行查询与比对,得到相应的等位基因编码(Aelle),并按照glpF、gmk、ilvD、pta、pur、pycA、tpi的排列顺序,确定菌株的序列型(Sequence type,ST)[16]。若测序所得的等位基因或序列型未与数据库中已有的序列完全匹配,则对该持家基因重新进行PCR扩增,反应体系与条件同1.2.4所述,PCR产物进行重新测序,在MLST数据库中比对重新测序得到的序列,以确证新的等位基因与序列型,将重复确证后的等位基因或序列型提交至数据库,得到新的等位基因编码与序列型编码,并获取相应的菌株ID编号[17]。
1.2.6 系统发育分析 将蜡样芽孢杆菌的七个持家基因序列进行拼接,得到长度为2829 bp的基因序列,利用Mega 7.0软件对84株蜡样芽孢杆菌分离株进行系统发育分析,选择最大似然算法(Maxmum likelihood algorithm),程序重复1000次,构建系统发育树[18],并选择B.cereusATCC 14579、B.anthracisATCC 14578、B.thuringiensis ATCC 10792、B.mycoides ATCC 6462、B.pseudomycoidesDSM 12442、B.weihenstephanensisDSM 11821、B.cytotoxicusNVH 391-98、B.toyonensisBCT-7112、B.gaemokensisBL3-6、B.manliponensisBL4-6和B.bingmayongensisFJAT-13831作为参考菌株。
2 结果与分析
2.1 蜡样芽孢杆菌分离株的DNA提取及PCR扩增
采用细菌基因组DNA提取试剂盒提取84株分离菌株的DNA,部分菌株的琼脂糖凝胶电泳检测结果如图1所示。分离菌株的DNA电泳条带清晰且无杂带,说明提取的DNA可用于后续PCR扩增。持家基因的特异性引物均能扩增出无引物二聚体的单一清晰明亮的目标条带,部分扩增结果如图2所示。
图1 试验菌株DNA提取电泳图Fig.1 The electrophoresis results of DNA extracted from part of isolated strains注:M:Marker DL2000;1~5:部分菌株DNA。

图2 部分菌株的持家基因PCR产物电泳结果Fig.2 The electrophoresis results of PCR products form part of isolated strains 注:M:Marker DL2000;1~6为部分菌株PCR产物。
2.2 MLST分型
将84株蜡样芽孢杆菌的七个持家基因序列在蜡样芽孢杆菌MLST数据库中进行比对,得到相应的等位基因编码和ST型。未与数据库完全匹配的等位基因经过确证试验后,得到3个新的等位基因pur-242、pyc-198、ilv-276。84株蜡样芽孢杆菌分离菌株被分成如下24个ST型:ST-24、ST-26、ST-32、ST-62、ST-144、ST-374、ST-999、ST-1119、ST-1243、ST-1284、ST-1333、ST-1334、ST-1335、ST-1336、ST-1337、ST-1338、ST-1339、ST-1340、ST-1341、ST-1342、ST-1343、ST-1344、ST-1345和ST-1347,其中14个序列型经过重复PCR及测序进行确证试验后被确认为新的ST型,分别是ST-1333、ST-1334、ST-1335、ST-1336、ST-1337、ST-1338、ST-1339、ST-1340、ST-1341、ST-1342、ST-1343、ST-1344、ST-1345和ST-1347,上传至MLST数据库并得到相应的ID为2093-2015和2110。84株菌的具体ST型结果如表2所示。
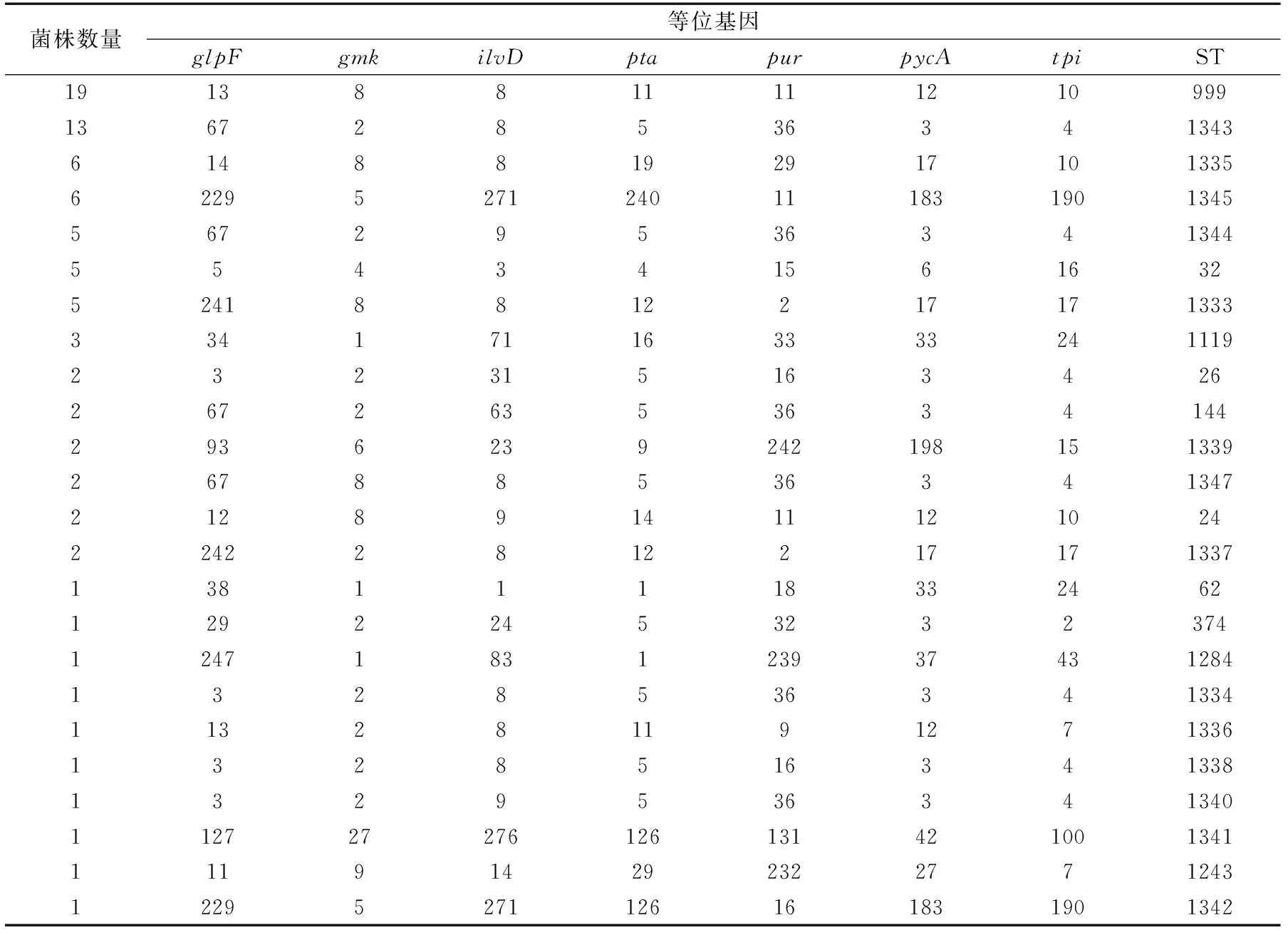
表2 84株蜡样芽孢杆菌MLST信息表Table 2 MLST of 84 B.cereus strains
在24个ST型中,ST-999的菌株为19株,占总数的22.62%;ST-1343的菌株为13株,占总数的15.48%;ST-1335与ST-1345的菌株均为6株,各占总数的7.14%,之后为ST-1344(5株,5.95%)、ST-32(5株,5.95%)、ST-1333(5株,5.95%)、ST-1119(3株,3.57%);6个ST型均有两株菌,包括ST-24、ST-26、ST-144、ST-1337、ST-1339和ST-1347;其余10个ST型均只有1株菌,分别为ST-62、ST-374、ST-1284、ST-1334、ST-1336、ST-1243、ST-1338、ST-1340、ST-1341和ST-1342。可见该婴幼儿配方乳粉加工环境中的优势ST型为ST-999、ST-1343、ST-1335与ST-1345。
到目前为止,蜡样芽孢杆菌MLST分型数据库中共包含了2300多株蜡样芽孢杆菌,这些蜡样芽孢杆菌已经被分为了1487个ST型,在这些ST型中一些重要的ST型已经被重点报道。有研究发现ST-26与ST-144在婴幼儿食品中被检出,检出率高达98%[19]。在本研究中两株ST-26与两株ST-144均分离于生产环节,是较为罕见的呕吐型蜡样芽孢杆菌,这种菌株在环境中检出率一般低于1%,并且ST-26在数据库中所有的呕吐型菌株中是最常见的,且占据着较大的比例(73%)。呕吐型菌株能产生导致食物中毒的呕吐毒素(cereulide)[20],这种毒素形成之后,很难在食品加工过程中和在人体内的胃消化过程中被消灭破坏,易引起食物中毒的集中爆发,其潜伏期非常短[21],主要产生呕吐症状,有时也会出现头晕、四肢无力的症状[22]。因此,在生产区域被检测到的ST-26与ST-144应该引起我们对安全生产的高度重视,注意保持加工环境的良好卫生状况,特别是喷雾干燥环节,流化床以及包装环节。
2.3 系统发育分析
84株蜡样芽孢杆菌基于七个持家基因拼接的全长为2829 bp的最大似然系统发育树如图3所示。该系统发育树揭示了蜡样芽孢杆菌群微生物明确的系统发育关系,该婴幼儿配方乳粉加工环境中所分离的24个ST型和蜡样芽孢杆菌群中的11个种都相互保持了一定的距离,而在这11个种中,24个ST型和B.cereus、B.anthracis、B.thuringiensis这三个种显示了更近的系统发育关系,同蜡样芽孢杆菌群中的另外8个种的亲缘关系较远。ST-24、ST-999和ST-921(B.cereusATCC 14579)具有更近的系统发育关系,而根据B.cereusMLST数据库的比对,这些相近的ST之间只相差3~7个碱基,由于MLST分型能够反应整个基因组的系统发育关系,因此ST-24、ST-999和ST-921的菌株很可能在整个基因组层面的系统发育关系也比较相近。新发现的ST-1340、ST-1334、ST-1347、ST-1343和ST-1344系统发育关系较近,且这些ST型均分离自生产内包环节和包装内包环节,表明这两个加工环节的ST型在进化上具有亲缘关系,可能存在不同环节交叉污染的风险。
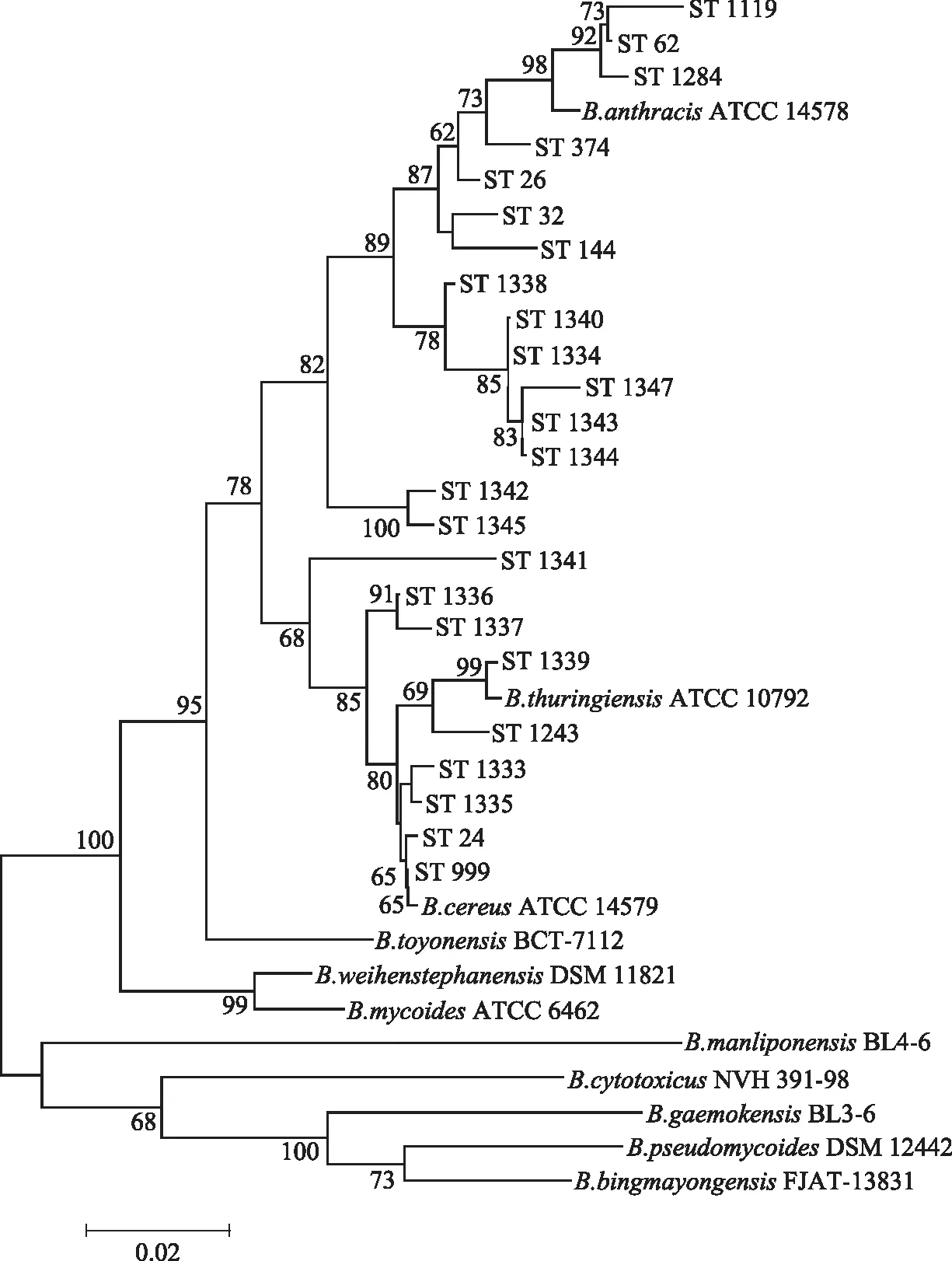
图3 84株蜡样芽孢杆菌的系统发育分析Fig.3 Phylogenetic analysis of 84 B. cereus strains
3 结论
本文将84株分离自婴幼儿配方乳粉加工环境中的蜡样芽孢杆菌进行多位点序列分型,共分为24个ST型,其中14个ST型是首次发现的ST型,分别为ST-1333、ST-1334、ST-1335、ST-1336、ST-1337、ST-1338、ST-1339、ST-1340、ST-1341、ST-1342、ST-1343、ST-1344、ST-1345和ST-1347,同时pur-242,pyc-198,ilv-276是三个新发现的等位基因。ST-999、ST-1343、ST-1335与ST-1345是该婴幼儿配方乳粉加工环境中的优势ST型。通过系统发育分析,24个ST型和B.cereus、B.anthracis、B.thuringiensis这三个种在基因层面的亲缘关系较近,与蜡样芽孢杆菌群中的其余8个种的亲缘关系较远。总体而言,利用MLST技术及系统发育分析研究了婴幼儿配方乳粉加工环境中的蜡样芽孢杆菌,丰富了蜡样芽孢杆菌的数据库,为进一步研究婴幼儿配方乳粉加工环境中的蜡样芽孢杆菌的多样性和溯源防控提供了理论基础和技术支持。
