不同光质对西兰花芽苗菜营养品质及抗氧化性的影响
2018-12-10,,,,
,, ,,
(南京农业大学生命科学学院,江苏南京 210095)
西兰花(BrassicaoleraceaL.var.italicPlanch)隶属于十字花科芸薹属,为甘蓝的变种。研究表明,经常食用西兰花可以降低患癌症和心血管疾病的风险[1],这些有益效果归因于一类重要的含硫次级代谢产物,称为硫苷[2]。西兰花芽苗菜是西兰花种子发芽后5~9 d的嫩芽,其中硫苷的含量是成熟西兰花的20倍以上[3]。硫苷在人体内的分解产物是异硫氰酸酯,它是由葡萄糖醛酸通过黑芥子酶的水解作用形成的,对各种癌症具有防御性功能,是已知最有希望的抗癌剂[4]。此外,西兰花芽苗菜还含有大量的抗氧化剂和保健功能化合物,如维生素C、总酚、类黄酮和花青苷等[5-6]。
通过光环境调控技术可以调节芽苗菜的生长发育,改善其营养品质。Lee等[11]研究不同光质处理对普通荞麦和鞑靼荞麦芽苗菜中酚类物质的影响,发现蓝光对普通荞麦影响较大,而红光对苦荞麦影响大;不同的光质处理下,红光处理更有利于酚类物质在普通荞麦芽苗中积累。刘文科等[12]利用不同光质处理研究对豌豆苗生长、光合色素和营养品质的影响。结果发现,蓝光和红蓝光可以促进豌豆苗地上部生长,提高叶片叶绿素a、b含量,红蓝光处理可增加豌豆苗叶片维生素C含量;白光和红蓝光处理的豌豆茎叶中类胡萝卜素含量最高,白光处理使豌豆苗茎叶中花青素积累最多。Moreira等[13]研究发现,不同强度的紫外光照射可改变西兰花芽苗菜的硫苷和酚类组分,提高芽苗菜品质。目前,关于芸薹属富含硫苷的芽苗菜光调控的研究主要为不同强度的UV-B辐射对西兰花芽苗菜疾病和害虫的抗性研究[14]以及光质对羽衣甘蓝芽苗菜健康品质的研究[15],关于单色光对西兰花芽苗菜子叶和下胚轴营养品质的研究尚未见报道。
为此,本试验研究了在西兰花芽苗菜生长中,不同单色光质对其活性物质积累和抗氧化活性的影响,探讨光调控对西兰花芽苗菜营养品质的影响,以期为光调控应用于芽苗菜工厂化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
西兰花(品种为‘蔓陀绿’)种子 购于山东金种子农业发展有限公司;烯丙基硫苷标准品、硫酸酯酶、抗坏血酸、DPPH· 美国Sigma公司;乙腈(色谱纯) 上海陆都化学试剂厂;甲酸、草酸、没食子酸、福林酚 上海化学试剂有限公司;超氧阴离子测定试剂盒 南京建成生物工程公司。
液相色谱质谱联用仪(Liquid chromatograph mass spectrometer,LC-MS)(配有电喷雾离子源(ESI)及Masslynx 4.1数据处理系统) 美国Waters公司;冷光源培养箱 浙江宁波海曙赛福实验仪器厂;HC-C 6002型电子天平 浙江慈溪市华徐衡器实业有限公司。
1.2 试验方法
1.2.1 西兰花芽苗菜的培养 将经过10%次氯酸钠消毒后用灭菌蒸馏水洗至中性的西兰花种子于30 ℃蒸馏水中浸泡4 h后均匀铺撒在纱布上,黑暗25 ℃催芽24 h。将发芽的种子播种并置于黑暗25 ℃培养36 h,再转移至不同光照培养箱中,箱内顶置LED光源,可发出白光(W)、蓝光(B)及红光(R);另外使用紫外窄谱灯管作UV-B光源,以白光培养(W)作为对照。箱内相对湿度为75%±5%,温度为(25±2) ℃,16 h光照,8 h黑暗处理,5 d后株高约4cm即可收苗。表1为光谱能量分布主要技术参数,调节光强为30 μmol/(m-2·s-1)左右。

表1 不同光谱能量分布的主要技术参数Table 1 Major technique parameters of light spectral energy distribution
1.2.2 光质对苗菜生长的影响 测定经光质处理5 d后的西兰花芽苗菜全株鲜重、可食鲜重、下胚轴长,并将经过光质处理的芽苗菜鲜样置于烘箱中105 ℃杀青15 min,85 ℃烘干3 d至恒重后测定全株干重、可食干重、可食率以及含水率。
1.2.3 子叶和下胚轴品质的测定
1.2.3.1 可溶性糖含量的测定 参照王学奎[16]的方法,称取0.5 g鲜样放入玻璃试管中,加入10 mL去离子水,沸水浴30 min(重复提取2次),合并提取液过滤至烧杯后,定容到25 mL的容量瓶中。取1 mL提取液加入到20 mL试管中,加入10 mL浓硫酸溶液和1 mL 2%蒽酮-乙酸乙酯溶液,沸水浴1 min,室温下测定630 nm波长下的吸光值。式中:C:从标准曲线中求得的糖含量(μg);VT:提取液总体积(mL);VS:测定时取用的样品提取液体积(mL);N:稀释倍数;W:样品质量(g)。
1.2.3.2 可溶性蛋白含量的测定 采用王学奎[16]的方法,称取1 g鲜样,加2 mL蒸馏水研磨成匀浆,转移到离心管中,再用6 mL蒸馏水多次洗涤,在室温下放置1 h后8000 r/min 4 ℃离心15 min,上清液转入10 mL容量瓶,定容至刻度。提取液加入考马斯亮蓝后静置3 min,在595 nm波长下测定吸光值。式中:C:由标准曲线所得蛋白的含量(μg);VT:提取液总体积(mL);VS:测定时所用提取液的体积(mL);N:稀释倍数;W:样品鲜重(g)。
1.2.3.3 游离氨基酸含量的测定 提取方法同可溶性糖。参照王学奎[16]的方法,取0.05 mL上清液,加0.5 mL茚三酮酒精溶液,沸水浴后加5 mL 95%乙醇,于570 nm波长下测定吸光值。式中:C:从标准曲线中求得的糖含量(μg);VT:提取液总体积(mL);VS:测定时取用的样品提取液体积(mL);N:稀释倍数;W:样品质量(g)。
1.2.4 总酚含量、类黄酮含量、花青苷含量、维生素C含量的测定
1.2.4.1 总酚含量的测定 取1.5 g西兰花芽苗,用15 mL 50%甲醇研磨,匀浆液于室温下12000 r/min离心10 min。参照Volden[5]所述的方法,使用福林-酚试剂测定酚类化合物,并在765 nm读取其吸光值。样品中总酚含量用没食子酸当量(GAE)/100 g FW表示。用没食子酸作标准曲线,计算出样品中总酚含量。式中:C:从标准曲线中求得的当量没食子酸含量(mg);VT:提取液总体积(mL);VS:测定时取用的样品提取液体积(mL);N:稀释倍数;W:样品质量(g)
1.2.4.2 类黄酮含量的测定 通过Chlopicka[17]所述的比色法测定,并稍作修改。用0.25 mL的80%甲醇提取芽苗菜类黄酮,加入1.25 mL蒸馏水稀释后向混合物中加入75 mL 5% NaNO2溶液,7 min后,加入150 mL 10% AlCl3·6H2O溶液,反应混合物加入0.5 mL NaOH(1 mol/L)后在510 nm处测定混合物的吸光值。
1.2.4.3 花青苷含量的测定 根据Su[18]的方法,将0.5 g样品于室温黑暗中用10 mL含1% HCl的甲醇溶液萃取24 h,10000 r/min室温离心15 min。经光质处理5 d后的西兰花芽苗菜子叶的花青苷需要在测量前使用氯仿萃取。读取A530和A657的吸光值。差值每增加0.01定义为一个单位。
1.2.4.4 维生素C含量的测定 根据Volden等[19]的方法作适当修改。取0.5 g鲜样,用5 mL 2%草酸研磨提取后过0.45 μm有机系膜后用HPLC测定。色谱柱:SB-C18 色谱柱;流速:0.8 mL/min;检测波长:254 nm;柱温:30 ℃;进样量:20 μL;流动相:0.1%草酸∶甲醇=95∶5。
1.2.5 抗氧化性与苯丙氨酸酶、查尔酮异构酶活性测定
1.2.5.1 DPPH自由基清除活性的测定 根据Do等[22]的方法进行DPPH自由基清除活性测定。取总酚类物质提取液,加入0.1 mmol/L的DPPH,35 min后517 nm波长处测定吸光值。自由基清除能力(%)=[(1-A517 nm样品/A517 nm对照)]×100
1.2.5.2 抗超氧阴离子能力测定 采用抗超氧阴离子试剂盒测其550 nm下的吸光度,单位为(U/g FW)。
1.2.5.3 苯丙氨酸酶(L-phenylalanine ammo-nialyase,PAL),查尔酮异构酶(Chalcone isomerase,CHI)活性的测定 参照刘金等[20]的方法,稍作修改。称取1 g鲜样,加入5 mL提取液(0.1 mol pH8.7硼酸缓冲液,0.05 mol/L抗坏血酸,0.018 mol/L 2-巯基乙醇)充分研磨后10000 r/min 4 ℃离心25 min,上清液即为粗酶液,用于酶活检测。PAL检测方法:取250 μL粗酶液、875 μL 0.1 mol/L缓冲液、250 μL L-苯丙氨酸加入试管内,其中L-苯丙氨酸最终浓度为11 mmol/L。将装有混合物的试管在30 ℃温育30 min,用0.5 mL 15% HCl终止反应。然后在室温8000 r/min下离心8 min沉淀变性的蛋白,在1 cm的石英比色皿中于290 nm波长下测定其吸光值。按以下公式计算PAL酶活。式中:N:酶粗提液总体积(mL);W:样品鲜重(g);T:反应时间(min);n:反应液所用酶粗提液的体积(mL)。
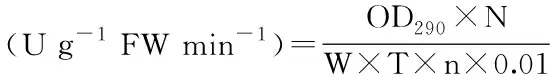
CHI检测方法:配制测定混合物(含粗酶液0.75 mL,pH7.4,0.050 mol/L Tris-HCl缓冲液2 mL;0.05 mL 1 mg/mL查尔酮溶液;7.5 mg/mL牛血清蛋白),将待测定混合物于34 ℃条件下水浴30 min(另取同量的酶提取液进行沸水浴10 min,作对照),测定A381。CHI酶活性计算公式如下。式中:V:酶粗提液总体积(mL);W:样品鲜重(g);T:反应时间(min);VS:反应液所用酶粗提液的体积(mL)。P:每克鲜样中的蛋白质含量(mg)
1.2.6 硫苷含量的测定 参考Font等[21]的方法并稍作修改。取1 g鲜样,加入6 mL 75%甲醇煮沸25 min灭酶,研磨匀浆后,再用2 mL 75%甲醇萃取残余物,80 ℃恒温水浴中浸提25 min,12000 r/min离心15 min,收集上清液。将2 mL上清液加到1 mL DEAE Sephadex A-25柱(乙酸活化)中,加入500 μL 硫酸酯酶,30 ℃下反应16 h。用2 mL去离子水洗脱后过0.22 μm滤膜。通过LC-MS系统(G2-XS QTof,Waters)分析样品。将2 μL溶液注入UPLC柱,流速为0.4 mL/min。使用Masslynx 4.1进行数据采集和处理。色谱柱:石英毛细柱(30 mm×0.25 mm,0.25 μm);柱温32 ℃;进样量0.5 μL;检测波长为226 nm,流速为1.5 mL/min,内标为烯丙基硫苷。
1.3 数据处理
数据处理采用SPSS 19.0软件,Origin 8.0软件作图,显著性测验采用邓肯氏新复极差法(p<0.05)。
每个样品做三次重复分析。
2 结果与分析
2.1 光质对西兰花芽苗菜生长的影响
图1所示(bar=1cm)为芽苗菜生长形态图。由表2可知,与对照白光相比,红光下西兰花芽苗菜下胚轴(图1所示)显著(p<0.05)伸长,UV-B则抑制下胚轴的伸长,而蓝光处理后的下胚轴长与白光相比并无显著性差异(p>0.05)。在红光培养下的西兰花芽苗菜可食鲜重最高,与白光相比,其可食鲜重增加约19%;蓝光和UV-B处理后全株鲜重以及可食鲜重与白光相比并没有提高。红光显著(p<0.05)提高了西兰花芽苗菜下胚轴长,这可能是因为,植物感受到红光后,会导致植物体内光敏色素远红光(Pfr)构型与红光构型(Pr)构型的转化,从而影响植株的内源激素,加速了茎的细胞分裂和伸长所导致的[23-25]。红光处理下可食鲜重也高于白光、蓝光以及UV-B处理。这可能与红光提高植物光合速率和碳水化合物的积累有关[26]。
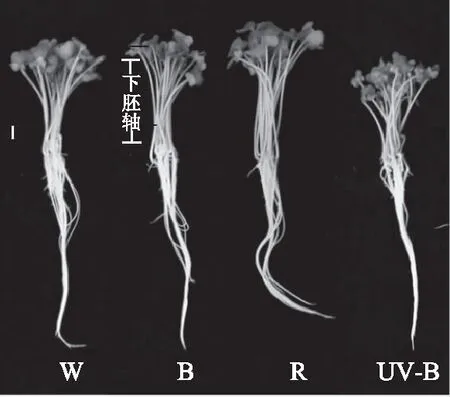
图1 光质处理对西兰花芽苗菜形态的影响Fig.1 Effects of light quality treatment on morphology on broccoli sprouts注:W-白光;B-蓝光;R-红光;UV-B-紫外光B。
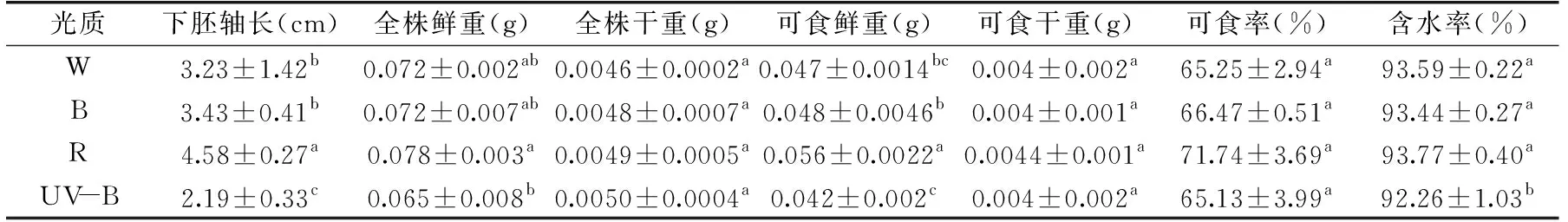
表2 光质对西兰花芽苗菜生长的影响Table 2 Effects of light quality on the growth of broccoli sprouts
2.2 光质对西兰花芽苗菜可溶性糖、可溶性蛋白和游离氨基酸含量的影响
可溶性糖含量可反映出环境对植物生长发育造成的影响。如图2A所示,单色光处理后子叶中可溶性糖含量均比白光显著性(p<0.05)提高,其中UV-B处理后的可溶性糖含量最高,提高了69.49%。水果与蔬菜中可溶性蛋白和氨基酸,参与调控多种代谢过程,并作用于氮源的同化和源-库转运[27]。图2B结果表明,与对照相比,蓝光和UV-B下可溶性蛋白的含量在子叶中分别显著提高了18.26%和8.70%;不同光照条件下,蓝光和UV-B处理的芽苗菜下胚轴中可溶性蛋白含量高于红光和白光的培养,其中UV-B培养下的西兰花芽苗菜与白光和红光相比具有显著性(p<0.05)提高。如图2C所示,子叶和下胚轴中游离氨基酸含量在UV-B照射后与白光相比分别提高67.95%和12.51%。蔬菜中大多数酶是可溶性蛋白,参与调控植物的生长发育、抵御病虫害、成熟衰老等。可溶性蛋白的含量是评价蔬菜营养品质的重要指标之一[28],能够反映植物整体代谢水平。有研究[29-30]表明,蓝光和低剂量UV-B辐射促进更多蛋白质的合成和抑制蛋白质的降解。本研究发现,与对照相比,在子叶和下胚轴中,蓝光和UV-B均能显著(p<0.05)提高西兰花芽苗菜可溶性蛋白的含量,这与王虹[31]等的研究结果基本一致。这可能是由于光照促进了西兰花芽苗菜的生理代谢过程,提高了与代谢相关的酶活性。
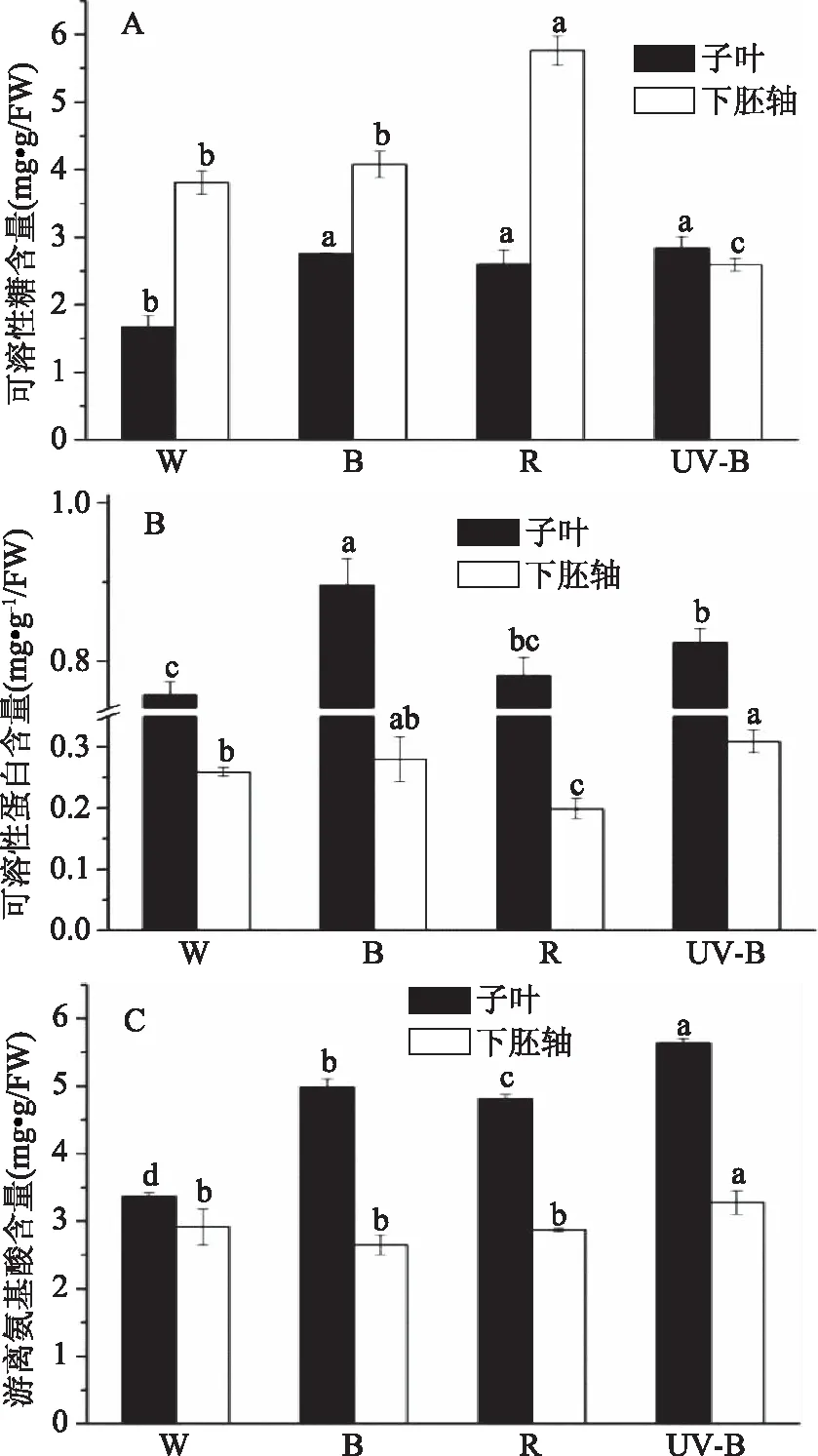
图2 光质对西兰花芽苗菜可溶性糖、蛋白和游离氨基酸的影响Fig.2 Effects of light quality on soluble sugar, soluble protein and free amino content in broccoli sprouts
2.3 光质对西兰花芽苗菜总酚、类黄酮、花青苷和维生素C含量的影响
酚类是植物次级代谢的产物,具有广泛的生物活性,这些活性包括抗氧化、抗癌、抗病毒、抗菌等[32]。一般来说,种子含有较高水平的酚类物质,可以帮助幼苗适应周围环境。有报道称,UV-B可以诱导如苹果、胡萝卜等[33-34]酚类的积累。如图3A所示,经不同光质处理后,西兰花芽苗菜下胚轴中总酚含量在UV-B处理下显著性(p<0.05)提高,比白光处理平均增加了26.04%。本研究表明,与其他LED光质相比,UV-B处理后的西兰花芽苗菜下胚轴中的酚类物质显著(p<0.05)增加。这种差异可能与UV-B促进参与酚类化合物合成酶的产生有关[35]。
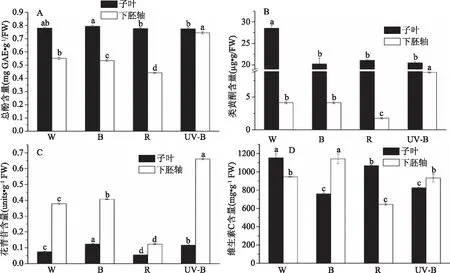
图3 光质对西兰花芽苗菜总酚、类黄酮、花青苷和维生素C含量的影响Fig.3 Effects of light quality on total phenolic,flavonoid,anthocyanin and vitamin C contents in broccoli sprouts
类黄酮是植物的重要次生代谢产物,具有清除自由基,延缓衰老和调节免疫力作用。花青苷是高等植物中主要的水溶性色素,在许多植物生理过程中起关键作用[18]。如图3B所示,与其他光质相比,UV-B显著(p<0.05)增加了西兰花芽苗菜下胚轴类黄酮含量。经蓝光、红光照射后的下胚轴中类黄酮与对照白光相比均没有提高,其中蓝光和白光处理下类黄酮含量相差甚微,没有显著性差异(p>0.05)。下胚轴中西兰花芽苗菜中类黄酮含量在UV-B处理后显著(p<0.05)高于对照组,其次是蓝光>白光>红光,这与Lee等[11]的研究结果相似。据推测,紫外线照射后黄酮含量的增加使西兰花芽苗菜有效地降低了植物表面紫外线的透过率,降低了紫外线对植物器官和组织的损伤[36]。西兰花芽苗菜的子叶和下胚轴的生理功能是不同的,两者的代谢途径不同,所以在西兰花芽苗菜子叶和下胚轴中的黄酮含量不同[37]。
如图3C所示,与对照相比,子叶中花青苷含量经蓝光和UV-B处理后分别显著(p<0.05)提高65.62%和55.35%,下胚轴中分别提高7.58%和74.75%。本研究发现,低剂量的蓝光和UV-B辐射都能有效地诱导西兰花芽苗菜子叶和下胚轴中的花青苷积累,具有在实际生产中加以应用以提高西兰花芽苗菜营养品质的可能性。此外,与白色LED灯相比,红色LED灯的花青苷诱导较弱,这与荞麦芽苗菜的研究报道相同[38]。
维生素C是西兰花以及许多其他园艺作物中最重要的营养素之一,是促进健康的重要化合物,作为强抗氧化剂,在人体内具有许多生物活性[39]。维生素C在预防动脉粥样硬化,神经和心血管疾病治疗方面也具有重要的医学价值[19]。据报道,在番茄中,环境胁迫可以诱导与维生素C合成相关基因的表达,增加维生素C含量[40]。如图3D所示,与白光相比,西兰花芽苗菜下胚轴经蓝光处理后,维生素C含量显著(p<0.05)增加;而在子叶中,不同光照条件下,红光处理的子叶中维生素C含量高于其他单色光,这与Qian[15]等研究结果相似。徐茂军等[41]发现,蓝光可通过提高 L-半乳糖脱氢(L-galactose dehydrogenase,GalLDH)的活性来提高发芽大豆中维生素C的含量,说明光质影响芽苗菜维生素C含量与其过程中关键酶的表达及活性有关。
2.4 光质对西兰花芽苗菜PAL与CHI酶活性及抗氧化能力的影响
植物酚类物质(黄酮、花青苷)合成过程中,PAL、CHI等酶起着关键作用。本试验中检测了PAL和CHI的酶活性,如图4A、B所示,蓝光和UV-B处理的西兰花芽苗菜子叶和下胚轴中PAL与CHI酶活性均比白光显著性(p<0.05)提高,子叶中PAL与CHI活性均高于对照,这与蓝光和UV-B处理下花青苷的含量影响规律基本一致。当然,PAL、CHI只是酚类物质合成途径中的第一个关键酶,有关光质对该途径中其他关键酶的影响,还需进一步研究。
抗氧化能力反映了多种抗氧化剂的协同作用,包括维生素C和酚类化合物在调节植物发育和光合作用中都有其自身的作用。如图4C、D所示,西兰花芽苗菜可食部分DPPH自由基清除能力在UV-B处理下最强,明显高于其他光质处理。超氧阴离子自由基清除能力在蓝光和UV-B处理下最高。研究采用DPPH法和抗超氧阴离子法测定酚提取物的抗氧化能力。研究发现,西兰花芽苗菜中下胚轴的抗氧化能力在UV-B处理下最高。这可能与酚类物质作为抗氧化剂相关,以保护植物免受不利环境的影响[42]。前人研究发现[43],光质处理可能会影响木质素的形成,酚类物质是木质素的前体物质,因此酚类的抗氧化能力也将受到影响。硫苷和花青苷是有效的抗氧化剂,其抗氧化能力增加可能与UV-B照射后下胚轴的含量花青素含量和硫苷含量有所提高有关。
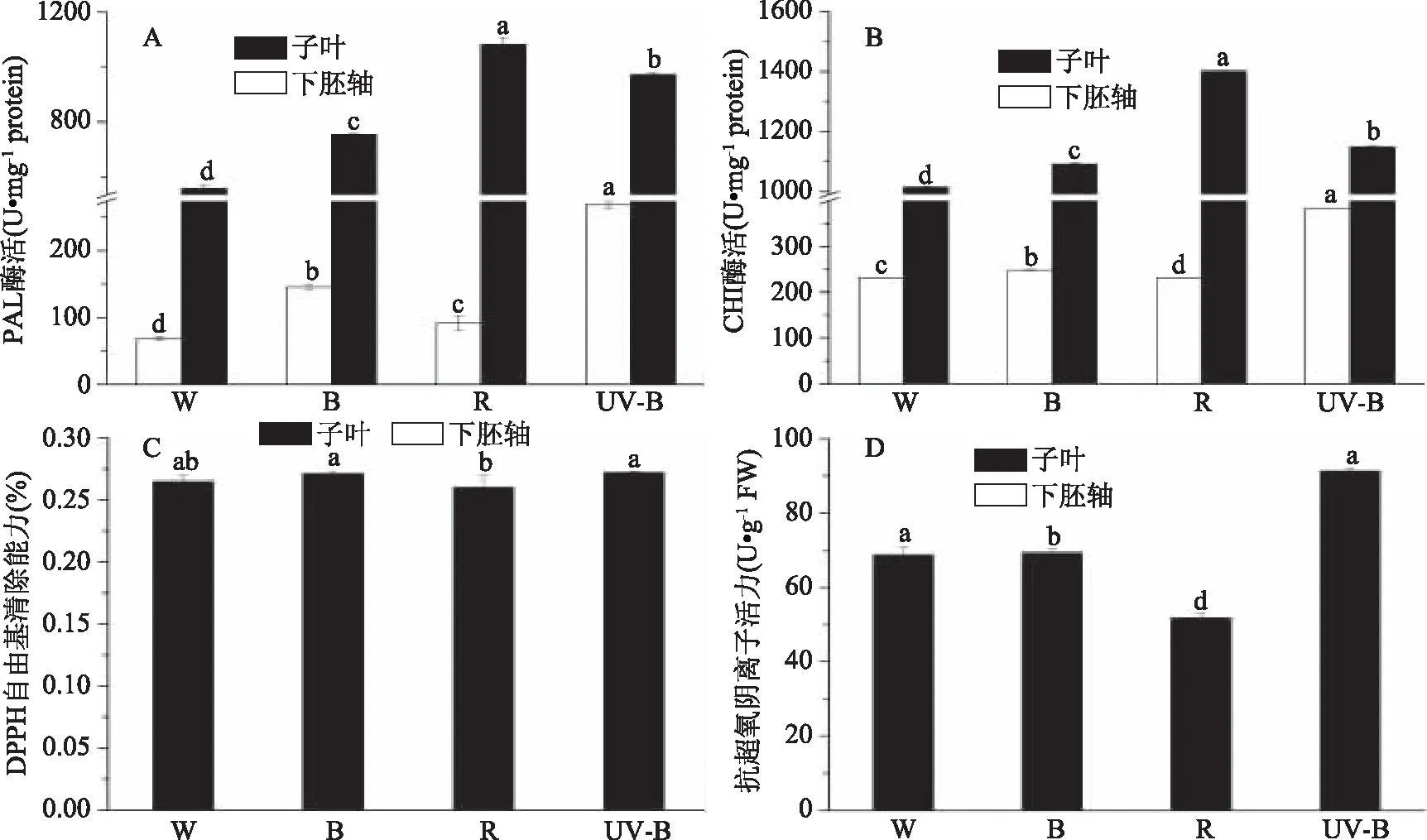
图4 光质对西兰花芽苗菜中PAL、CHI酶活和抗氧化能力的影响Fig.4 Effect of light quality on the activities of PAL,CHI and antioxidant activity
2.5 光质对西兰花芽苗菜硫苷含量的影响
硫苷是主要在十字花科作物中发现的一类含氮和硫的次级代谢产物,因为其在抗癌活性、植物防御微生物病原体和食草昆虫方面具有重要性[3,44],其分解产物已经成为被广泛研究的对象,其中萝卜硫苷的分解产物萝卜硫素是目前发现的抗癌活性最强的成分。本实验中检测到9种硫苷,其中脂肪族硫苷的比例较高。在西兰花芽苗菜的子叶和下胚轴中定量测定总硫苷含量以及单个硫苷含量(表3~表4)。如表3所示,与白光处理相比,子叶经蓝光、红光照射后均显著(p<0.05)地提高了GRA的含量。此外,相比于对照,GBS和4HGBS含量在蓝光培养后分别提高了约56%和35%。子叶中蓝光下吲哚族脂肪族硫苷的提升可能与植物内源茉莉酸诱导吲哚族硫苷的提高有关[45]。
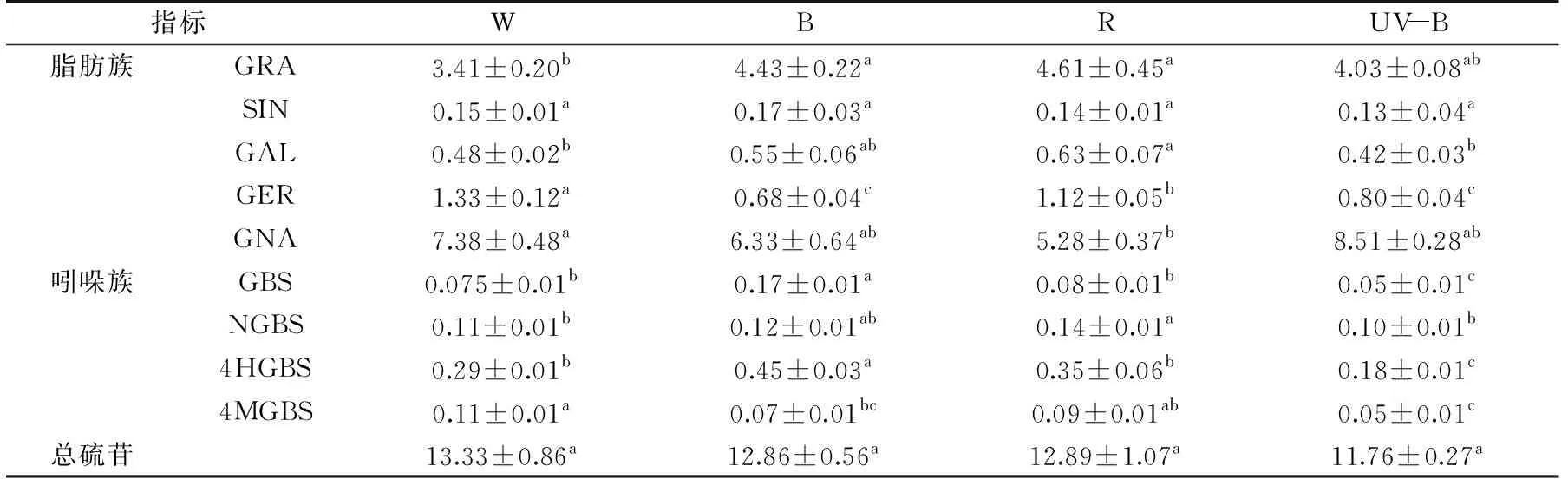
表3 不同光质处理下西兰花芽苗菜菜子叶中硫苷含量的变化(μmol/g FW)Table 3 Effect of different lights on glucosinolate composition and content in cotyledons of broccoli sprouts(μmol/g FW)
表4反映了西兰花芽苗菜下胚轴中硫苷含量的变化。蓝光和UV-B促进了GAL含量的积累,分别提高21.43%和32.14%。红光显著(p<0.05)促进了GBS的提高,其含量约为对照白光的2.7倍。GER和GNA在UV-B处理下分别提高了约3.1和2.6倍。蓝光处理的下胚轴中4HGBS含量是白光处理下的2.21倍。UV-B处理后芽苗菜下胚轴中总硫苷含量在整个处理中最高,与对照白光相比提高了约37.78%。
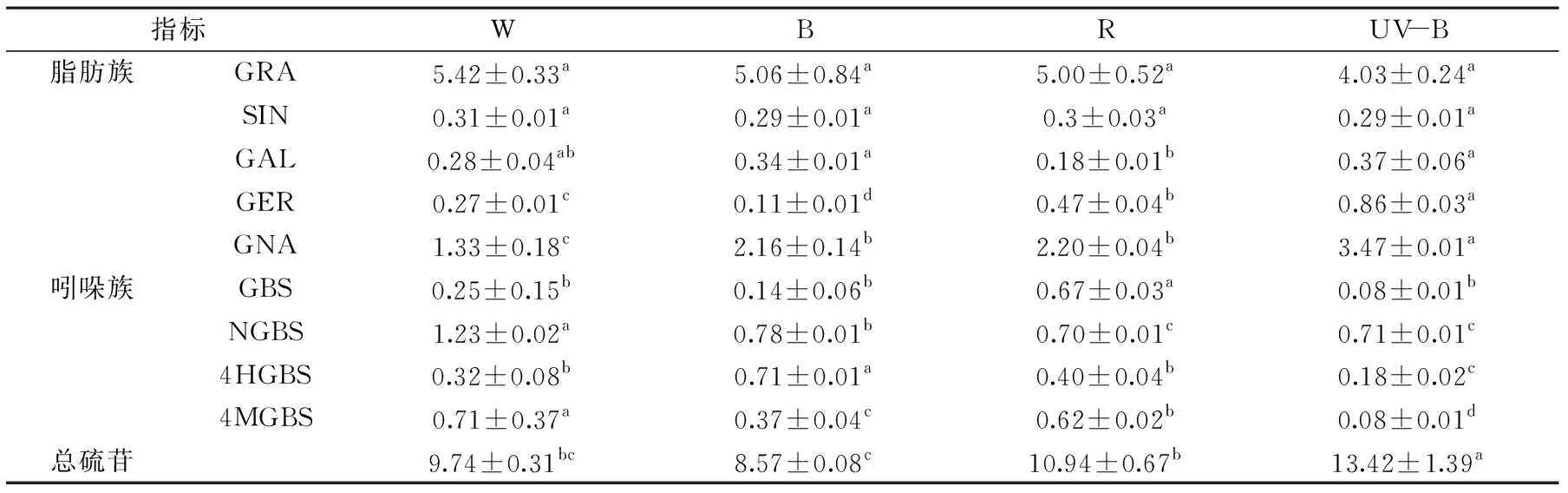
表4 不同光质处理下西兰花芽苗菜下胚轴中硫苷含量的变化(μmol/g FW)Table 4 Effect of different lights on glucosinolate composition and content in hypocotyls of broccoli sprouts(μmol/g FW)
结果表明,与对照白光相比,总硫苷含量经蓝光和红光处理后无显著性差异(p<0.05),但硫苷中最重要的单体GRA的含量在子叶中得到了显著性(p<0.05)提升。GRA在西兰花芽苗菜中不仅含量高,而且其分解产物是迄今为止抗癌活性最强的天然成分[3]。综合全文考虑,蓝光是西兰花芽苗菜实际生产中较理想的光照条件。
3 结论
蓝光照射的西兰花芽苗菜具有更高的营养品质。首先与白光相比,蓝光处理下的西兰花芽苗菜的可食鲜重并没有减少,而且蓝光处理与白光处理相比显著增加了子叶中可溶性糖含量、可溶性蛋白含量、游离氨基酸含量以及下胚轴中的维生素C含量(p<0.05)。蓝光比白光还显著提高了可食部分的花青苷含量以及相应的PAL、CHI酶活(p<0.05)。其次,蓝光比红光显著性地提高了子叶和下胚轴中的总酚、花青苷、可溶性蛋白的含量以及下胚轴中类黄酮、维生素C、子叶中游离氨基酸含量;蓝光比红光还显著性地提高了子叶中苯丙氨酸酶、查尔酮异构酶的活性(p<0.05)。与红光相比,蓝光处理下抗超氧阴离子活性和清除DPPH自由基的能力也较为显著地提高(p<0.05)。UV-B处理虽可部分提高西兰花芽苗菜的营养品质,但其效果不如蓝光处理。综合考虑,蓝光是西兰花芽苗菜实际生产中较理想的光照条件。西兰花芽苗菜富含营养与功能品质,推荐食用。
