酶解黄秋葵籽蛋白制备抗氧化肽的工艺优化
2018-12-10郭溆田硕程安玮王新坤王青刘超孙金月
郭溆,田硕,程安玮,王新坤,王青,刘超,孙金月,*
(1.山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业部新食品资源加工重点实验室,山东济南250100;2.济南市畜产品质量安全监测中心,山东济南250000)
黄秋葵(Abelmoschus esculentus L.)为锦葵科(Malvaceae)秋葵属(Abelmoschus Medic)一年生草本植物。黄秋葵种子近球形,种皮呈灰黑色至褐色,有小腺体,揉之有咖啡香味,干粒约重55 g~75 g。目前黄秋葵种子主要用于油脂的提取,随之会产生大量的饼粕。黄秋葵种子蛋白质含量丰富约占20%,脱脂后可达55%[1],蛋白质营养价值与大豆蛋白接近[2]。随着人们生活水平的不断提高,对植物蛋白的需求量也越来越大,植物蛋白不仅可作为食品添加剂,也可作为营养成分补充人体所需的蛋白质。蛋白质由于其分子量大且结构复杂,摄入人体后不易被消化吸收,从而影响了其生理功能和营养价值的有效发挥。
近年来,多肽在生物体内所发挥的生理功能受到越来越多的重视。多肽与蛋白质相比,具有结构简单分子量小的特点,多肽不仅能为机体提供营养,还具有调节植物神经系统、活化细胞免疫机能、改善心血管功能、抗衰老等多种生理活性功能[3]。氧化与人类的癌症、老化、动脉硬化等多种疾病相关,适当摄入具有抗氧化活性的物质可以降低体内自由基水平,防止脂质过氧化,帮助机体抵御疾病,对于预防和治疗心血管、糖尿病、癌症、衰老等慢性病有一定的疗效。1960年Marcuse首次报道了多肽具有抗氧化活性[4],此后对食源性抗氧化肽的活性研究引起广泛关注,并发现许多来自食物蛋白的寡肽或多肽具有抗氧化活性[5-8]。因此,通过蛋白质的可控酶解技术制备天然的抗氧化肽,研究开发多肽类抗氧化食品、保健品具有十分重要的科学意义和应用前景。
目前利用制备的黄秋葵籽粕蛋白开发活性肽的研究还鲜见报道,个别有关黄秋葵籽蛋白酶解工艺的优化多以提高水解度为目标[9]。由于水解度与抗氧化能力之间并不是单纯的线性关系[10],根据蛋白水解度制备的抗氧化肽的活性还不是很高。该研究将利用制备的黄秋葵籽粕蛋白为原料,探究应用响应面法(response surface method,RSM)优化制备抗氧化活性肽的最佳酶解条件,获得利用黄秋葵籽粕蛋白制备具有较强抗氧化活性多肽的最佳工艺,为黄秋葵籽粕的精深加工开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
黄秋葵籽收获于山东省农业科学院农产品研究所章丘龙山试验基地。将黄秋葵籽干燥后粉碎,使用石油醚作为溶剂,采用索氏提取装置去除黄秋葵籽中的油脂,获得的籽粕低温烘干后备用。
复合蛋白酶(1.5AU-A/g)、碱性蛋白酶(2.4AU-A/g)、中性蛋白酶(0.8AU-A/g)、风味蛋白酶(500LAPU/g):诺维信公司;木瓜蛋白酶(800 U/mg)、1,1-二苯基-2-苦基肼(DPPH):上海源叶生物科技有限公司;盐酸、氢氧化钠、三氯乙酸、铁氰化钾,石油醚:分析纯,国药集团化学试剂有限公司。
AR423CN型电子天平:美国奥豪斯公司;Allegra 25R型高速冷冻离心机:美国Beckman公司;LXJ-IIB离心机:上海安亭科学仪器厂;DK-S24型电热恒温水浴锅:上海精宏公司;FE20K型台式酸度计:美国梅特勒-托利多公司;907型超低温冰箱:美国赛默飞世尔公司;Lab-1A-50E型真空冷冻干燥机:北京博医康公司;UV-1800型紫外分光光度计:日本岛津公司。
1.2 方法
1.2.1 黄秋葵籽粕蛋白的制备
称取黄秋葵籽粕置于烧杯中,按1∶10(g/mL)的料液比加入去离子水,用1 mol/L NaOH溶液调整pH值到11.0,180 W超声2.5 h提取蛋白,5 000 r/min离心10 min,收集上清液,用1 mol/L盐酸调pH值至3.80,离心收集沉淀,沉淀置于-60℃真空冷冻干燥机中冻干,-20℃储存备用。
1.2.2 最适蛋白酶的筛选
称取5等份黄秋葵籽粕蛋白溶于去离子水中,分别加入不同的蛋白酶(加酶量6.25%,底物浓度2%),在各自最适温度和pH值条件下(详见表1),酶解8 h。然后将反应液置于沸水中10 min灭酶活,离心取上清液,分别测定水解度和DPPH自由基清除率,筛选出最适合黄秋葵籽粕蛋白酶解的蛋白酶。

表1 5种蛋白酶的最适酶解条件Table 1 Optimal reaction conditions of five proteases
1.2.3 多肽制备的单因素试验
选用筛选出的最适蛋白酶,设定底物浓度、加酶量([E]/[S])、酶解时间、酶解温度、酶解pH值5个单因素进行试验。在进行单因素试验时,除被考察单因素外,其它4个因素均设定为相同的固定值。采用水解度和DPPH自由基清除率为响应值,研究各种单因素对制备多肽的抗氧化活性的影响。
1.2.4 响应面优化试验
在单因素试验结果的基础上,根据Box-Behnken中心组合试验设计原理,选取加酶量(A)、酶解时间(B)、底物浓度(C)、酶解温度(D)作为自变量进行组合,以DPPH自由基清除率为响应值,确定最佳制备工艺,并进行试验验证。
1.2.5 黄秋葵籽粕蛋白酶解效果指标的测定
1.2.5.1 酶解物水解度的测定
待测样品酶解过程中,通过不断滴加0.5 mol/L NaOH溶液使混合液pH值保持不变,并记录一定时间间隔的碱液消耗量,用于计算黄秋葵籽粕蛋白的水解度。水解度(degrees of hydrolysis,DH)的计算采用pH-state法[11],该方法的原理是根据水解过程中释放质子的量对水解度进行测定。其计算公式为:
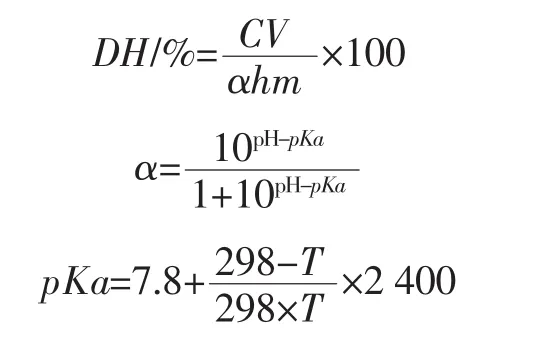
式中:C为NaOH溶液浓度,mol/L;V为NaOH溶液消耗体积,mL;m为样品蛋白质质量,g;h为每克黄秋葵籽粕蛋白原料中肽键的毫摩尔数(h=7.84 mmol/g);T为试验温度,K;α为氨基的平均离解度;pKa为α-氨基的解离度的负对数。
1.2.5.2 酶解物对DPPH自由基清除率的测定
分别配制133.3 mg/L的待测样品溶液和0.1mmol/L的DPPH溶液。取1 mL待测样品液加入1 mL DPPH溶液,混匀后室温避光反应30 min,在517 nm波长下测定吸光度值Ai。向1 mL去离子水中加入1 mL待测样品溶剂,作为空白组记录吸光度为Aj。向1 mL去离子水中加入1 mL DPPH溶剂,作为对照组记录吸光度为A0[12-14]。使用无水乙醇调零,计算公式为:
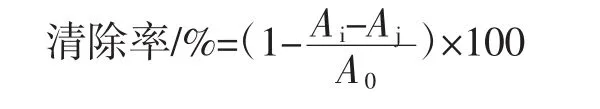
1.2.6 数据统计分析
采用SPSS Statistics 17.0软件对数据进行显著性分析,结果以平均值±标准差表示。P<0.05表示差异显著有统计学意义,P<0.01说明差异极显著。
2 结果与分析
2.1 水解蛋白酶的筛选
通过水解度和DPPH自由基清除力两个指标对水解蛋白酶进行筛选,结果表明5种蛋白酶水解得到的酶解产物的水解度和DPPH自由基清除力均不同,见图1。

图1 不同蛋白酶酶解对黄秋裤籽粕多肽水解度和DPPH自由基清除率的影响Fig.1 Effects of proteases on hydrolysis degree and DPPH radical scavenging rate of peptides prepared from okra seed meal protein
由图1A可以看出,5种酶的水解反应都符合酶反应动力学曲线变化规律,在酶反应的最初1 h内水解度随着时间的延长而逐渐增加,1 h后水解反应逐渐趋于平稳,5种酶的水解速度从高到低依次是:碱性蛋白酶>复合蛋白酶>木瓜蛋白酶>中性蛋白酶>风味蛋白酶;由图1B可以看出,碱性蛋白酶酶解后得到的多肽对DPPH自由基的清除能力较强。因此,综合考虑水解度和水解产物的抗氧化能力,后续研究将选用碱性蛋白酶对黄秋葵籽粕蛋白进行酶解。
2.2 单因素试验分析
2.2.1 底物浓度对黄秋葵籽粕抗氧化肽制备的影响
固定加酶量6%、酶解时间8 h、酶解温度50℃,在pH 8.0的条件下,测定不同底物浓度对黄秋葵籽粕抗氧化肽制备的影响,见图2。
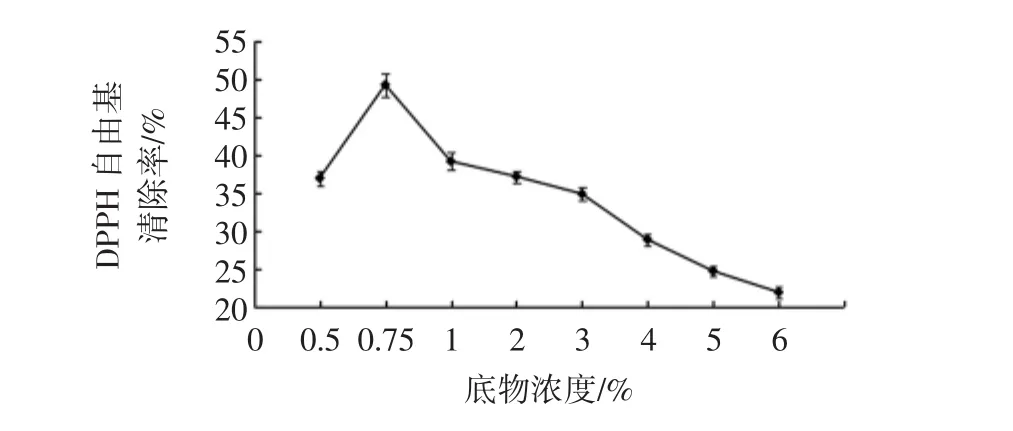
图2 底物浓度对酶解物DPPH自由基清除率的影响Fig.2 Effects of substance concentrations on DPPH radical scavenging activity of hydrolysates
结果表明,随着底物浓度的增加,DPPH自由基清除率呈现出先增加后降低的趋势,在底物浓度数为0.75%时达到最大值49.3%,随后开始降低。根据试验结果变化趋势,选择0.5%、0.75%、1.0%3个水平进行响应面优化。
2.2.2 加酶量对黄秋葵籽粕抗氧化肽制备的影响
固定底物浓度3%、酶解时间8 h、酶解温度50℃,在pH值为8.0的条件下,研究不同加酶量对黄秋葵籽粕抗氧化肽制备的影响,见图3。
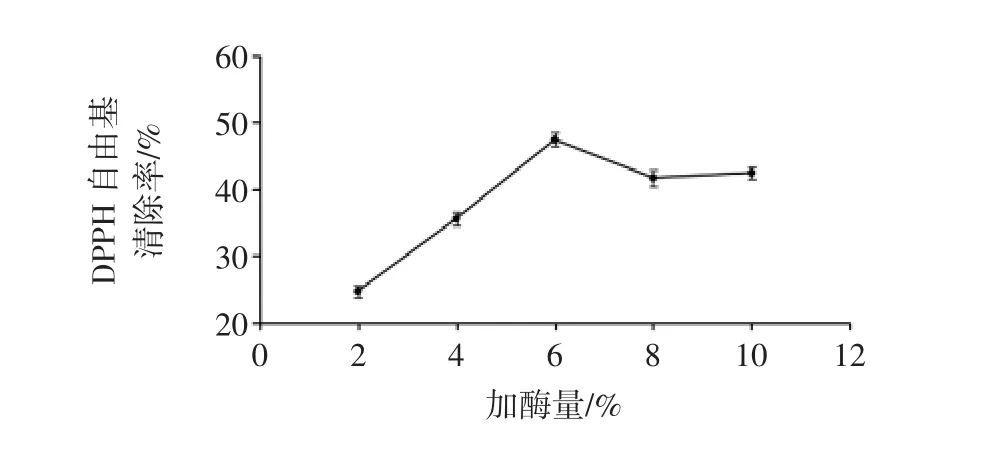
图3 加酶量对酶解物DPPH自由基清除率的影响Fig.3 Effects of enzyme dosage on DPPH radical scavenging activity of hydrolysates
结果表明,DPPH自由基清除率随着加酶量的增加呈先升后降的趋势,在2%时DPPH自由基清除率最低,仅为24.71%,在6%时清除率最高,达到47.39%,随后随着加酶量的不断增加清除率呈逐渐降低的趋势。根据试验结果变化趋势,选择4%、6%、8%3个水平进行响应面优化。
2.2.3 酶解时间对黄秋葵籽粕抗氧化肽制备的影响
固定底物浓度3%、加酶量6%、酶解温度50℃,在pH值为8.0的条件下,研究不同酶解时间对黄秋葵籽粕抗氧化肽制备的影响,见图4。
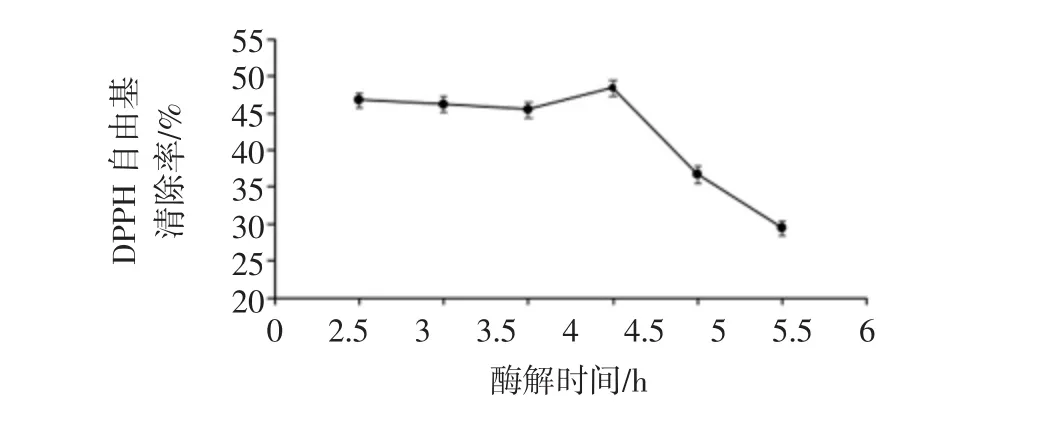
图4 酶解时间对酶解物DPPH自由基清除率的影响Fig.4 Effects of hydrolysis time on DPPH radical scavenging activity of hydrolysates
结果表明,2.5 h~4 h之间随着时间的增加DPPH自由基清除率呈现缓慢增加趋势,在4 h时DPPH自由基清除率达到最高(48.35%),随后随着时间的增加DPPH自由基清除率逐渐降低。根据试验结果变化趋势,选择3.5、4、4.5 h 3个水平进行响应面优化。
2.2.4 酶解温度对黄秋葵籽粕抗氧化肽制备的影响
固定底物浓度3%、加酶量6%、酶解时间8 h,在pH值为8.0的条件下,研究不同酶解温度对黄秋葵籽粕抗氧化肽制备的影响,见图5。

图5 酶解温度对酶解物DPPH自由基清除率的影响Fig.5 Effect of temperature on DPPH radical scavenging activity of hydrolysates
结果表明,DPPH自由基清除率在5℃时达到最大(47.59%),之后随着时间的增加,逐渐降低。根据试验结果变化趋势,选择45、50、55℃3个水平进行响应面优化。
2.2.5 pH值对黄秋葵籽粕抗氧化肽制备的影响
固定底物浓度3%、加酶量6%、酶解时间8 h、酶解温度50℃的条件下,研究不同pH值对黄秋葵籽粕抗氧化肽制备的影响,见图6。
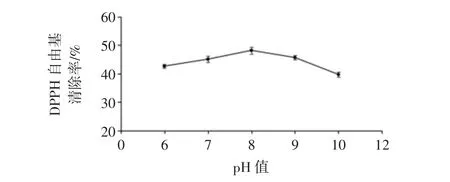
图6 pH值对酶解物DPPH自由基清除率的影响Fig.6 Effects of pH value on DPPH radical scavenging activity of hydrolysates
结果表明,随着pH值的升高,DPPH自由基清除率呈先升高后降低的趋势,在pH值为8时达到最大值,结果与碱性蛋白酶的最适pH值相吻合。因此,后续试验制备活性肽时选用的最适酶解pH值为8.0,而不选择pH值作为响应面分析的因素。
2.3 响应曲面法优化黄秋葵籽粕抗氧化肽制备工艺
2.3.1 响应面分析结果
在单因素试验的基础上,确定了相应的三水平(见表2)并进行响应面分析,以确定黄秋葵籽粕抗氧化肽的最优制备方法,结果见表3。
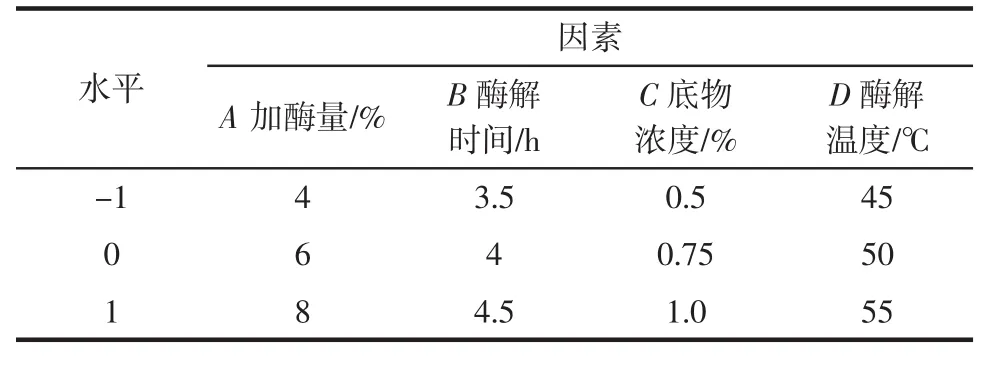
表2 响应面优化实验的自变量因素及水平设计Table 2 Independent variables and their levels used in response surface design
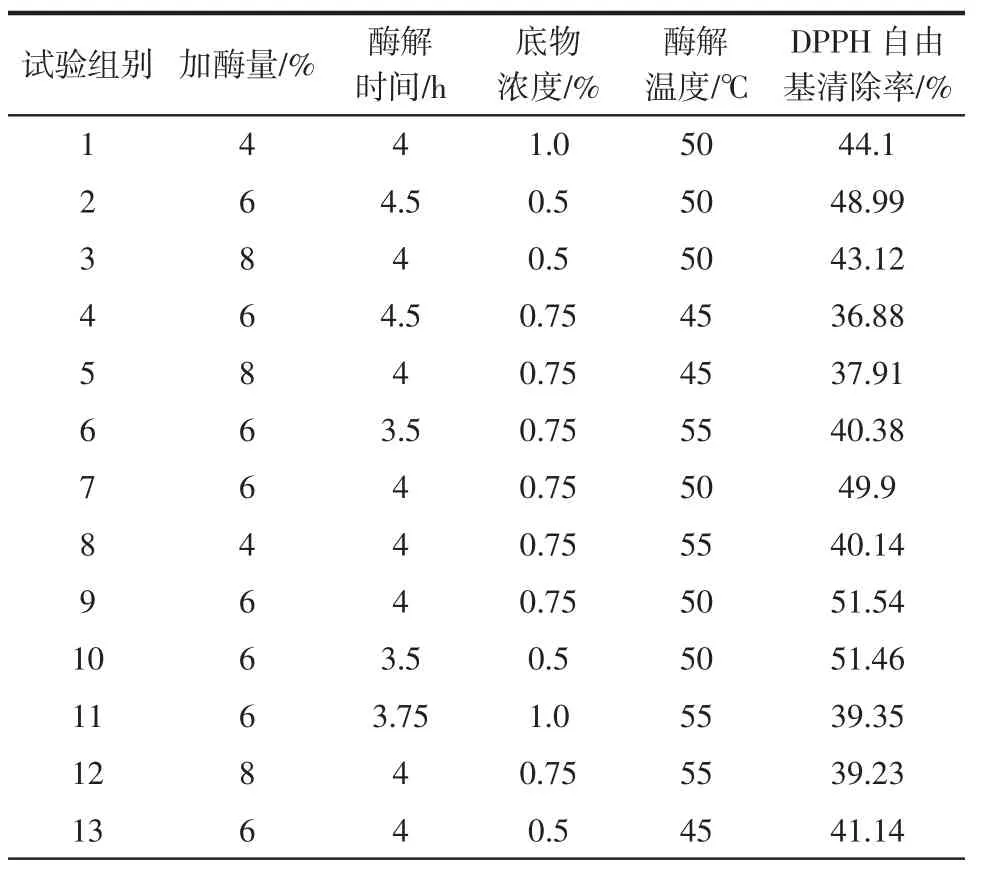
表3 响应面法试验设计及结果Table 3 Response surface experimental design and results
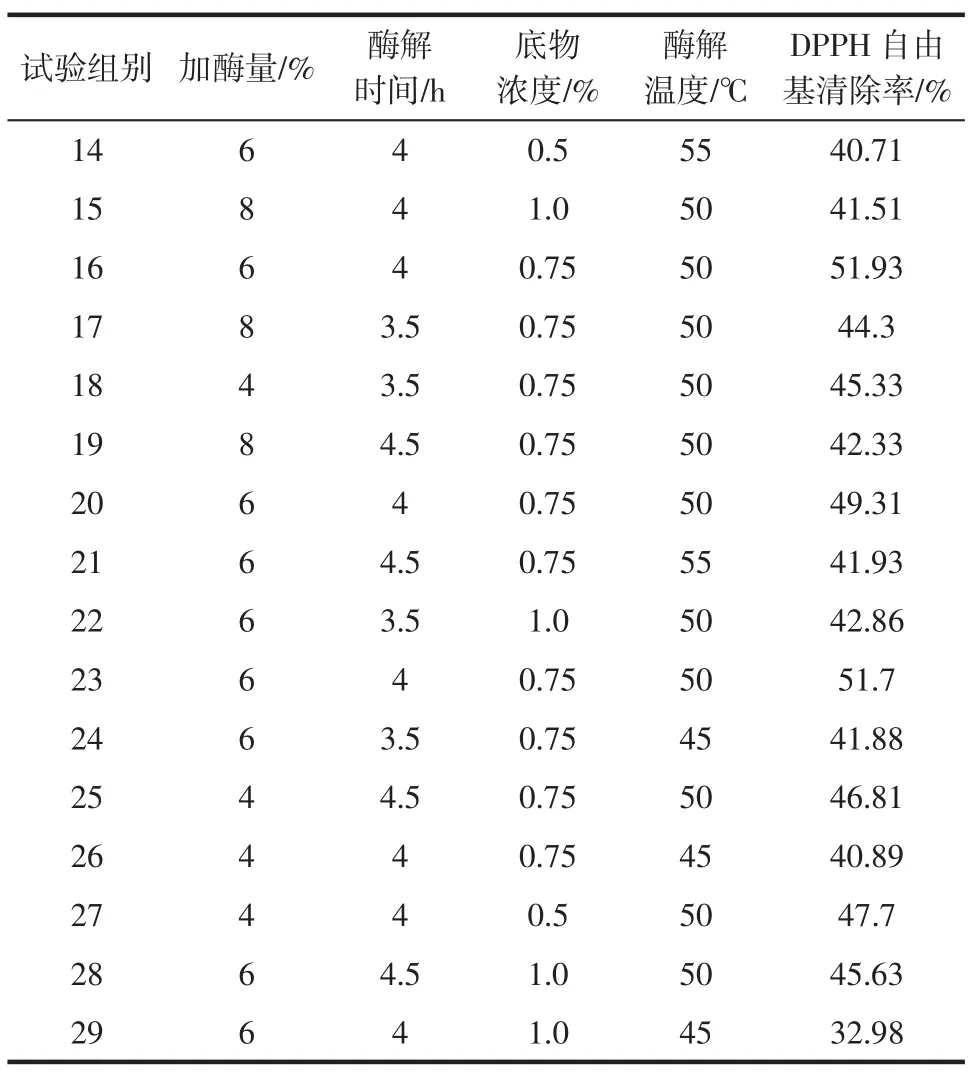
续表3 响应面法试验设计及结果Continue table 3 Response surface experimental design and results
通过Design-Expert 8.0软件对各因素进行回归拟合,根据表2得到以下多元二次回归方程:
DPPH自由基清除率Y/%=+50.88-1.38A-0.30B-2.22C+0.84D-0.86AB+0.50AC+0.52AD+1.31BC+1.64BD+1.70CD-3.67A2-1.74B2-2.89C2-8.66D2。
对黄秋葵籽粕抗氧化肽的制备工艺进行响应面分析,结果表明(表3)该模型差异显著(P值<0.000 1),具有统计学意义。失拟项不显著(P值=0.293 5>0.05),说明试验误差小。模型的决定系数R2=0.953 6,响应值(DPPH自由基清除率)与变量(底物浓度、加酶量、酶解时间和酶解温度)之间具有很好的线性关系,校正决定系数R2(adj)=0.907 2>0.80,说明总黄酮提取率的变化有90.72%来自于所选的变量。
方差分析结果表明(表4),模型的自变量二次项BD、CD、B2均达显著水平(P<0.05);一次项 A、C,二次项 A2、C2、D2均呈极显著水平(P<0.01)。根据 F 值的大小顺序推断变量对响应值的影响程度依次为:底物浓度(C)>加酶量(A)>酶解温度(D)>酶解时间(B)。

表4 二次回归模型的方差分析结果Table 4 Analysis of variance for quadric regression model
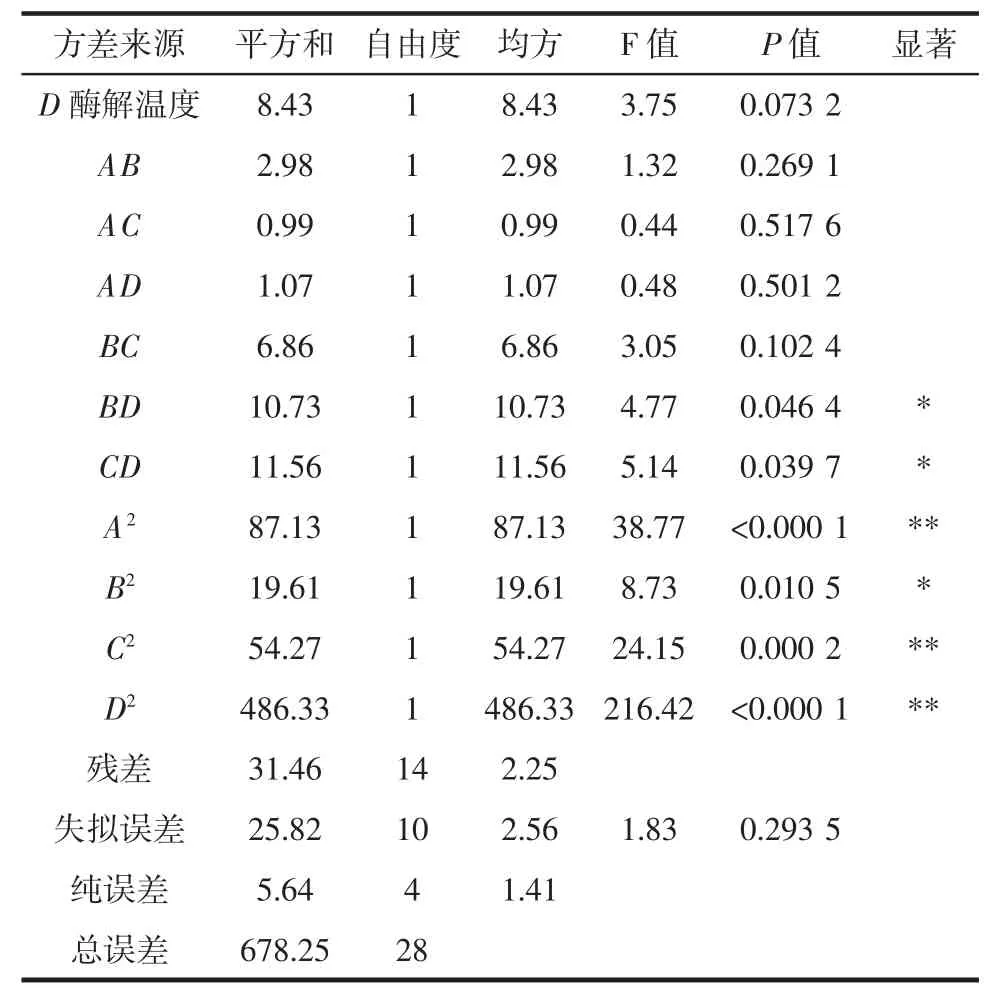
续表4 二次回归模型的方差分析结果Continue table 4 Analysis of variance for quadric regression model
2.3.2 因素间的交互影响
通过回归方程得到三维响应曲面图及相应的二维等高线图,根据其可直观地看出4个变量对响应值的影响,并确定最佳工艺条件的范围,见图7。

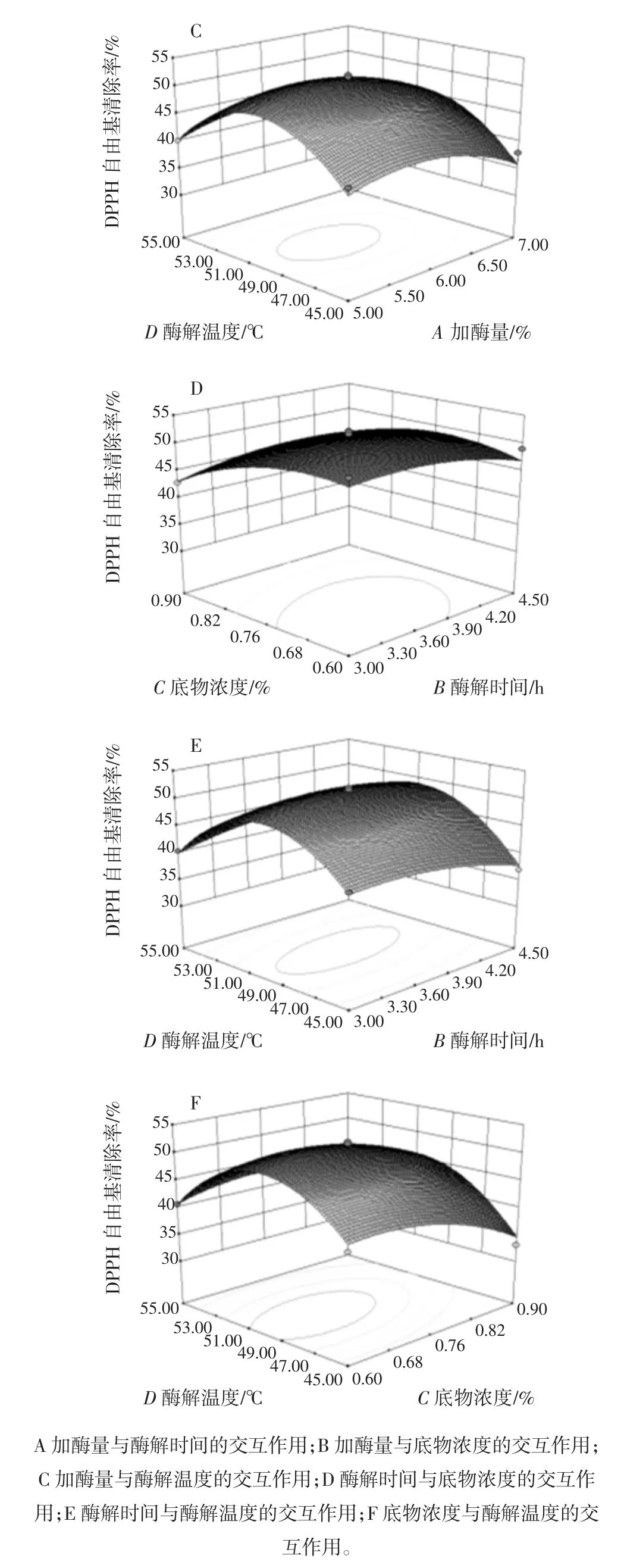
图7 任意两变量交互作用对DPPH自由基清除率影响的响应曲面图Fig.7 Response surface plots for the synergetic effects of any two variables on DPPH radical scavenging activity
结果表明,加酶量和底物浓度对酶解产物DPPH自由基清除率的影响最为显著,表现为曲面较陡;其次是酶解温度;酶解时间对总酶解产物DPPH自由基清除率的影响最小,表现为曲面较为平缓。加酶量和酶解温度、酶解时间和酶解温度以及底物浓度和酶解温度的相互作用较为显著,表现为等高线呈现椭圆形;其它因素的相互作用不显著,表现为等高线呈圆形。
2.3.3 最佳酶解条件的预测及试验验证
通过对二次多项式数学模型进行解析,得出酶解蛋白的最佳工艺条件为:加酶量5.8%、酶解时间3.81 h、底物浓度0.68%、酶解温度49.88℃、pH 8.0。该条件下,黄秋葵籽蛋白酶解产物对DPPH自由基清除率的预测值为51.54%。为检验该方法的可靠性,根据实际的操作条件,将黄秋葵籽蛋白酶解的最佳条件修正为:加酶量6%、酶解时间3.8 h、底物浓度0.7%、酶解温度50℃、pH 8.0。修正条件下,实际测得黄秋葵籽蛋白酶解产物对DPPH自由基清除率为50.83%,与预测值相比偏差为1.38%,证实了模型的有效性。
3 结论
选用5种蛋白酶对黄秋葵籽粕蛋白进行酶解,以蛋白水解度和DPPH自由基清除率为指标,筛选确定碱性蛋白酶为水解黄秋葵籽粕蛋白的最佳蛋白酶。在单因素试验结果的基础上,以DPPH自由基清除率为响应值,采用响应曲面法对黄秋葵籽粕蛋白制备抗氧化肽的工艺条件进行优化,建立了二次多项式数学模型,具有良好的显著性。试验结果表明,加酶量和底物浓度对酶解产物DPPH自由基清除率的影响最为显著。利用黄秋葵籽粕蛋白制备抗氧化肽的最佳条件为:加酶量6%、酶解时间3.8 h、底物浓度0.7%、酶解温度50℃、pH 8.0,该条件下通过试验获得的DPPH自由基清除率为50.83%,与模型预测值相近,充分验证了该模型的可靠性。该研究利用黄秋葵籽粕蛋白作为原料开展制备抗氧化肽的研究,旨在提高黄秋葵种子及其籽粕的利用率,为黄秋葵种子及其籽粕的精深加工与开发利用奠定了理论技术基础,并且具有较强的实际应用价值。
