长白山野生软枣猕猴桃总黄酮提取工艺的优化
2018-12-10彭雪刘振春张悦周瑾琨
彭雪,刘振春,张悦,周瑾琨
(吉林农业大学食品科学与工程学院,吉林长春130118)
野生软枣猕猴桃(Actinidia arguta Sieb.et Zucc.),俗名软枣子、猕猴梨、藤瓜,属于猕猴桃科(Actinidiaceae),猕猴桃属(Actinidia)多年生落叶藤本植物[1-4]。分布于我国吉林省、黑龙江省、山东省及华北、西北地区。每年8月~9月成熟,是长白山区著名的经济野果之一,是珍贵的野生果中之王,其颜色翠绿,细嫩多汁,风味独特,酸甜适口,被誉为“世界之珍果”。野生软枣猕猴桃果实营养丰富,富含多种功能性成分,如氨基酸、维生素及黄酮等,是开发功能保健食品的绝佳原料[5-10]。黄酮类化合物是长白山野生软枣猕猴桃的主要活性成分之一,具有抗氧化、抗病毒、防治心脑血管疾病、保肝护肝以及提高机体免疫力等生理功能[11-14]。
提取软枣猕猴桃中的黄酮主要用乙醇提取法[15]。也有研究者使用超声波或微波辅助溶剂提取法[16],可有效提高软枣猕猴桃中黄酮的得率。由于提取长白山野生软枣猕猴桃需要消耗大量的提取剂,生产成本较高,急需优化长白山野生软枣猕猴桃中总黄酮的提取工艺,提高其得率,降低生产成本。本试验利用乙醇溶液作为提取剂,采用超声波微波协同技术提取总黄酮,旨在减少溶剂用量,提高生产效率,为长白山野生植物资源的综合利用和开发提供理论依据。
1 材料与方法
1.1 材料与试剂
长白山野生软枣猕猴桃:吉林省通化市(9月份采摘)。
芦丁标准品:中国药品生物制品鉴定所;无水乙醇、石油醚、NaNO2、NaOH、Al(NO3)3:分析纯,沈阳化学试剂厂。
1.2 仪器与设备
FZ102型微型植物式样粉碎机:天津泰斯特仪器有限公司;FA2104型电子分析天平:上海精密科学仪器有限公司天平仪器厂:TDL-4型离心器:上海安亭科学仪器厂;TU-1901型紫外可见分光光度计:北京普析通用仪器有限公司;JY99-2D超声波细胞粉碎机:宁波新芝生物科技股份有限公司;UWave-1000微波-紫外-超声波三位一体合成萃取反应仪:上海新仪微波化学科技有限公司;LG 0.2型真空冷冻试验机:沈阳航天新阳速冻设备制造有限公司。
1.3 方法
1.3.1 长白山野生软枣猕猴桃鲜果预处理
将新鲜长白山野生软枣猕猴桃用蒸馏水洗净并于0.55%抗坏血酸溶液中浸泡15 min[17],沥干捣碎后,65℃真空冷冻干燥至恒重,粉碎过筛,制得软枣猕猴桃干粉。准确称取一定量粉粹过筛的软枣猕猴桃粉于烧杯中,加入60%乙醇溶液,在超声波微波设备中,于不同条件下提取野生软枣猕猴桃黄酮。将浸提后的萃取液于4 000 r/min离心10 min,收集上清液,定容至10 mL,得到长白山野生软枣猕猴桃黄酮提取液。
1.3.2 黄酮标准曲线的建立
黄酮含量的测定方法采用Al(NO3)3-NaNO2显色法[18-19]进行含量测定,内容稍作修改。精确称取10 mg芦丁标准品,以30%乙醇定容至50 mL,摇匀。分别准确吸取芦丁标准溶液 0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL于7个10 mL比色管中,加入0.2 mL 5%NaNO2,摇匀静置6 min,再加入0.2 mL 10%Al(NO3)3,摇匀静置6 min,然后加入2.0 mL 4%NaOH,用蒸馏水稀释至刻度,摇匀静置15 min后,在波长510 nm处测定吸光度,并以芦丁标准品浓度(mg/mL)为横坐标,吸光度(A)为纵坐标绘制标准曲线,得线性回归方程为:y=0.292 1x+0.003 5,R2=0.999 8,由数据可以分析得出标准品具有良好的线性关系。
1.3.3 长白山野生软枣猕猴桃黄酮含量的测定
取1.0 mL长白山野生软枣猕猴桃提取液加入10 mL比色管中,加入0.2 mL 5%NaNO2,摇匀静置6 min,再加入0.2 mL 10%Al(NO3)3,摇匀静置6 min,然后加入2.0 mL 4%NaOH,用蒸馏水稀释至刻度,摇匀静置15 min后,在波长510 nm处测定吸光度,代入标准曲线,按下式求得比色管中长白山野生软枣猕猴桃黄酮得率。
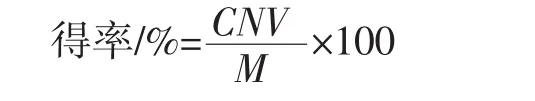
式中:C为长白山野生软枣猕猴桃总黄酮质量浓度,g/mL;N为稀释的倍数;M为称取长白山野生软枣猕猴桃粉末的质量,g;V为提取液体积,mL。
1.3.4 单因素试验
准确称取5.000 g长白山野生软枣猕猴桃粉末,在乙醇浓度为60%条件下,分别研究不同的液料比、超声功率、超声处理时间、微波功率、微波处理时间对长白山野生软枣猕猴桃黄酮得率的影响。提取的基本条件是:60%的乙醇溶液作为提取剂、液料比25∶1(mL/g)、超声与微波温度控制在70℃以内、超声功率350 W、超声处理时间7 min、微波处理功率360 W、微波处理时间336 s。各因素水平为:超声波功率200、250、300、350、400、450、500 W;超声处理间 4、5、6、7、8、9、10 min;微波功率 240、300、360、420、480、540、600 W;微波处理时间 48、144、240、336、432、528、624 s。
1.3.5 响应面优化试验方案
采用响应面法进行试验数据处理,选用Box-Behnken模型对影响超声-微波协同技术提取长白山野生软枣猕猴桃黄酮得率的因素进行响应面设计,以得率为响应值进行优化。
1.3.6 数据处理与统计分析
试验操作重复3次取平均值,计算标准误差并制图分析。试验方案设计和模型构建采用Design Expert 8.0.6软件,数据处理采用Origin Pro 8.5进行,统计分析采用SPSS 18.0软件中的单因素ANOVA进行,显著性水平为P<0.05,高度显著为P<0.01,极显著为P<0.001。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 超声功率对黄酮得率的影响
超声功率对黄酮得率的影响见图1。
由图1可知,超声功率对黄酮得率产生了比较明显的影响,随着超声功率的增大而增加,但当功率超过350 W后,黄酮得率下降,故选用超声功率为350 W。这种现象与其它报道类似[20-22]。由SPSS 18.0数据分析软件分析,P<0.05,说明超声功率对黄酮得率影响差异显著。

图1 超声功率对黄酮得率的影响Fig.1 Effect of ultrasonic power on the yield
2.1.2 超声时间对黄酮得率的影响
超声时间对黄酮得率的影响见图2。

图2 超声时间对黄酮得率的影响Fig.2 Effect of ultrasonic time on the yield
由图2可见,超声时间对长白山野生软枣猕猴桃黄酮得率影响较小,随着时间的延长,黄酮得率不断增加,当时间为7 min时,得率最高,超过7 min后,黄酮得率略有下降,故选择7 min为提取黄酮的超声时间。在一些报道中不同原材料提取总黄酮也观察到类似现象[23]。根据SPSS 18.0数据分析软件处理知,P>0.05,说明超声时间对黄酮得率影响不显著。
2.1.3 液料比对黄酮得率的影响
液料比对黄酮得率的影响见图3。
由图3可知,在试验选取的液料比范围内,提取液用量少时得率较小,随着提取液用量的增加,得率呈逐渐上升的趋势[24],但当液料比到 25 ∶1(mL/g)后,得率逐渐下降,从节约成本的角度考虑,选择液料比为 25 ∶1(mL/g),根据 SPSS 18.0 软件分析,P<0.05,液料比对长白山野生软枣猕猴桃黄酮得率有显著性的影响。

图3 液料比对黄酮得率的影响Fig.3 Effect of liquid-solid ratio on the yield
2.1.4 微波功率对黄酮得率的影响
微波功率对黄酮得率的影响见图4。

图4 微波功率对黄酮得率的影响Fig.4 Effect of microwave power on the yield
由图4可知,当微波功率为360 W时,得率最大,超过360 W,可能由于强烈的热效应使有效成分遭到破坏,导致得率降低,因此,选取微波功率为360 W。这一变化趋势与杜广芬等[25]报道相似。根据SPSS 18.0数据分析软件处理知,P<0.05,说明微波功率对长白山野生软枣猕猴桃黄酮得率影响显著。
2.1.5 微波时间对黄酮得率的影响
微波时间对黄酮得率的影响见图5。
由图5可以看出,在微波处理时间为48 s~336 s范围内时,由于细胞壁破裂程度不断增加,336 s时,细胞破裂程度达到最大,从而使野生软枣猕猴桃黄酮得率缓慢上升,在225 s后,野生软枣猕猴桃细胞壁基本破壁完全,同时由于持续的加热破坏了软枣猕猴桃黄酮成分,而使得率下降,所以选微波时间为336 s(即微波处理7次,每次48 s)。这一变化趋势与文献[26]报道的相似。由SPSS 18.0数据分析软件分析,P<0.01,说明微波时间对野生软枣猕猴桃黄酮得率影响高度显著。

图5 微波处理时间对黄酮得率的影响Fig.5 Effect of microwave treatment time on yield
2.2 Box-Behnken试验设计与结果
由单因素试验结果可知,不同试验因素对长白山野生软枣猕猴桃黄酮得率的影响有所不同。对单因素试验结果的方差分析发现:超声波功率、液料比、微波功率、微波时间对黄酮得率的影响均为显著。因此,选用以上因素作为试验因素,设计Box-Behnken试验以优化提取条件,以黄酮得率为评价指标,确定超声波-微波协同法提取长白山野生软枣猕猴桃中黄酮的较适条件。
2.2.1 回归模型的建立与显著性分析
Box-Behnken试验方案与结果如表1所示。利用统计软件Design-Expert 8.06对表1中所得的数据进行分析,方差分析结果见表2。

表1 Box-Behnken试验设计及结果Table 1 Design and results of Box-Behnken experiments
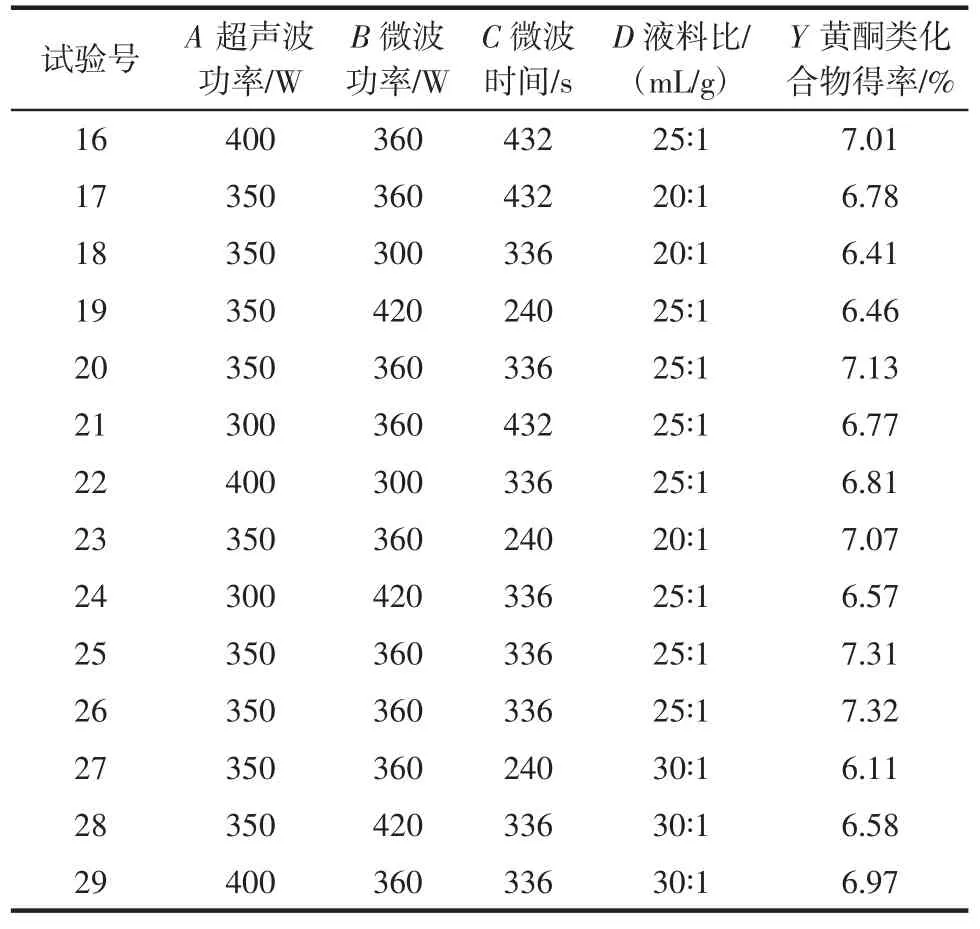
续表1 Box-Behnken试验设计及结果Continue table 1 Design and results of Box-Behnken experiments

表2 Box-Behnken试验结果方差分析Table 2 ANOVA of Box-Behnken experimental results
因素经回归拟合,得到如下四元二次回归方程为:Y=7.33+0.18A+0.075B+0.13C-0.11D-0.077AB-0.058AC+0.065AD+0.028BC-0.22BD+0.37CD-0.22A2-0.45B2-0.36C2-0.16D2。
由表2回归模型方差分析可知,回归模型P值均小于0.000 1,达到了极显著水平,说明该模型显著回归,方程能够正确反映长白山野生软枣猕猴桃黄酮得率与各因素之间的关系。模型的失拟项P=0.632 3>0.1,不显著,说明此回归模型与实际情况拟合得很好,试验误差小,不存在其他未考虑到的因素。模型中一次项 A、B、C、D,二次项 A2、B2、C2、D2和交互项 BD、CD表现为差异极显著,说明这几个因素对黄酮得率影响极大,且所考虑因素对响应值影响不是简单的一次线性关系。AB为差异高度显著,交互项除AC、BC不显著。根据F值大小,可知影响因素的主次顺序为:A>C>B>D,即超声波功率>微波时间>微波功率>液料比。该回归模型的校正决定系数R2Adj=0.962 1,表明有96.21%的得率变异分布在所研究的4个相关因素中;决定系数为R2=0.981 1,表明实测值与预测值间有很好的拟合度。方差分析结果表明采用响应面法设计所得的回归模型有效,可适用于长白山野生软枣猕猴桃黄酮提取试验的理论预测。
2.2.2 响应面分析法对长白山野生软枣猕猴桃黄酮提取工艺的优化
两因素交互作用对黄酮得率的影响的响应面见图6。


图6 两因素交互作用对黄酮得率的影响的响应面Fig.6 Response surface of the effect of two-factor interaction on flavone yield
如图6的a、e、f所示的响应面为开口向下的凸形曲面,均有极高值,超声波功率、微波功率和微波时间方向的曲面坡度陡峭,且超声波功率方向的曲面坡度与微波功率方向相比更为陡峭(图6a),微波功率方向的曲面坡度与液料比相比更为陡峭(图6e),微波时间方向的曲面坡度与液料比相比更为陡峭(图6f),说明黄酮得率对超声波功率、微波功率和微波时间对这3个因素的变化敏感,且对超声波功率的变化更为敏感。图6a、图6b、图6c的曲面图的陡峭程度显示,可得出:超声波功率对黄酮得率的影响要大于微波功率、微波时间与液料比。同理,图6d响应面图显示微波时间对黄酮得率的影响要大于微波功率。再次验证了单因素与交互项对黄酮得率的影响的主次顺序。
2.2.3 提取工艺的优化与验证
经Design-Expert 8.0.6分析优化,可得到超声波-微波协同法提取长白山野生软枣猕猴桃总黄酮的最佳工艺条件为液料比25∶1(mL/g)、超声波功率350 W、微波功率360 W、微波时间336 s。在此条件下,根据方程得到黄酮得率的预测值为7.33%。为了验证响应面优化的可行性,采用优化后的提取条件进行5次平行试验。结果见表3。

表3 优化条件下的黄酮得率Table 3 Under the optimal conditions of flavonoid yield
结果表明,采用上述优化条件提取时,黄酮得率是7.33%,预测值与试验值的相对偏差在0.002%左右,说明Design-Exper软件响应面试验设计有效的对超声波微波协同提取黄酮的工艺参数进行了优化,证明在实践中应用该模型进行预测是可行的,具有一定的应用价值。采用超声波-微波协同法提取长白山野生软枣猕猴桃总黄酮的得率明显高于孙宁宁[15]的溶剂浸提法,说明采用超声波-微波协同法提取效果较好。
3 结论
响应面优化超声波-微波协同法提取长白山野生软枣猕猴桃总黄酮的最佳工艺条件为液料比25∶1(mL/g)、超声功率 350 W、微波功率 360 W、微波时间336 s,在此条件下黄酮得率为(7.33±0.002)%,与孙宁宁[15]的传统溶剂浸提法相比提高了3.47%。此研究对提高长白山野生软枣猕猴桃野生资源充分利用及经济价值,同时促进长白山野生资源产业的发展具有重要意义。
