不同产地北沙参多糖的性质和生物活性研究
2018-12-10景永帅张丹参苏蕾张瑞娟吴兰芳郑玉光
景永帅,张丹参,苏蕾,张瑞娟,吴兰芳,郑玉光,*
(1.河北科技大学化学与制药工程学院,河北石家庄050018;2.河北中医学院药学院,河北石家庄050200)
北沙参为伞形科植物珊瑚菜(Glehnia littoralis Fr.schmidt ex Miq.)的干燥根,其性甘,味微苦、微寒,是传统的药食同源物品,具有养阴清肺、益胃生津、调解免疫系统等功效[1-2],主产于山东、河北、内蒙及辽宁等地[3]。据文献调研,北沙参中含有苷类、多糖类、香豆素类等成分,其中多糖所占比例最大,具有免疫调节、抗氧化等多种生物活性[4-6]。
目前,对北沙参多糖(Glehnia littoralis polysaccharide,GLP)的研究主要集中于同一产地提取方法和含量测定方面[7-8],对不同产地的理化性质及生物活性的差异性报道较少。本研究以北沙参为原料,采用水提醇沉法对10个产地的北沙参多糖成分进行提取,并对各多糖的理化性质和生物活性进行研究,旨在探清北沙参的产地差异性,并为其质量评价提供理论依据。
1 材料与仪器
1.1 材料与试剂
1,1-二苯基-2-苦味基肼 (1,1-diphenyl-2-picrylhydrazyl,DPPH)、α-葡萄糖苷酶、对硝基苯-α-D-吡喃葡萄糖苷(p-Nitrophenyl-α-D-galactopyranoside,PNPG)、蓝葡聚糖、标准葡聚糖 T5000、T50000、T150000、T270000:上海阿拉丁生化科技股份有限公司生产;无水乙醇、FeSO4、水杨酸、过氧化氢、混和磷酸盐、无水碳酸钠均为分析纯。
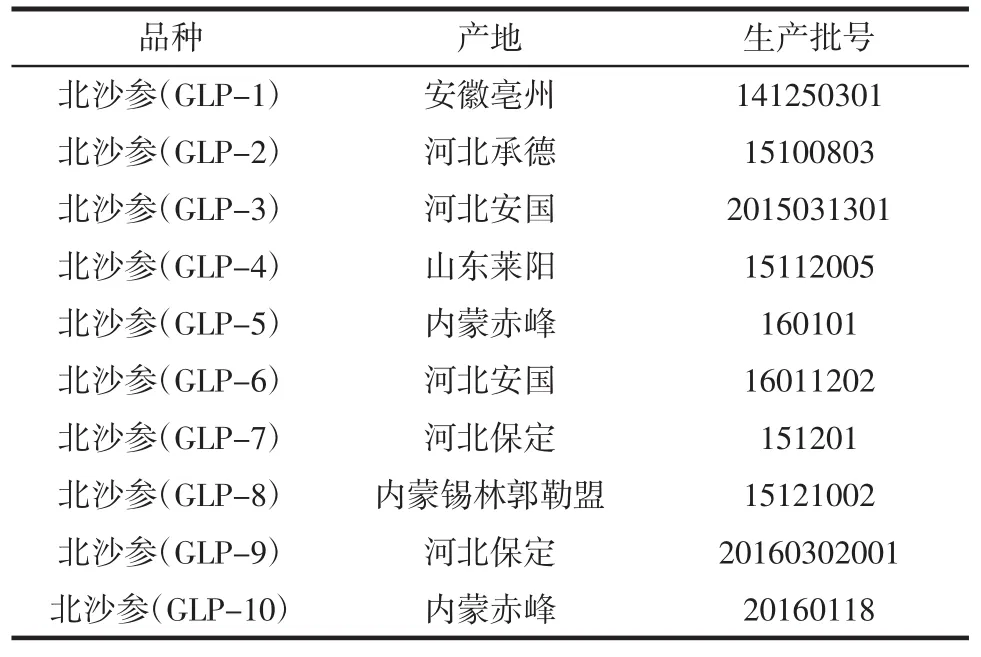
表1 10个产地北沙参样品信息Table 1 10 producing area sample of Glehnia littoralis
1.2 仪器与设备
HH-2恒温水浴锅:江苏金坛宏华仪器厂;N-1100旋转蒸发仪:东京理化株式会社;KS-300DE超声波清洗器:昆山洁力美超声仪器有限公司;UV-2550紫外-可见分光光度计:岛津仪器制造有限公司;TGL-15B高速离心机:上海安亭科学仪器厂;NDJ-4旋转黏度计:上海标卓科学仪器有限公司;S-100傅里叶变换红外光谱仪:珀金埃尔默仪器有限公司;凝胶色谱柱、BSZ-100自动部分收集器、BT-100B数显恒流泵:上海沪西分析仪器厂有限公司。
2 试验方法
2.1 北沙参多糖的提取
分别取10个产地的北沙参,粉碎,过40目筛,用3倍体积的95%乙醇回流提取2次,残渣干燥备用。取200 g北沙参残渣,加入30倍体积的蒸馏水,恒温水浴锅回流 2 h,离心(8 000 r/min、4 min),收集上清液,过滤,减压浓缩至小体积,用4倍体积的无水乙醇醇沉,静置过夜,抽滤,干燥[9],分别命名为GLP-1、GLP-2、GLP-3、GLP-4、GLP-5、GLP-6、GLP-7、GLP-8、GLP-9、GLP-10。
北沙参多糖提取率的测定:将制备的10组北沙参多糖精密称重,计算其提取率,多糖提取率/%=多糖重量/北沙参干粉重量×100。
2.2 北沙参多糖的理化性质
2.2.1 可溶性总糖含量的测定
采用苯酚-硫酸法,以葡萄糖作为标准品绘制标准曲线,根据标准曲线计算10种北沙参多糖的可溶性总糖含量[10]。
2.2.2 黏度的测定
分别称取1 200 mg10组北沙参多糖样品,在室温25℃条件下,不经超声波和任何辅助条件下溶于300mL蒸馏水中,配置成浓度为4.0 mg/mL的多糖溶液,用黏度计测定其黏度。
2.2.3 紫外-可见光谱分析
分别配制0.1 mg/mL的10组北沙参多糖溶液,用紫外-可见分光光度计在200 nm~800 nm范围内扫描[11]。
2.2.4 红外光谱分析
分别称取1.0 mg的10组北沙参多糖样品,与KBr粉末混匀后压片,傅里叶变换红外光谱仪在4000 cm-1~5 000 cm-1波数范围内扫描[12]。
2.2.5 凝胶渗透色谱法测定分子量分布
2.2.5.1 标准曲线的绘制
分 别 称 取 5.0 mg 标 准 葡 聚 糖 T5000、T50000、T150000、T270000,溶解于5.0 mL的去离子水中,分别上凝胶渗透色谱柱,以蒸馏水为洗脱液,调节凝胶渗透色谱柱流速,设置自动部分收集器收集每管3.0 mL,用苯酚-硫酸法测定样品出峰液分布。计算各标准葡聚糖出峰的洗脱体积Ve,利用已知分子量为200万的蓝葡聚糖确定凝胶柱的空体积Vo,利用无水葡萄糖确定凝胶色谱柱的总体积Vt。以有效分配系数纵坐标,以lgMw(Mw为分子质量,molecular weigh)为横坐标作标准曲线。有效分配系数由以下公式求得:有效分配系数=(Ve-Vo)/(Vt-Vo)。
2.2.5.2 测定多糖分子量及其分布
分别准确称取10组北沙参多糖样品5.0 mg,加入5.0 mL去离子水溶解。将溶解后的多糖溶液放入离心机离心处理,取离心后所得的上清液,过0.45 μm滤膜后上样,以去离子水作为洗脱液,调节凝胶渗透色谱柱的流速,设置自动部分收集器使其每管收集3.0 mL,之后将收集到的每管样品溶液经苯酚-硫酸法显色,测定其吸光度,从而检测出各多糖样品的出峰液体积分布。根据所得的多糖样品的出峰液体积数据,代入所求得的标准曲线方程,从而计算出各组多糖样品的分子量及其分布[12]。
2.3 北沙参多糖的生物活性
2.3.1 抗氧化活性
10组北沙参多糖样品清除DPPH自由基、羟基自由基的测定参照文献方法进行[13-14]。
2.3.2 对α-葡萄糖苷酶抑制活性
10组北沙参多糖样品对α-葡萄糖苷酶抑制活性的测定参照文献方法进行[15]。
3 结果与讨论
3.1 北沙参多糖的提取率、可溶性总糖含量和黏度葡萄糖标准曲线见图1。
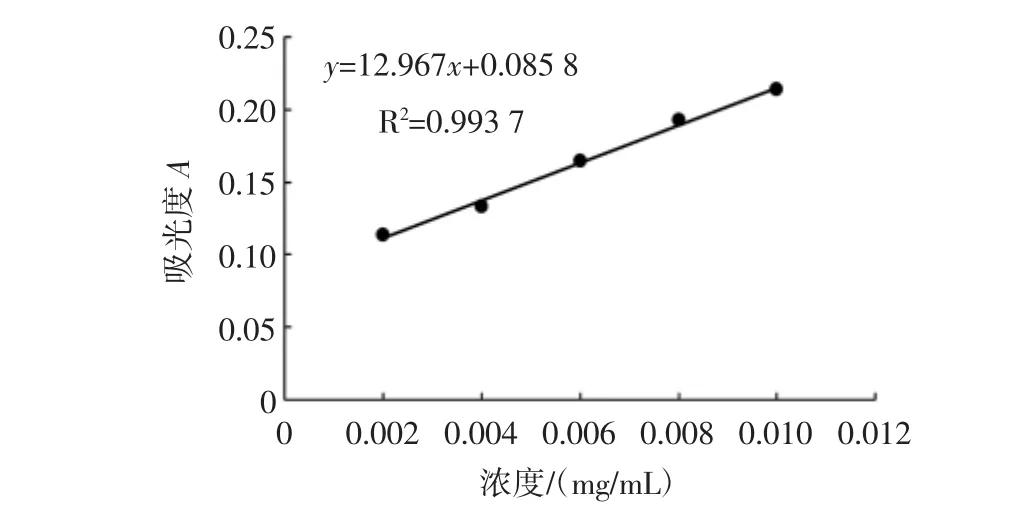
图1 葡萄糖标准曲线Fig.1 Glucose standard curve
由图1可知,标准曲线的方程为y=12.967x+0.0858,R2=0.993 7。根据公式计算10组北沙参多糖样品的可溶性总糖含量。10组北沙参多糖样品的提取率、可溶性总糖含量和黏度见表2。
由表2可知,10个不同产地的北沙参多糖提取率在(13.20±0.07)%~(26.75±0.01)%,内蒙锡林郭勒盟产北沙参GLP-8的提取率最高,为(26.75±0.01)%,安徽亳州产北沙参GLP-1的提取率最低,为(13.20±0.07)%。10种北沙参多糖的可溶性糖含量均在80%以上,内蒙赤峰产北沙参GLP-10的可溶性总糖最高,为(89.10±0.10)%,河北保定产北沙参GLP-7的可溶性总糖含量最低,为(81.28±0.02)%。室温25℃,浓度为4 mg/mL的各多糖样品溶液,内蒙赤峰产北沙参多糖 GLP-10 黏度最大,为(9.40±0.10)Pa·s,河北承德产北沙参 GLP-2 黏度最小,为(6.55±0.05)Pa·s。对可溶性总糖含量和黏度进行相关性分析,见表3。
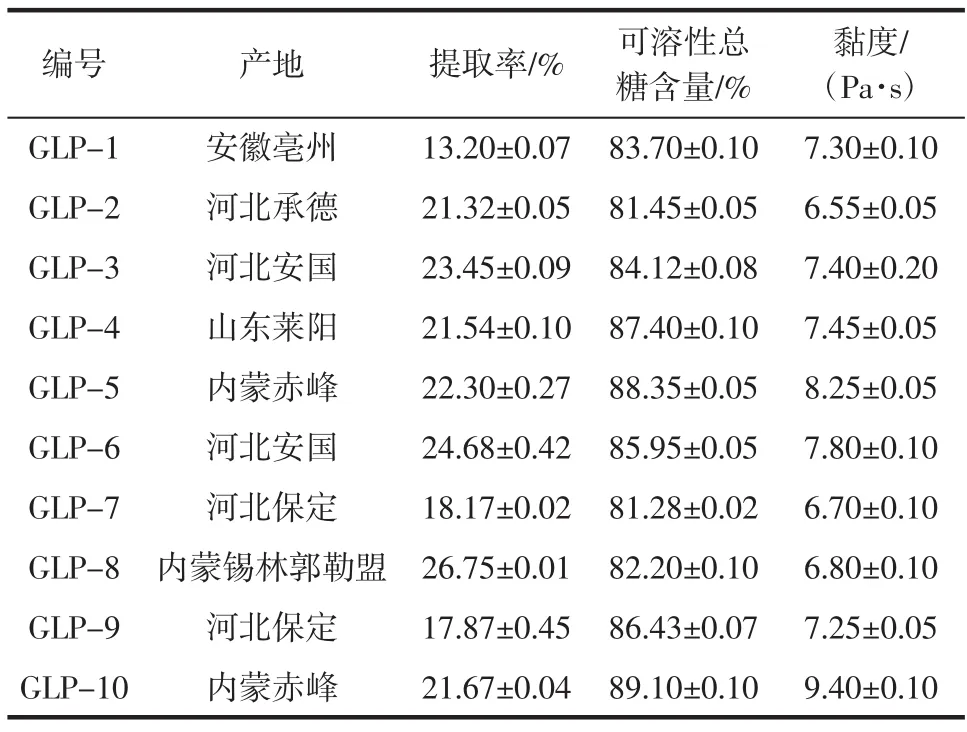
表2 10组北沙参多糖样品的提取率、可溶性总糖含量和黏度Table 2 Extraction rate,sugar content and viscosity of polysaccharides from Glehnia littoralis
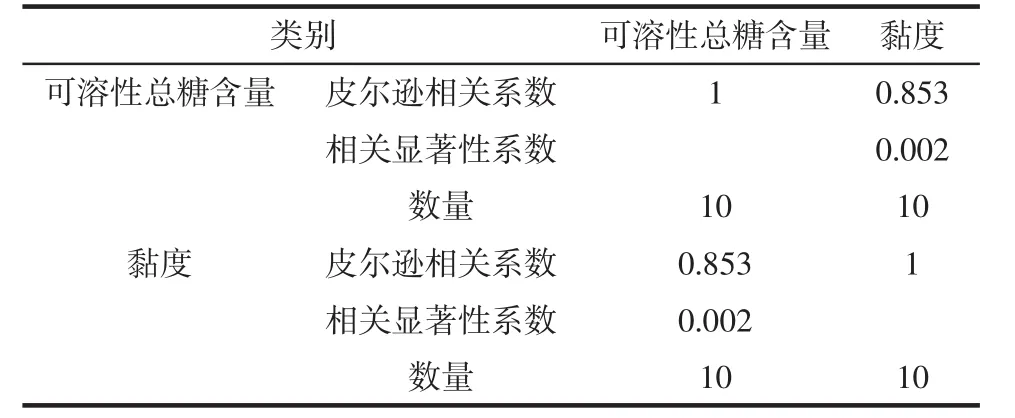
表3 可溶性总糖含量与黏度的相关性分析Table 3 Analysis of correlation between soluble total sugar content and viscosity
由表3可知相关性为0.853,属于极强相关,P为0.002,具有强显著性。说明多糖溶液的黏度和可溶性总糖含量成正相关。
3.2 北沙参多糖的理化性质
3.2.1 紫外-可见光谱分析
10组北沙参多糖的紫外-可见光谱图见图2。
由图2可知,在检测范围内,10组北沙参多糖样品均在260 nm~280 nm范围内无明显吸收,说明各产地的北沙参多糖中均不含蛋白质和核酸[16],在整个研究体系中,可排除蛋白质和核酸的影响。
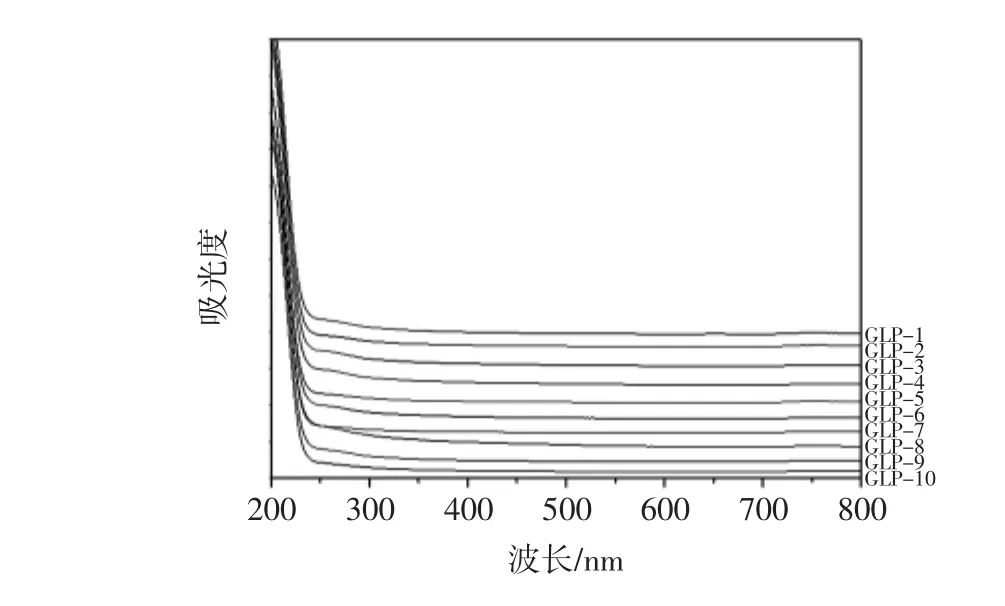
图2 10组北沙参多糖的紫外-可见光谱图Fig.2 Ultraviolet and visible spectra of 10 groups of Glehnia littoralis polysaccharides
3.2.2 红外光谱分析
10组北沙参多糖的红外光谱图见图3。
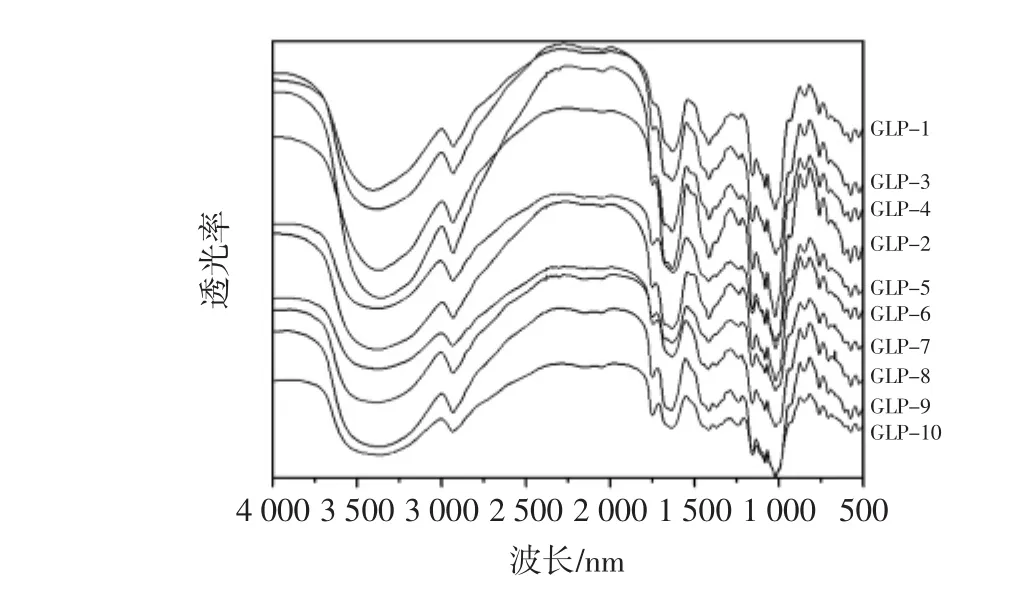
图3 10组北沙参多糖的红外光谱图Fig.3 Infrared spectra of 10 groups of Glehnia littoralis polysaccharides
由图3可以看出10组北沙参多糖的峰值,由左向右分别为:3400cm-1为-OH伸缩振动吸收峰,2 927 cm-1处为C-H伸缩振动吸收峰,1 640 cm-1处为-OH吸收峰,1 421 cm-1处为=CH2变形吸收峰,1 161 cm-1处为C-O吸收峰,1 082 cm-1处为醇羟基-OH振动吸收峰,847 cm-1处为α-型糖苷键[17]。10组不同产地的北沙参多糖的吸收峰峰形与位置相似,均具有多糖的特征吸收峰。
3.2.3 分子量分布和大小
标准葡聚糖 T5000、T50000、T150000、T270000经凝胶渗透色谱柱后测得数据,以有效分配系数为纵坐标,以lgMw为横坐标作标准曲线。计算得标准曲线方程为y=-0.409 4x+2.321 2,其R2=0.998 77,表明构建的标准曲线模型较为精确,回归效果和回归拟合效果显著。
将试验所得10组北沙参多糖样品洗脱体积代入求得的标准曲线方程,可求出10组多糖样品中的多糖分子量分布及其大小,如图4所示。
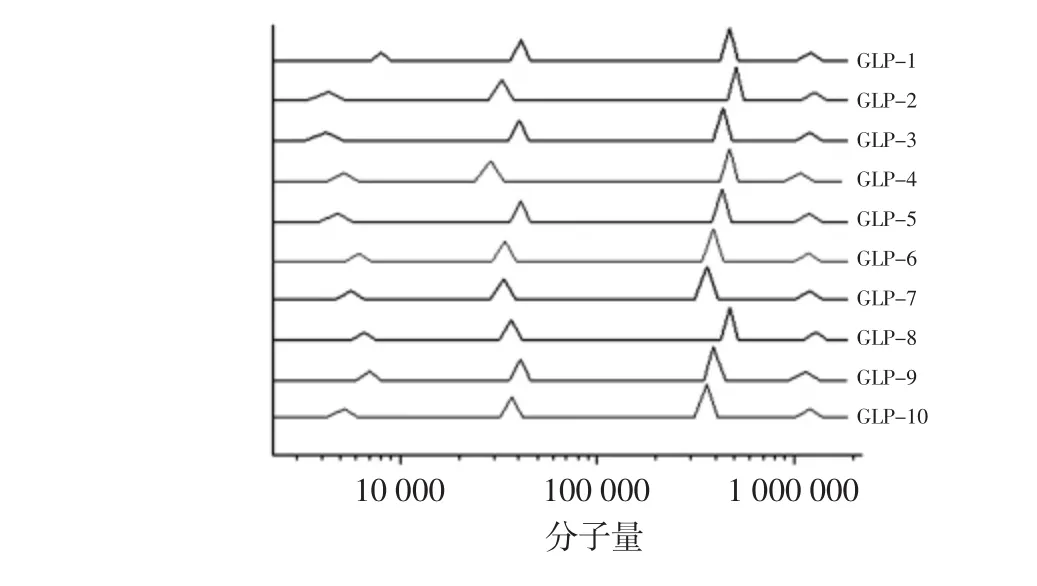
图4 10组北沙参多糖样品分子量分布Fig.4 Molecular weight distribution of 10 groups of Glehnia littoralis polysaccharides
由图4可知多糖经凝胶渗透色谱柱后,有4个特征吸收峰,即10组北沙参多糖样品均由4个不同分子量大小的多糖组分组成,但分子量之间有差别。
3.3 北沙参多糖的生物活性
3.3.1 清除DPPH自由基
10组北沙参多糖对DPPH自由基清除作用见图5。
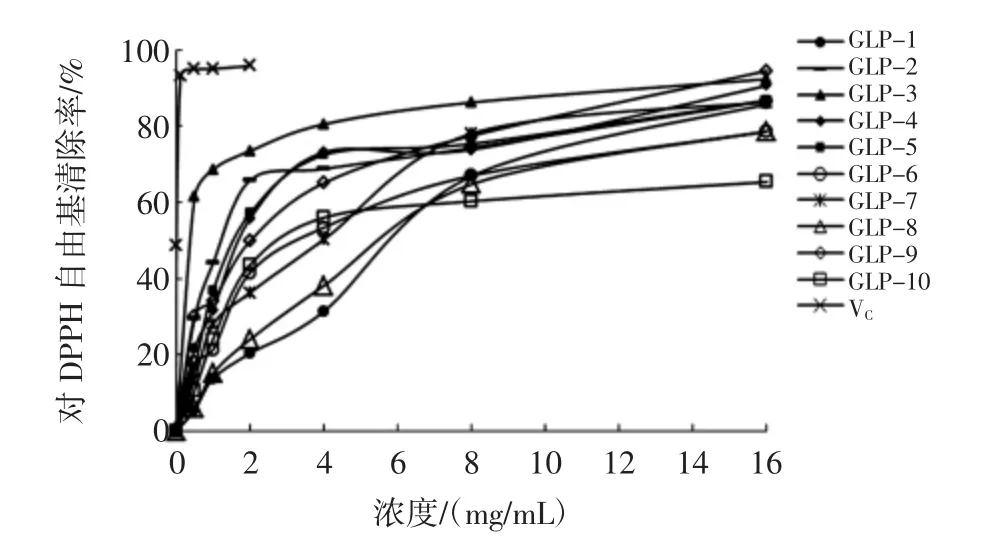
图5 10组北沙参多糖对DPPH自由基清除作用Fig.5 Scavenging effect on DPPH radical of 10 groups of Glehnia littoralis polysaccharides
由图5可知,10组北沙参多糖样品对DPPH自由基均有一定的清除作用,且呈浓度依赖性。通过比较IC50值,对照品VC和各北沙参多糖对DPPH自由基的清除作用大小:VC(0.005 mg/mL)>GLP-3(0.237 mg/mL)>GLP-2(1.324 mg/mL)>GLP-9(1.749 mg/mL)>GLP-4(1.854 mg/mL)>GLP-5 (1.868 mg/mL)>GLP-7(3.015 mg/mL)>GLP-6(3.439 mg/mL)>GLP-10(4.350 mg/mL)>GLP-1 (5.161 mg/mL)>GLP-8(5.220 mg/mL)。由此可知,河北安国产GLP-3对DPPH自由基的清除作用最强。
3.3.2 清除羟基自由基
10组北沙参多糖对羟基自由基清除作用见图6。
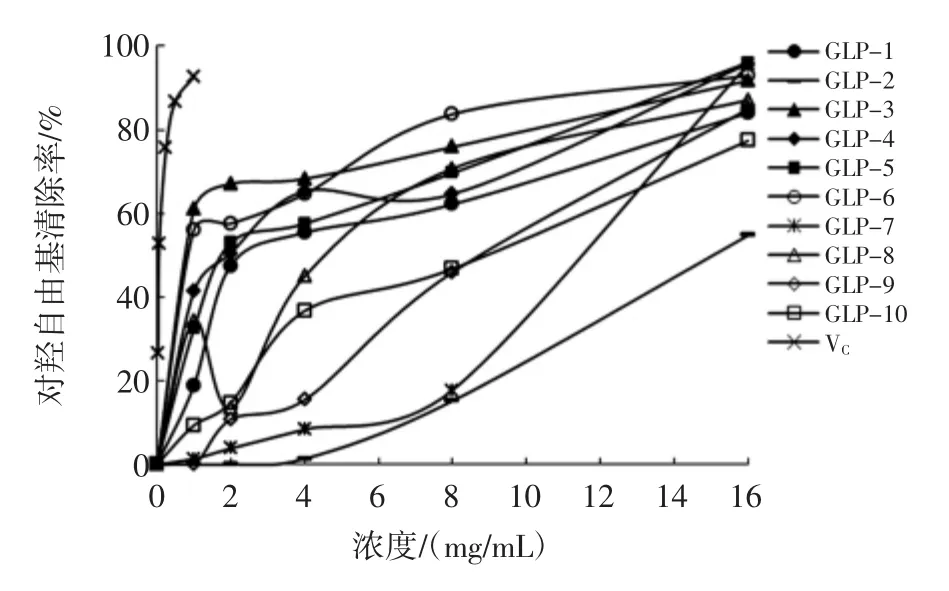
图6 10组北沙参多糖对羟基自由基清除作用Fig.6 Scavenging effect on hydroxyl radical of 10 groups of Glehnia littoralis polysaccharides
由图6可知,10组北沙参多糖样品均对羟基自由基均有一定的清除作用,且呈现浓度依赖性。对照品VC和各北沙参多糖对羟基自由基的清除作用大小(IC50值)依次为:VC(0.072 mg/mL)>GLP-3(0.564 mg/mL)>GLP-6(1.057 mg/mL)>GLP-4(1.858 mg/mL)>GLP-5(2.221 mg/mL)>GLP-1(3.323 mg/mL)>GLP-8(3.975 mg/mL)>GLP-10(7.090 mg/mL)>GLP-9(7.953 mg/mL)>GLP-7(9.542 mg/mL)>GLP-2(14.819 mg/mL)。由此可知,河北安国产GLP-3的清除羟基自由基作用最强。
3.3.3 对α-葡萄糖苷酶的抑制活性
10组北沙参多糖对α-葡萄糖苷酶的抑制作用见图7。
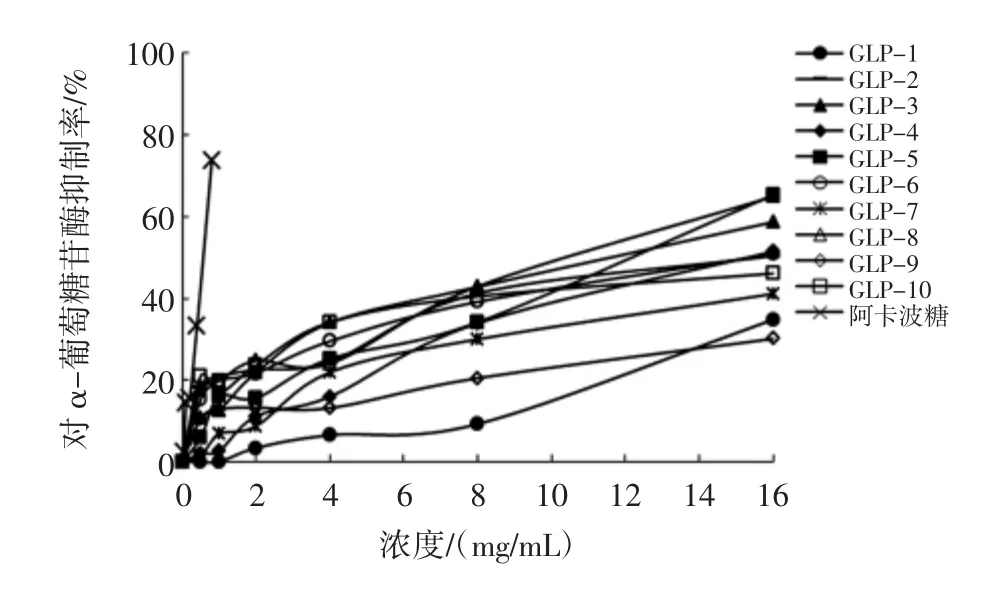
图7 10组北沙参多糖对α-葡萄糖苷酶的抑制作用Fig.7 Inhibition on α-glucosidase of 10 groups of Glehnia littoralis polysaccharides
由图7可知,10组北沙参多糖样品均对α-葡萄糖苷酶有一定的抑制作用,随着多糖浓度的升高,对α-葡萄糖苷酶的抑制能力也不断增强,当达到一定浓度时,抑制能力趋于稳定。对比IC50值,对照品阿卡波糖和各北沙参多糖对α-葡萄糖苷酶的抑制能力大小为:阿卡波糖(0.501 mg/mL)>GLP-3(10.614 mg/mL)>GLP-8(10.769 mg/mL)>GLP-5(11.485 mg/mL)>GLP-4(14.882 mg/mL)>GLP-6 (18.092 mg/mL)>GLP-2(20.850 mg/mL)>GLP-7 (20.993 mg/mL)>GLP-10(22.873 mg/mL)>GLP-1 (25.331 mg/mL)>GLP-9(264.266 mg/mL)。由此可知,河北安国产GLP-3对α-葡萄糖苷酶抑制能力最强。
4 结论
本文通过对10个产地的北沙参的多糖进行提取,对其提取率、理化性质及生物活性进行测定,结果表明,不同产地北沙参多糖的提取率存在差异,内蒙锡林郭勒盟产北沙参多糖GLP-8的提取率最高,为(26.75±0.01)%;可溶性总糖含量范围为(81.28±0.02)%~(89.10±0.10)%,其中产地为内蒙赤峰的北沙参多糖(GLP-10)最高;不同产地北沙参多糖具有相似的紫外、红外光谱学性质及分子量分布;产地为河北安国的北沙参多糖(GLP-3)对DPPH和羟基自由基的清除率以及对α-葡萄糖苷酶的抑制率最高,IC50值分别为0.237、0.564、10.614 mg/mL。不同产地北沙参多糖理化性质及生物活性存在差异,分析原因可能与不同产地北沙参的栽培管理、采收季节、加工方式的不同有关。近年来,由于市场经济刺激,多数种植户以及加工企业有抢收,或者以次充好的情况存在。在推广规范化生产技术的同时,也不能忽视生长环境对北沙参多糖的影响。
