加速溶剂萃取-固相萃取净化-气相色谱-串联质谱法检测茶叶中9种拟除虫菊酯类农药残留
2018-12-07徐瑞晗李崇勇
黄 微, 李 娜, 徐瑞晗, 李 婷, 李崇勇
(1. 汉中市食品药品检验检测中心, 陕西 汉中 723000; 2. 汉中市动物卫生监督所, 陕西 汉中 723000)
茶叶是我国的传统饮品,不仅风味独特,而且具有抗氧化、降压降脂、防癌抗癌等保健功能[1-3],深受大众喜爱。在茶叶的种植过程中,为防治虫害,农药的使用难以避免。如果农药使用不规范,或者未到安全间隔期而进行茶叶采摘,往往会导致农药残留量超标。除此之外,大气、土壤、水体等外源性污染亦是引起农药残留超标的重要原因[4]。农药残留超标不仅危害人体健康,也影响着我国茶叶在国际市场的竞争力,目前已经成为当前茶叶出口和内销最被关注和最为敏感的质量安全问题。
拟除虫菊酯类农药是一类高效、低毒、广谱的杀虫剂[4],相比于有机氯、有机磷类农药,其生物活性更优异、环境相容性更好,因此被广泛用于茶叶的种植和生产中。然而,由于拟除虫菊酯类农药对光、热较为稳定,其在自然环境下降解较慢,往往更容易导致残留问题。残留的拟除虫菊酯类农药对机体危害较大[5-7],目前国内外对于茶叶中的拟除虫菊酯类农药残留均有严格的限量规定。我国国家标准GB 2763-2016《食品中农药最大残留限量》对茶叶中的氟氯氰菊酯、氟氰戊菊酯、甲氰菊酯、联苯菊酯、氯氟氰菊酯、氯菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯等9种拟除虫菊酯类农药残留量做出了明确规定,残留量为0.1~20 mg/kg。
我国现行方法标准中对茶叶拟除虫菊酯类农药残留的检测方法主要有气相色谱(GC)法[8]和气相色谱-质谱(GC-MS)法[9]。由于茶叶基质比较复杂,易对目标组分造成干扰,采用气相色谱法容易导致假阳性的误判。气相色谱-质谱法虽然能够准确定性,但检出限和灵敏度不够理想。气相色谱-串联质谱(GC-MS/MS)法是近几年来应用日益广泛的一种农药残留检测方法,它分离性能高,比单四极杆质谱有更强的抗干扰能力和更高的灵敏度。刘丽等[10]用乙腈超声提取、串联双柱固相萃取净化,用气相色谱-串联质谱检测茶叶中的3种拟除虫菊酯类农药残留,得到的检出限为0.3~1.0 μg/kg,加标回收率为80.6%~116.3%, RSD为1.3%~12.6%。高艺美等[11]用乙腈提取、固相萃取柱净化,双内标法定量,气相色谱-串联质谱分析茶叶中的53种农药残留,得到的检出限为0.3~8.9 μg/kg,加标回收率为72.5%~130.9%, RSD为0.4%~19.4%。以上文献均显示出了用气相色谱-串联质谱法测定农药残留的高灵敏性。
加速溶剂萃取是近年来新兴的一种萃取技术,具有萃取时间短、溶剂消耗少、自动化程度高等优点,被广泛用于环境、食品中农药残留的检测[12]。然而,目前加速溶剂萃取联合气相色谱-串联质谱技术应用于检测茶叶中拟除虫菊酯类农药残留的研究尚未有相关报道。本文针对GB 2763-2016《食品中农药最大残留限量》中对茶叶做出限量规定的9种拟除虫菊酯类农药残留检测项目,利用加速溶剂萃取茶叶样品,经固相萃取柱净化,采用气相色谱-串联质谱法进行测定。所建立的方法快速简便、抗干扰能力强、检出限低、灵敏度高,实现了茶叶中拟除虫菊酯类农药残留的痕量分析,完全能够满足我国对茶叶农药残留检测的需求。
1 实验部分
1.1 仪器、试剂与材料
GCMS-TQ8040三重四极杆质谱仪、SH-RXi-5Sil MS色谱柱(30 m×0.25 mm, 0.25 μm)(日本Shimadzu公司); APLE-2000快速溶剂萃取仪(北京吉天仪器有限公司); Milli-Q超纯水仪(美国Millipore公司); IKA-RV10真空浓缩仪(德国IKA公司); MS1003S电子天平(瑞士Mettler Toledo公司)。
氟氯氰菊酯(CAS: 68359-37-5)、氟氰戊菊酯(CAS: 70124-77-5)、甲氰菊酯(CAS: 64257-84-7)、联苯菊酯(CAS: 82657-04-3)、氯氟氰菊酯(CAS: 68085-85-8)、氯菊酯(CAS: 52645-53-1)、氯氰菊酯(CAS: 52315-07-8)、氰戊菊酯(CAS: 51630-58-1)、溴氰菊酯(CAS: 52918-63-5)标准品(质量浓度均为100 mg/L,农业部环境保护科研监测所);乙腈(色谱纯,美国Sigma-Aldrich公司);乙酸乙酯(色谱纯,美国Mreda公司);正己烷、丙酮(色谱纯,美国Fisher Scientific公司);无水硫酸钠(分析纯,成都科龙化工试剂厂);硅藻土(分析纯,天津鼎盛鑫化工有限公司); Cleanert TPT固相萃取小柱(2 g/10 mL,天津博纳艾杰尔科技有限公司)。茶叶样品为日常送检样品。
1.2 标准溶液的配制
混合标准工作液的配制:将9种拟除虫菊酯类农药标准品(100 mg/L)用正己烷分别配制成10 mg/L的单标储备液,于4 ℃低温避光保存。分别移取上述9种农药单标储备液1 mL,置于同一10 mL容量瓶中,用正己烷定容至刻度,配制成1 mg/L的混合标准使用液,用正己烷逐级配制成质量浓度分别为2、5、10、20、40、100、400和1 000 μg/L的混合标准工作液,现用现配。
基质匹配标准工作液的配制:称取8份5 g空白茶叶,经加速溶剂萃取、固相萃取净化、浓缩至近干后,分别加入2 mL不同浓度的混合标准工作液,摇匀后过0.22 μm有机滤膜过滤,得到相应浓度的基质匹配标准工作液。
1.3 样品前处理
1.3.1样品提取
准确称取5.00 g粉碎均匀的茶叶样品,与5 g硅藻土混匀后,移入34 mL不锈钢样品萃取池中进行加速溶剂萃取。提取溶剂为丙酮-正己烷(1∶1, v/v),萃取压力为10 MPa,萃取温度为100 ℃,加热时间3 min,静态萃取时间为5 min,循环1次,冲洗体积为40%萃取池体积,萃取结束后氮气吹扫100 s,萃取液收集到60 mL收集瓶中。将萃取液转移至100 mL鸡心瓶中,于40 ℃水浴中减压浓缩至近干,加入2 mL乙腈-甲苯(3∶1, v/v)溶解残渣,待净化。
1.3.2样品净化
Cleanert TPT固相萃取柱中加入约2 cm高无水硫酸钠,用10 mL乙腈-甲苯(3∶1, v/v)预洗固相萃取柱,弃去流出液。将待净化液转移至固相萃取柱中,用2 mL乙腈-甲苯(3∶1, v/v)洗涤浓缩瓶,重复1次,将2次洗涤液均转入固相萃取柱中,收集流出液于鸡心瓶中。用10 mL乙腈-甲苯(3∶1, v/v)洗脱,收集流出液于同一鸡心瓶中,于40 ℃水浴中减压浓缩至约1 mL,用5 mL正己烷交换两次,于40 ℃水浴中减压浓缩至近干,用正己烷定容至2 mL,过0.22 μm有机滤膜,供气相色谱-串联质谱分析。
1.4 仪器条件
气相色谱条件:色谱柱为SH-RXi-5Sil MS(30 m×0.25 mm, 0.25 μm);进样口温度:250 ℃;升温程序:50 ℃保持1 min,以25 ℃/min的速度升至125 ℃,再以10 ℃/min的速度升至300 ℃,保持10 min;进样方式:不分流进样;柱流量:1.5 mL/min;载气:高纯氦气(纯度大于99.999%);进样量:1 μL。
质谱条件:电子轰击离子源(EI);离子源电压:70 eV;离子源温度:200 ℃;接口温度:250 ℃;溶剂延迟时间:4 min;碰撞气:氩气(纯度大于99.999%);扫描方式:多反应离子监测(MRM)模式。
2 结果与讨论
2.1 检测条件的优化
分别比较了气相色谱-质谱(GC-MS)与气相色谱-串联质谱(GC-MS/MS)两种检测方法用于检测茶叶中拟除虫菊酯类农药的灵敏度。首先用1 mg/L的混合标准使用液分别摸索GC-MS法和GC-MS/MS法的仪器条件,使9种农药能够得到较好的分离。GC-MS的扫描方式为选择离子监测模式(Q3-SIM), GC-MS/MS的扫描方式为MRM。优化仪器条件后,分别用两种方法测定相同浓度的茶叶基质匹配标准溶液(100 μg/L),重复进样6次。结果表明,GC-MS/MS法得到的9种拟除虫菊酯类农药的平均响应值要比GC-MS法的平均响应值高,且基线更平滑,信噪比更高,因此,本文选择采用GC-MS/MS法作为检测茶叶农药残留的方法。
采用GC-MS/MS法时,质谱条件的优化如下:将1 mg/L的9种拟除虫菊酯类农药混合标准使用液进行单极杆质谱全扫描(Q3-SCAN),通过谱库检索间接确定各组分农药的保留时间,同时获得每种农药的代表性母离子碎片,再通过Smart Database MRM优化工具确定各组分的碎片离子信息和碰撞能量,具体参数见表1。在优化的质谱条件下,9种拟除虫菊酯类农药的空白绿茶基质匹配标准溶液(1 mg/L)的总离子流色谱图见图1。


图 1 9种拟除虫菊酯类农药基质匹配标准溶液(1 mg/L)的总离子流色谱图
2.2 分散剂的使用
样品在填充入萃取池之前,可选择加入或不加入分散剂进行分散处理。目前关于分散剂对茶叶中农药残留提取的影响鲜有报道。本文考察了分散剂添加与否对拟除虫菊酯类农药提取的影响。称取两组空白茶叶样品,每组3个平行,9种拟除虫菊酯类农药的添加水平均为0.04 mg/kg,在相同萃取条件下,其中一组茶叶加入5 g常用分散剂硅藻土做分散处理,另一组不添加硅藻土,最后得到的回收率结果见图2。显然,样品添加硅藻土后,9种拟除虫菊酯类农药的回收率均有不同程度的提高。这可能是因为在快速溶剂萃取过程中,高温、高压可能会导致样品的积聚结块,从而使萃取效率降低,而添加分散剂后,样品积聚结块的现象得以有效抑制,从而获得更高的回收率。因此,本文选择使用分散剂硅藻土(添加量为5 g)。

图 2 添加硅藻土对9种拟除虫菊酯类农药回收率的影响
2.3 提取溶剂的选择
乙腈、乙酸乙酯、丙酮、正己烷等是农药残留检测中常用的、也是快速溶剂萃取允许使用的提取溶剂,本文分别比较了以上4种有机溶剂和丙酮-正己烷(1∶1, v/v)用于提取拟除虫菊酯类农药残留时的提取效果。结果发现,不同溶剂得到的萃取液颜色深浅不同,由深到浅分别是丙酮>丙酮-正己烷(1∶1, v/v)>乙酸乙酯>乙腈>正己烷,乙腈和正己烷提取液颜色相对较浅。这表明,在高温高压的萃取条件下,丙酮、丙酮-正己烷(1∶1, v/v)、乙酸乙酯均会提取到大量的茶叶色素等杂质。
为了确定最优的提取溶剂,本文使用以上5种溶剂进行空白基质加标回收试验,9种拟除虫菊酯类农药的添加水平均为0.04 mg/kg。评价方法参考文献[13]的评分方法,每种农药组分分别使用5种有机溶剂提取后,将得到的回收率与100%的绝对差值进行比较,并由小到大进行排序,依次评分为1、2、3、4、5分,最后进行分数总和,分数越低,回收率越接近100%,提取效果越好,具体结果见表2。由表可知,乙腈和丙酮-正己烷(1∶1, v/v)的得分较低,对9种拟除虫菊酯类农药的提取效果比其他3种溶剂要好。虽然乙腈得分比丙酮-正己烷(1∶1, v/v)更低,但试验中发现,用乙腈提取后,萃取液中出现了肉眼可见的絮状沉淀,可能是茶叶中的多酚类、蛋白质等在乙腈中形成的不溶物。孟祥龙等[14]用快速溶剂萃取法选择乙腈来提取粮谷中的多农药残留时,也出现了类似现象。这些絮状沉淀的出现无疑会增加后续净化步骤,且乙腈在浓缩换相时需要消耗更长的时间,故最终选择丙酮-正己烷(1∶1, v/v)为提取溶剂。

表 2 不同溶剂的提取效果评分(n=3)
The numbers in the brackets are average recoveries (%).

表 3 不同温度的提取效果评分(n=3)
The numbers in the brackets are average recoveries (%).
2.4 萃取条件的优化
快速溶剂萃取可变的参数主要有萃取温度、萃取压力、加热时间、萃取时间、冲洗体积、循环次数、氮气吹扫时间等。研究发现,加热时间、萃取时间在3 min以上时以及氮气吹扫时间在60 s以上时,农药残留的回收率变化不大,故本试验设置加热时间为3 min,萃取时间为5 min,氮气扫时间为100 s。而受限于收集瓶体积的缘故,设置循环次数为一次。综上所述,本文主要研究萃取温度、萃取压力、冲洗体积对提取效果的影响。
2.4.1萃取温度
加速溶剂萃取温度一般选择在40~120 ℃之间,在其他萃取条件相同的情况下,以萃取温度为变量,分别考察40、60、80、100和120 ℃ 5个温度水平对提取效果的影响,评价方法与2.3节相同,具体结果见表3。由表中数据可知,大多数农药的回收率随着萃取温度的升高而呈现先升高后降低的趋势,如联苯菊酯、甲氰菊酯、氯氟氰菊酯、氯菊酯的回收率在40~100 ℃范围内不断上升,在100 ℃时达到最高值,在120 ℃时开始下降;氟氯氰菊酯、氯氰菊酯、氟氰戊菊酯在40~60 ℃范围内不断上升,在60 ℃时达到最高值,从80 ℃时开始下降。这主要是因为,温度的升高不仅可以提高拟除虫菊酯类农药残留在萃取溶剂中的溶解度,还能够降低萃取溶剂的粘度和表面张力,这样就能使溶剂快速渗透到样品基质中,加大农药残留的扩散速率,从而使提取效果变好。然而,过高的温度可能会导致农药残留发生热降解或者其他不可逆的形态转化,从而使回收率出现下降现象。
由表3可知,40 ℃和120 ℃萃取条件下得到的总分最高,两者皆不是最佳萃取温度。60 ℃、80 ℃的得分接近,但均高于100 ℃。采用100 ℃萃取时得分最低,拟除虫菊酯类农药残留总体提取效果最好,故最终选择100 ℃为萃取温度。

表 4 不同压力的提取效果评分(n=3)
The numbers in the brackets are average recoveries (%).
2.4.2萃取压力
在快速溶剂萃取中,萃取压力的主要作用是保证萃取溶剂在高温下保持液态,一般设定压力范围为0~20 MPa。本文考察了0.5、5、10和15 MPa 4个压力水平对提取效果的影响,评价方法与2.3节相同,具体结果见表4。由表可知,随着萃取压力的升高,绝大部分拟除虫菊酯类农药残留的回收率也不断上升,并在15 MPa时达到最高值。这主要是因为,在高压条件下,萃取溶剂在高温时不仅能保持液态,同时能够快速地渗透到样品基质中,加快了农药残留目标物向萃取溶剂的转移,所以回收率会随着压力的上升而上升。但在实际萃取过程中,萃取压力并非越高越好,过高的压力不仅会影响仪器的稳定性和使用寿命,而且对农药残留提取帮助不大。从表4可以看出,当萃取压力为0.5 MPa时,总分最高,提取效果最差,当萃取压力为10 MPa时总分最低,提取效果最好,故最终选择萃取压力为10 MPa。
2.4.3冲洗体积
冲洗体积是指快速溶剂萃取结束后,使用干净萃取溶剂冲洗残渣的体积,一般以萃取池体积的百分比表示。可以预见,在其他萃取条件相同的情况下,冲洗体积越大,提取效果越好。然而,如果采用过高的冲洗体积,在一定程度上会造成萃取溶剂的浪费,同时也会延长后续浓缩净化的时间。本试验考察了20%、40%、60% 3个冲洗体积水平对拟除虫菊酯类农药的提取效果。结果表明,在其他萃取条件完全相同的情况下,上述3个冲洗体积水平得到的9种拟除虫菊酯类农药残留的回收率分别是58.39%~96.21%、61.40%~99.96%、62.77%~100.4%,采用40%冲洗体积与采用60%冲洗体积得到的回收率相差不大,故最终选择冲洗体积为40%萃取池体积。
2.5 净化条件的优化
2.5.1固相萃取柱的选择
茶叶中含有大量色素、多酚类、蜡质等需要净化的杂质成分,分别比较了相同柱容量(1 g/6 mL)的Cleanert Florisil、Cleanert PestiCarb以及Cleanert TPT固相萃取柱对茶叶农药残留的净化效果,发现用Cleanert Florisil、Cleanert PestiCarb固相萃取柱净化后得到的净化液颜色较深,浓缩后存在较多的残渣,无法完全去除目标杂质,主要是因为两者填充材料单一,对杂质的选择性较高,并不能同时净化上述茶叶中的几类杂质。Cleanert TPT柱由3种材料按一定比例分层填装而成,净化后得到的净化液澄清透明,残渣量小,故选择Cleanert TPT作为净化柱。同时,本文还考察了两种柱容量的Cleanert TPT柱对净化效果的影响,发现当称样量为5 g时,2 g/10 mL容量柱得到的净化液颜色接近无色,浓缩后几乎无残渣,净化效果比1 g/6 mL容量柱好,故最终选择2 g/10 mL柱容量的Cleanert TPT柱进行净化处理。
2.5.2洗脱体积的确定
为确定洗脱体积,提取浓缩后的转移液流出后先单独收集,记为0 mL,而后分4次加入洗脱液进行洗脱,每次5 mL,分别收集相应的洗脱液,经分析后绘制流出曲线图(见图3)。容易看出,洗脱体积为5 mL时,9种拟除虫菊酯类农药的回收率基本达到了80%以上,洗脱体积在10 mL以上时,回收率基本上保持持平,故最终确定洗脱体积为10 mL。
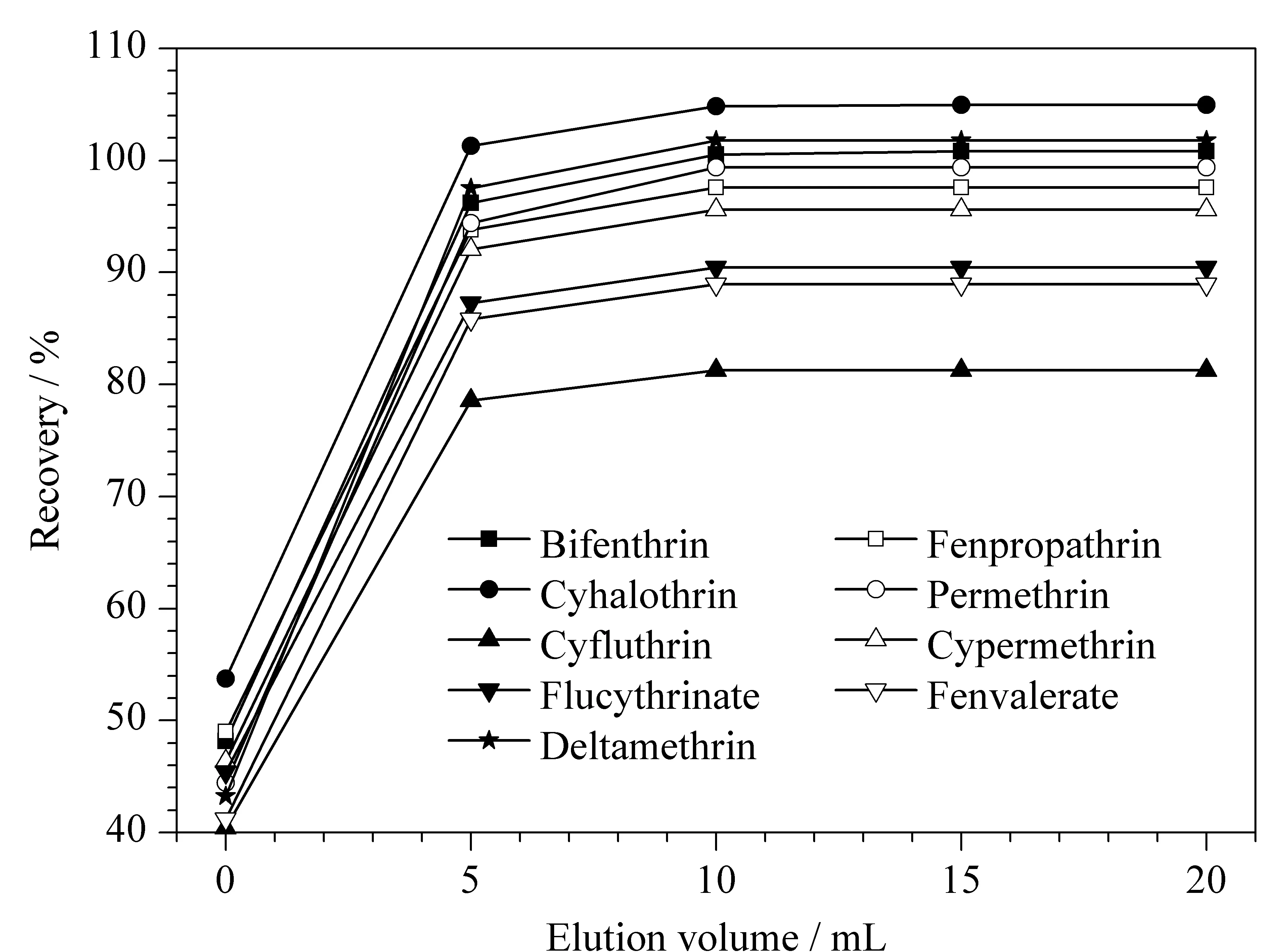
图 3 洗脱体积对9种拟除虫菊酯类农药回收率的影响
2.6 线性方程、检出限和定量限
预实验中发现,除了氟氯氰菊酯以外,其他8种拟除虫菊酯类农药均呈现出不同程度的基质增强效应。为消除背景干扰,本文采用空白基质液配制标准曲线。分别配制质量浓度为2、5、10、20、40、100、400、1 000 μg/L的空白绿茶基质匹配标准工作液进行测定,以定量离子峰面积y对质量浓度x(单位μg/L)做线性回归,得到各组分农药的线性方程和相关系数。采用加标回收的方法,以信噪比为3(S/N=3)确定检出限(LOD),以信噪比为10(S/N=10)确定定量限(LOQ),结果见表1。由表可知,在2~1 000 μg/L的浓度范围内,9种拟除虫菊酯类农药的线性相关系数均大于0.99,呈现出良好的线性关系。另外,9种拟除虫菊酯类农药的检出限为0.2~4.5 μg/kg,均低于国家方法标准[7];定量限为0.8~15.0 μg/kg,显示出较高的灵敏度。
2.7 回收率和精密度
在优化后的实验条件下,分别在绿茶、红茶空白样品中做加标回收试验,添加水平为低、中、高3个浓度(0.02、0.1和0.4 mg/kg)以及LOQ水平,每个浓度做6个平行样,得到的回收率和精密度数据见表5。在4个添加水平下,9种拟除虫菊酯类农药的平均回收率为69.87%~110.0%,相对标准偏差(RSD)为0.7%~11.2%,表明方法的准确度和精密度均能达到满意结果。
2.8 实际样品的测定
利用本文建立的方法对2018年送检的25份茶叶样品进行上述9种拟除虫菊酯类农药残留的测定,其中一份茶叶检出联苯菊酯,但未超过规定的限量值,其余茶叶样品均未检出任何农药组分。

表 5 绿茶、红茶中9种拟除虫菊酯类农药残留的加标回收率和相对标准偏差(n=6)
3 结论
本文利用加速溶剂萃取结合固相萃取净化的前处理技术,采用气相色谱-串联质谱进行测定,建立了茶叶中的9种拟除虫菊酯类农药残留的检测方法。通过优化检测条件和前处理过程,使用多反应监测模式和基质校准曲线,使本方法背景干扰低、分离能力强、灵敏度高、重现性好、回收率稳定,能够满足国内外对茶叶中多种拟除虫菊酯类农药残留的检测要求。
猜你喜欢
杂志排行
色谱的其它文章
- 获2017年度领跑者5000
--中国精品科技期刊顶尖学术论文入选证书的《色谱》论文名单 - Determination of airborne formaldehyde and ten other carbonyl pollutants using programmed temperature vaporization-large volume injection-gas chromatography
- 重组含糖识别结构域的人源半乳糖凝集素-3在糖蛋白/糖肽富集中的应用
- QuEChERS-液相色谱-串联质谱法测定蔬菜中105种农药残留
- 超高效液相色谱-串联质谱法测定热带水果中杀虫双残留
- 高效液相色谱-串联质谱法分析毛发中甲基苯丙胺和苯丙胺手性对映异构体
