柳蘑菌丝体高产多糖发酵条件优化及其多糖组分分析
2018-12-07,,,*,
,,,*,
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.广东广益科技实业有限公司,广东东莞 523220)
柳蘑(Pholiotaadiposa),又称多脂鳞伞、黄伞,属真菌门、担子菌纲、担子菌亚纲伞目[1],具有适应性强、原料易得、商品性状好等优点,被认为是一种具有良好市场前景的食用菌[2]。柳蘑富含碳水化合物、蛋白质、维生素及多种矿物质元素,其必需氨基酸占总氨基酸含量的43.9%,具有极高的营养价值[3]。
柳蘑多糖是从柳蘑子实体和菌丝体中提取的功能性成分,具有抗肿瘤[4]、抗氧化[5]、降血脂等生物活性。李德海等[6]研究表明,柳蘑子实体多糖可显著降低高脂血症小鼠的血清总胆固醇、甘油三酯和低密度脂蛋白胆固醇,具有降血脂、预防动脉硬化的功效。但由于柳蘑子实体栽培周期较长且产量较低,严重影响了柳蘑多糖的开发利用,因此还远不能够满足市场需求[7]。相对于子实体而言,菌丝体可以使用液体深层发酵实现,其周期短、产量大、适合规模化生产,并且能够增强柳蘑质量的稳定性[8]。Tian等[9]的研究发现,柳蘑菌丝体在优化后的培养基上菌丝粗壮、长势旺盛、生长速度较快,并且菌丝体深层发酵产物可以代替子实体作为商业上产品深度开发的原料[10]。国内外对柳蘑的研究多集中在其营养保健方面,并且已经达到较为成熟体系,Soo-Muk等[11]研究发现,柳蘑多糖提取物能够有效预防小鼠的高脂血症。目前对柳蘑菌丝体多糖高产的发酵条件研究较少,高效发酵生产柳蘑多糖能够为产品的开发及应用提供坚实的实验基础。
因此,本实验通过研究碳源、氮源、生长因子和发酵条件(温度、接种量、pH、发酵时间)对柳蘑菌丝体生长量和多糖产量的影响,从而确定柳蘑菌丝体高产多糖的最优发酵条件,同时采用气相色谱法对菌丝体多糖组分进行分析,为柳蘑多糖进一步合理开发和综合应用提供理论依据和可靠的技术支持。
1 材料与方法
1.1 材料与仪器
柳蘑菌种(Pholiotaadiposa) 由东北林业大学林学院森林保护实验室提供;D-木糖、D-甘露糖、L-鼠李糖、D-半乳糖、L-阿拉伯糖、D-果糖、D-葡萄糖单糖标准品 Sigma公司;SephadexG-100填料 北京鼎国昌盛生物技术有限责任公司;蛋白胨、可溶性淀粉、VC、VB2、VB6等 均为国产分析纯;种子培养液(玉米粉20%,葡萄糖3%,蛋白胨1%,磷酸二氢钾0.15%,硫酸镁0.1%,VB10.005%,加蒸馏水至1000 mL,主要用于扩大培养)、发酵基本培养基(可溶性淀粉20%,葡萄糖3%,蛋白胨1%,磷酸二氢钾0.15%,硫酸镁0.1%,VB20.005%,加蒸馏水至1000 mL,主要用于柳蘑液体发酵) 实验室自制。
Agilent 1100型气相色谱仪 美国Agilent公司;CHRIST 1-2型真空冷冻干燥机 德国Christ公司;722s型可见分光光度计 上海佑科仪器仪表有限公司;BHC-1300IIA2型超净工作台 苏州苏洁净化设备有限公司;JA2003型电子分析天平 上海展平仪器仪表有限公司;SephadexG-100型层析柱 上海沪西仪器厂。
1.2 实验方法
1.2.1 菌种活化 将保存于4 ℃冰箱中的菌种,取3块0.2 cm2菌块接种于100 mL种子培养液,26 ℃振荡(120 r/min)培养10 d。将培养好的菌种以10%的体积分数接入发酵基本培养基中,26 ℃振荡(120 r/min)培养10 d,备用。
1.2.2 培养基的优化试验
1.2.2.1 不同碳源及其添加量对菌丝体得率及多糖含量的影响 在发酵基本培养基中分别加入4种碳源(乳糖、葡萄糖、果糖、蔗糖)各3%,以取代基本培养基中的葡萄糖进行碳源筛选。
筛选出碳源后,按基本培养基:可溶性淀粉20%,蛋白胨1%,磷酸二氢钾0.15%,硫酸镁0.1%,VB20.005%,分别设置目标碳源的添加量为0.5%、1.0%、1.5%、2%、2.5%、3%,加蒸馏水至1000 mL,以10%的体积分数将活化菌种接入培养基中,26 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.2.2 不同氮源及其添加量对菌丝体得率及多糖含量的影响 在发酵基本培养基中分别加入4种氮源(硫酸铵、牛肉膏、酵母浸粉、蛋白胨)各1%,以取代基本培养基中的蛋白胨进行氮源筛选。
筛选出氮源后,按基本培养基:可溶性淀粉20%,葡萄糖2.5%,磷酸二氢钾0.15%,硫酸镁0.1%,VB20.005%,分别设置其目标氮源的添加量为0.5%、1.0%、1.5%、2.0%、2.5%、3%,加蒸馏水至1000 mL,以10%的体积分数将活化菌种接入培养基中,26 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.2.3 不同生长因子及其添加量对菌丝体得率及多糖含量的影响 在发酵基本培养基中分别加入4种生长因子(VC、VB2、VB6、肌醇)各1%,以取代基本培养基中的VB2进行生长因子筛选。
筛选出生长因子后,按基本培养基:可溶性淀粉20%,葡萄糖2.5%,蛋白胨1.5%,磷酸二氢钾0.15%,硫酸镁0.1%,VB20.005%,分别设置其中目标生长因子的添加量为0.003%、0.004%、0.005%、0.006%、0.007%、0.008%,加蒸馏水至1000 mL,以10%的体积分数将活化菌种接入培养基中,26 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.2.4 硫酸镁添加量对菌丝体得率及多糖含量的影响 按基本培养基:可溶性淀粉20%,葡萄糖2.5%,蛋白胨1.5%,磷酸二氢钾0.15%,VB20.006%,分别设置其中硫酸镁添加量为0.05%、0.1%、0.15%、0.2%、0.25%、0.3%,加蒸馏水至1000 mL,以10%的体积分数将活化菌种接入培养基中,26 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.2.5 正交试验 在单因素实验的基础上,确定碳源、氮源、生长因子、硫酸镁作为试验因素,每个因素3个水平,使用L9(34)正交表进行试验(见表1),共9个组合,每个组合设3个重复。
1.2.3 菌丝体得率 参照Ahmadi等[12]的方法,并稍作修改,计算菌丝体得率,见公式(1)。
式(1)
式中:P1为菌丝体得率(g/L),M为菌丝体产量(g),V为发酵培养基体积(L)。
1.2.4 菌丝体多糖含量的测定 柳蘑菌丝体经粉碎过60目筛,石油醚(1∶4,v/v)浸泡12 h脱脂,挥干溶剂。在料液比1∶20、提取时间2 h、提取温度90 ℃条件下,提取两次,合并提取液,在60 ℃旋转蒸发至原体积1/3,浓缩后冷却至室温,加入4倍体积的90%乙醇溶液静置过夜(4 ℃),于4000 r/min离心10 min,弃去上清液,沉淀物-40 ℃冷冻干燥得柳蘑粗多糖[13]。采用苯酚-硫酸法[14]测定柳蘑多糖含量,以葡萄糖为标准品,得标准曲线Y=0.017X-0.156(R2=0.999)。多糖含量计算公式如下(2)。
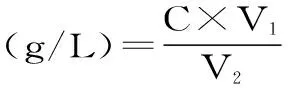
式(2)
式中:C为提取液中多糖浓度(g/mL),V1为提取液体积(mL),V2为发酵培养基体积(L)。
1.2.5 发酵条件的优化试验
1.2.5.1 培养温度对菌丝体得率及多糖含量的影响 按培养基,可溶性淀粉20%,葡萄糖2.5%,蛋白胨1.5%,磷酸二氢钾0.15%,VB10.006%,硫酸镁0.15%,加蒸馏水至1000 mL,以10%的体积分数将活化菌种接入培养基中23、24、25、26、27 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.5.2 接种量对菌丝体得率及多糖含量的影响 按培养基,可溶性淀粉20%,葡萄糖2.5%,蛋白胨1.5%,磷酸二氢钾0.15%,VB10.006%,硫酸镁0.15%,加蒸馏水至1000 mL,以5%、10%、15%、20%、25%的体积分数将活化菌种接入培养基中25 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.5.3 pH对菌丝体得率及多糖含量的影响 可溶性淀粉20%,葡萄糖2.5%,蛋白胨1.5%,磷酸二氢钾0.15%,VB10.006%,硫酸镁0.15%,加蒸馏水至1000 mL,pH分别为4.0、5.0、6.0、7.0、8.0,以15%的体积分数将活化菌种接入培养基中25 ℃振荡(120 r/min)培养10 d,分别测定其菌丝体得率及多糖含量。
1.2.5.4 发酵时间对菌丝体得率及多糖含量的影响 按培养基,可溶性淀粉20%,葡萄糖2.5%,蛋白胨1.5%,磷酸二氢钾0.15%,VB10.006%,硫酸镁0.15%,加蒸馏水至1000 mL,pH为5.0,以15%的体积分数将活化菌种接入培养基中25 ℃振荡(120 r/min)培养8、9、10、11、12、13 d,分别测定其菌丝体得率及多糖含量。
1.2.5.5 正交试验 在单因素实验的基础上,以培养温度、接种量、pH、发酵时间作为试验因素,每个因素3个水平,使用L9(34)正交表进行试验,共9个组合,每个组合设3个重复(见表1),确定发酵最佳条件。

表2 正交试验因素水平Table 2 Factors and levels used for orthogonal test
1.2.6 柳蘑菌丝体多糖的纯化 取2 g粗多糖溶于少量蒸馏水中,用Sevage法除蛋白[15],在5%过氧化氢、37 ℃条件下脱色3 h,经8000 Da透析后,用滴管将多糖溶液沿壁加入平衡好的Sephadex G-100色谱柱层析,用蒸馏水以流速1.0 mL/min,每管10 min自动收集糖峰洗脱液,得菌丝体多糖纯品,-40 ℃冻干后备用。
1.2.7 柳蘑菌丝体多糖组成分析 参照文献[16],称取纯化多糖约5 mg,置于安瓿瓶中,加入2 mol/L的三氟乙酸5 mL,酒精喷灯封口,在120 ℃条件下水解反应2 h。水解液在55 ℃旋转蒸发至干,加入2.5 mL的甲醇,再次蒸干,如此反复5次,蒸干后备用。
毛细色谱柱:DB-225(30 m×0.25 mm×0.25 μm)。色谱条件:载气为N2,压力为103 kPa,辅助气体:空气流量300 mL/min,助燃气体:氢气流量30 mL/min;进样方式:分流进样,分流比1/20;进样口温度:220 ℃;FID氢火焰检测器:温度280 ℃;程序升温:柱起始温度180 ℃,保持3 min,5 min内升温至220 ℃,保持20 min。测定柳蘑菌丝体多糖组分。
1.3 数据处理
每组3个平行,结果取平均值。数据结果以平均值±标准方差(means±SD)表示,数据处理,结果采用统计分析软件SPSS 21.0与Origin 9.0进行统计分析,以p<0.05为差异有统计学意义。
2 结果与分析
2.1 培养基配方优化结果
2.1.1 单因素实验
2.1.1.1 不同碳源及其浓度对菌丝体得率及多糖含量的影响 碳源是微生物生长的一类营养物质,有糖类、油脂和小分子醇等,为微生物生长代谢提供一定的物质基础,提供细胞及合成产物的碳架,释放生命活动所需要的能量[17]。不同碳源及其浓度对柳蘑液体培养的影响见图1~图2。

图1 不同碳源对柳蘑菌丝得率的影响Fig.1 Effect of carbon source on yield of Pholiota adiposa mycelia

图2 葡萄糖浓度对柳蘑菌丝体得率及多糖含量的影响Fig.2 Effect of glucose concentration on yieldand polysaccharide contents of Pholiota adiposa mycelia注:不同大写字母为菌丝体得率差异显著(p<0.05);不同小写字母为多糖含量差异显著(p<0.05);图4、图6~图11同。
由图1可知,碳源是柳蘑菌丝体生长的必需营养物质,葡萄糖、蔗糖、果糖和乳糖这4种碳源对柳蘑菌丝体的生长呈现不同的影响,其中乳糖作为碳源添加后,菌丝生长缓慢,菌丝体得率(2.33±0.09) g/L;而葡萄糖作为碳源添加后,菌丝生长迅速,相同生长时间内菌丝体得率高达(8.71±0.32) g/L,是添加乳糖柳蘑菌丝体得率的3.74倍,因此为获得柳蘑菌丝体高产多糖,可将葡萄糖作为最适碳源。
由图2可以看出,柳蘑菌丝体得率随着葡萄糖浓度的升高呈先升高后下降的趋势,当葡萄糖浓度为2.5%时,菌丝体得率最高,为(9.6±0.40) g/L,与葡萄糖浓度为2.0%时无显著性差异(p>0.05),但均显著高于其他浓度间菌丝体得率(p<0.05);葡萄糖浓度继续增加至3.0%时,菌丝体得率随之降低。多糖含量随葡萄糖浓度升高呈现先上升后下降的趋势,当葡萄糖浓度为2.5%时,多糖含量最高,达到(0.98±0.04) g/L,随后多糖含量缓慢下降。由此说明,太高或太低的碳源浓度均不利于微生物的生长、可能会抑制多糖的合成[18],因此选择浓度为2.5%的葡萄糖进行接下来的实验。
2.1.1.2 不同氮源及其浓度对菌丝体得率及多糖含量的影响 氮源可分为有机氮和无机氮,是构成生物体的蛋白质、核酸及其它化合物的材料,作为微生物细胞结构物质以及含氮次生代谢产物中的氮素提供营养物质。不同氮源及其含量对柳蘑液体培养的影响见图3~图4。

图3 不同氮源对柳蘑菌丝得率的影响Fig.3 Effect of nitrogen source on yieldand polysaccharide contents of Pholiota adiposa mycelia

图4 蛋白胨浓度对柳蘑菌丝体得率及多糖含量的影响Fig.4 Effects of peptone concentration on yield and polysaccharide contents of Pholiota adiposa mycelia
由图3可知,蛋白胨、酵母浸粉、牛肉膏和硫酸铵4种氮源均能使柳蘑菌丝体生长,但对柳蘑菌丝体的生长呈现明显差异,其中蛋白胨作为氮源添加后,菌丝生长速率较快,相同生长时间内菌丝体得率高达(8.85±0.31) g/L,牛肉膏次之,菌丝体得率最低的为硫酸铵,不适合作为氮源。由此说明,蛋白胨能提供适合柳蘑生长的氮元素,因而选择蛋白胨为最适氮源。
由图4可以看出,柳蘑菌丝体得率随着蛋白胨浓度的升高,呈现先升高后降低的趋势,当蛋白胨浓度为1.5%时,菌丝体得率最高,为(9.20±0.36) g/L,且与蛋白胨浓度为2.0%时无显著性差异(p>0.05),但均显著高于其他浓度下的菌丝体得率(p<0.05);多糖含量也随蛋白胨浓度升高,呈现先上升后下降再平稳的趋势,当蛋白胨浓度为1.5%时,多糖含量最高(0.95±0.033) g/L,但2.0%浓度下的多糖含量为无显著性差异(p>0.05),当蛋白胨浓度继续升高至2.5时,多糖含量迅速降低,继续增加蛋白胨浓度,多糖含量趋势趋于平缓。因此选1.5%作为最适氮源浓度,既可得到高产多糖又不影响菌体干重,该实验结果与贾瑞博等[19]研究结果一致。
2.1.1.3 不同生长因子及其浓度对菌丝体得率及多糖含量的影响 生长因子是微生物生长的必需物质,但由于某些微生物自身不能合成,必须由外界提供某些成分从而促进其生长,不同的生长因子对同一种物质的作用不尽相同。不同生长因子及其含量对柳蘑液体培养的影响见图5~图6。
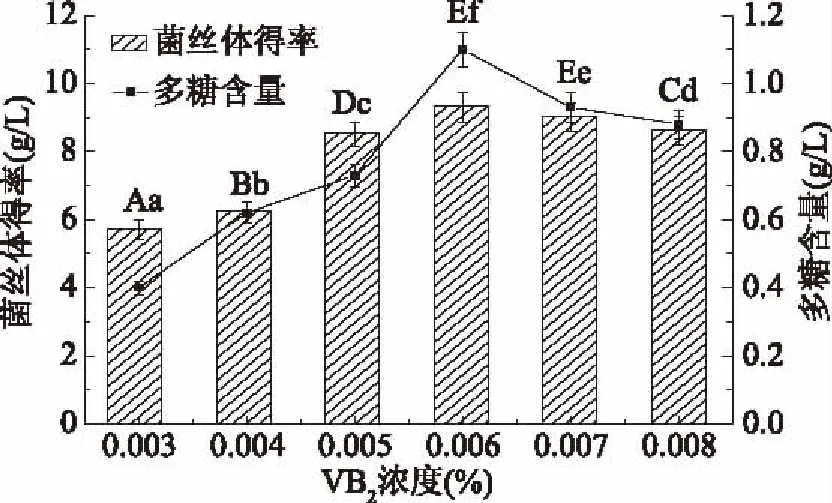
图6 VB2浓度对柳蘑菌丝体得率及多糖含量的影响Fig.6 Effects of VB2 concentration on yield and polysaccharide contents of Pholiota adiposa mycelia

图5 不同生长因子对柳蘑菌丝体得率的影响Fig.5 Effect of growth factor on yield of Pholiota adiposa mycelia
由图5可知,生长因子是柳蘑菌丝体生长的必需营养物质,4种生长因子对柳蘑菌丝体的生长呈现不同的影响,其中肌醇作为生长因子加入后,菌丝生长缓慢,菌丝体得率(6.53±0.22) g/L;而VB2作为生长因子添加后,相同生长时间菌丝生长迅速,菌丝体得率高达(8.52±0.41) g/L,是添加肌醇生长因子柳蘑菌丝体得率的1.31倍,VB2能够有效地促进菌丝体的生长[20]。因此,选择VB2为最适生长因子。
由图6可知,柳蘑菌丝体得率随着VB2浓度的升高,呈先升高后降低的趋势,当VB2浓度为0.006%时,菌丝体得率最高为(9.36±0.44) g/L,随后菌丝体得率略有下降,但下降幅度不大;多糖含量也随蛋白胨浓度升高而升高,当VB2浓度为0.006%时,多糖含量高达(1.1±0.047) g/L,且与其他浓度间菌丝体得率差异显著(p<0.05),浓度高于0.006%后,多糖含量降低。因此选0.006% VB2作为最适生长因子浓度既可得到高产多糖,又不影响菌体干重,对菌丝体生长有良好促进作用[21]。
2.1.1.4 不同浓度硫酸镁对菌丝体得率及多糖含量的影响 Mg2+是酶反应的辅助因子,与碳源的氧化相关,可激活多种酶的活性,可稳定细胞膜,并通过主动运输传递物质[22]。不同浓度硫酸镁液态发酵柳蘑菌丝体干重变化及多糖产量变化如图7所示。

图7 硫酸镁浓度对柳蘑菌丝体得率及多糖含量的影响Fig.7 Effects of MgSO4 concentration on yield and polysaccharide contents of Pholiota adiposa mycelia
由图7可知,柳蘑菌丝体得率随着硫酸镁浓度的升高,呈现先升高后降低的趋势,当硫酸镁浓度为0.15%时,菌丝体得率最高,略微高于0.1%浓度下菌丝体得率,随后菌丝体得率下降;多糖含量也随硫酸镁浓度升高而升高,当VB2浓度为0.15%时,多糖含量高达(0.91±0.026) g/L,且与其他浓度间菌丝体得率差异显著(p<0.05),浓度高于0.15%后,多糖含量出现大幅下降,过高或过低浓度均会抑制菌丝体的生长及多糖的合成,因此选0.15%硫酸镁作为最适无机盐浓度,与许谦的研究结果一致[23]。
2.1.2 正交试验 选用葡萄糖作为碳源,牛肉膏作为氮源,VB2作为生长因子,硫酸镁作为无机盐,进行L9(34)正交试验,试验设计及结果见表3。

表3 L9(34)正交试验结果Table 3 Result of the L9(34)orthogonal experiment
正交试验结果表明,各因素对菌丝得率影响的主次顺序为:A>B>C>D,即葡萄糖浓度>蛋白胨浓度>VB2浓度>硫酸镁浓度,菌丝得率最高的优水平组合是A3B1C3D2;各因素对多糖含量影响的主次顺序为:A>B>C>D,即葡萄糖浓度>蛋白胨浓度>VB2浓度>硫酸镁浓度,多糖含量最高的优水平组合是A3B1C3D1。综合本试验需得到高产柳蘑菌丝体多糖的目的考虑,因而选用A3B1C3D1,即葡萄糖2.5%,蛋白胨1%,VB20.006%,硫酸镁0.10%为菌丝体发酵的最优培养基配方,在此条件下,柳蘑菌丝体得率达(10.93±0.41) g/L,多糖含量达到(1.29±0.04) g/L。
2.2 发酵条件优化结果
2.2.1 单因素实验
2.2.1.1 温度对菌丝体得率及多糖含量的影响 温度是影响有机体生长繁殖最重要的因素之一,将接种培养基分别置于不同温度下恒温培养,研究发酵温度对柳蘑液体培养的影响,结果如图8所示。
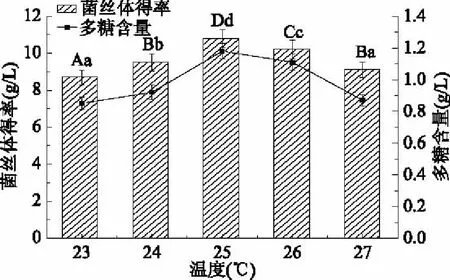
图8 温度对柳蘑菌丝体得率及多糖含量的影响Fig.8 Effects of temperature on yield and polysaccharide contents of Pholiota adiposa mycelia
由图8可知,柳蘑菌丝体得率随着温度的升高,呈现先升高后降低的趋势,当温度为25 ℃时,菌丝体得率最高为(10.8±0.50) g/L,略高于其他浓度菌丝体得率,随着温度的上升,反应速度加快,呼吸强度增加,细胞的生长繁殖加快[24],而温度继续升高,酶失活速率加快,导致菌丝体得率下降;多糖含量也随温度升高而升高,当温度为25 ℃时,多糖含量高达(1.18±0.05) g/L,温度高于25 ℃后,多糖含量出现大幅下降,因此25 ℃作为最适温度。
2.2.1.2 接种量对菌丝体得率及含量的影响 接种量对柳蘑液体培养的影响见图9。

图9 接种量对柳蘑菌丝体得率及多糖含量的影响Fig.9 Effects of inoculation volume on yield and polysaccharide contents of Pholiota adiposa mycelia
由图9可知,柳蘑菌丝体得率随着接种量的增加而增加,当接种量为15%时,菌丝体得率最高,随后菌丝体得率下降;多糖含量也随接种量的升高而升高,当接种量为15%时,多糖含量高达(1.06±0.05)g/L,且与其他接种量间菌丝体得率差异显著(p<0.05),接种量大于15%后,多糖含量出现大幅下降,接种量过小,菌丝生长缓慢,接种量过大,菌丝初期生长繁殖迅速,过早达到发酵终点,从而导致菌丝体含量较少,因此选择15%作为最适接种量,与甘聃的研究结果一致[25]。
2.2.1.3 初始pH对菌丝体得率及多糖含量的影响 初始pH对柳蘑液体培养的影响见图10。
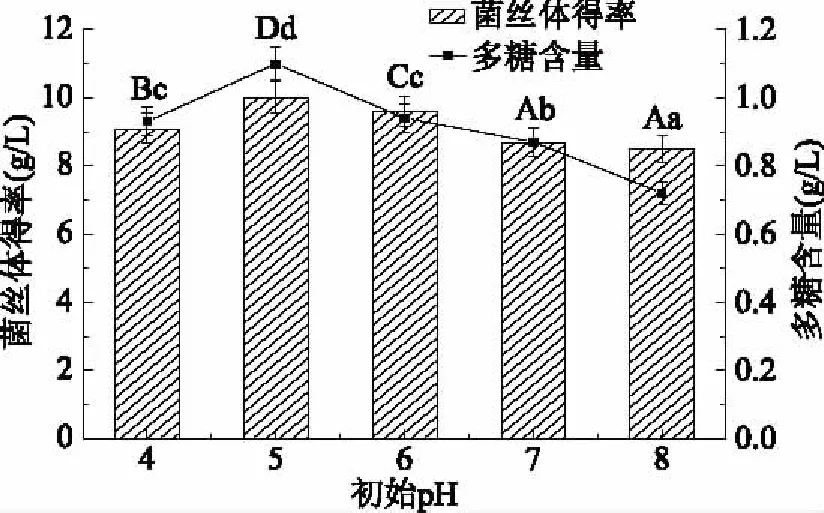
图10 初始pH对柳蘑菌丝体及多糖含量的影响Fig.10 Effects of initial pH on yield and polysaccharide contents of Pholiota adiposa mycelia
由图10可知,柳蘑菌丝体在偏酸性条件下生长较好。当初始pH为5时,菌丝体得率最大,多糖含量最高,并且pH为5时,多糖含量显著高于其他浓度(p<0.05)。由此可以看出,过高或过低的pH均不利于柳蘑菌丝体的生长及物质的合成,因此最适pH为5。
2.2.1.4 发酵时间对菌丝体得率及多糖含量的影响 发酵时间对柳蘑液体培养的影响见图11。

图11 发酵时间对柳蘑菌丝体及多糖含量的影响Fig.11 Effects of time on yield and polysaccharide contents of Pholiota adiposa mycelia
由图11可知,随着发酵时间的延长,菌丝干重不断增加,发酵时间为10 d时,菌丝体得率最高,发酵时间超过10 d,菌丝体得率降低。多糖含量也随发酵时间的延长而升高,当发酵时间为10 d时,多糖含量高达(1.27±0.05) g/L,显著高于其他浓度下多糖含量(p<0.05);发酵时间大于10 d时,因溶氧量降低,菌体老化自溶,导致菌丝干重及多糖含量均下降,因此最适发酵时间为10 d。
2.2.2 正交试验 选取温度、接种量、初始pH、发酵时间为因素,每个因素3个水平进行L9(34)正交试验,试验结果见表4。

表4 L9(34)正交试验结果Table 4 Results of the L9(34)orthogonal experiment
正交试验结果表明,各因素对菌丝得率影响的主次顺序为:D>A>C>B,即发酵时间>温度>pH>接种量,菌丝得率最高的优水平组合是A2B2C2D2;各因素对多糖含量影响的主次顺序为:D>A>C>B,即发酵时间>温度>pH>接种量;多糖含量最高的优水平组合是A2B2C2D2。在此条件下,柳蘑菌丝体得率达(10.94±0.27) g/L,多糖含量(1.20±0.015) g/L,但由于得到的最优验证结果低于正交表中A2B2C1D2中菌丝体得率和多糖含量,因而选用A2B2C1D2,即温度25 ℃,接种量15%,pH4,发酵时间10 d为菌丝体发酵的最优培养基配方。
2.3 柳蘑多糖组成分析
单糖标准品的气相色谱及单糖保留时间分别如图12所示,柳蘑菌丝体多糖水解后进行气相色谱测定,所得气相色谱图如图13所示。
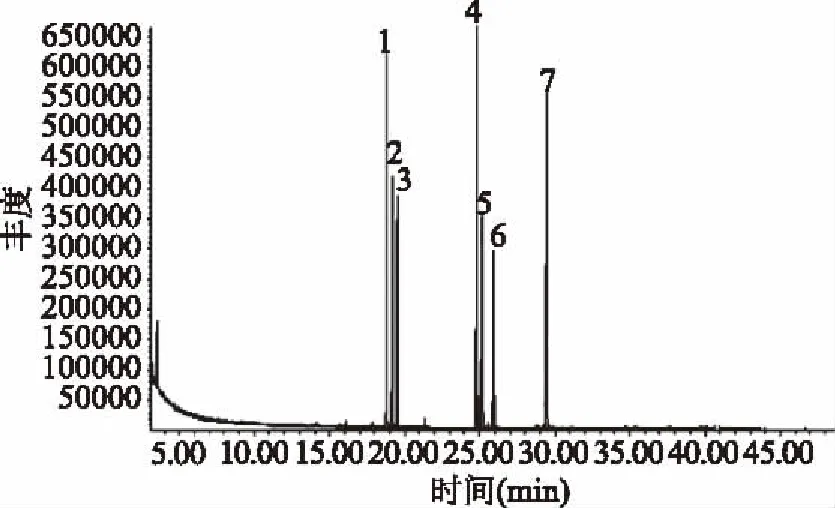
图12 标准单糖气相色谱图Fig.12 GC spectrum of monosaccharide reference注:1~7分别为L-鼠李糖、L-阿拉伯糖、D-木糖、D-甘露糖、葡萄糖、D-半乳糖和肌醇。

图13 柳蘑菌丝多糖的气相色谱图Fig.13 GC spectrum of Pholiota adipos mycelia polysaccharide
由图13可知,多糖水解液样品色谱图中第一个峰出峰时间为18.85 min,与标准品相比较,可判定为L-鼠李糖,第二个峰出峰时间为19.20 min,与标准品相比较可判定为L-阿拉伯糖,第三个峰出峰时间为25.95 min,与标准品相比较,可判定为D-半乳糖,由此说明柳蘑菌丝体多糖主要由L-鼠李糖、L-阿拉伯糖、D-半乳糖组成。
3 结论
通过实验得出结果,柳蘑菌丝体发酵最优培养基配方为葡萄糖2.5%,蛋白胨1%,VB20.006%,硫酸镁0.1%,最优发酵条件为温度25 ℃,接种量15%,pH4,发酵周期10 d,在此条件下,柳蘑菌丝得率为(11.50±0.29) g/L,多糖含量达到(1.330±0.035) g/L。其中各因素对菌丝体得率和多糖含量影响的主次顺序为:葡萄糖浓度>蛋白胨浓度>VB2浓度>硫酸镁浓度,发酵周期>温度>pH>接种量,推测这些物质影响柳蘑菌丝体的次级代谢及物质的合成。另外,通过气相色谱分析得知,柳蘑菌丝体多糖由L-鼠李糖、L-阿拉伯糖和D-半乳糖所组成。通过本实验对培养基配方的优化及培养条件的优化,可实现对柳蘑菌丝体的高产发酵,同时采用气相色谱法对菌丝体多糖组分进行分析,为进一步探究柳蘑菌丝体多糖的生理活性及作用机理提供理论和实验基础。
