离子色谱-积分脉冲安培法测定肉类产品中鹅肌肽、高肌肽及肌肽
2018-12-06朱作艺王君虹
朱作艺, 张 玉, 王君虹, 李 雪, 王 伟*, 杨 华, 朱 岩
(1. 浙江省农业科学院农产品质量标准研究所, 浙江 杭州 310021; 2. 农业农村部创意农业重点实验室,浙江 杭州 310021; 3. 浙江大学化学系, 浙江 杭州 310028)

图 1 肌肽、鹅肌肽及高肌肽的结构式
肌肽(carnosine)是β-丙氨酸和L-组氨酸经肽键缩合而成的二肽化合物,天然存在于脊椎动物骨骼肌和大脑等组织中。1900年俄国化学家古列维奇首次从牛肉提取物中分离出肌肽,后来被证实这是从天然原料中分离得到的第一个具有代表性的生物活性肽[1]。除肌肽外,在脊椎动物组织中同样存在许多肌肽类化合物(CRCs),也称组氨酸二肽类物质,包括鹅肌肽(anserine)和高肌肽(homocarnosine)等[2]。鹅肌肽是肌肽的甲基化衍生物,由β-丙氨酸和L-1-甲基组氨酸组成,为高度稳定的水溶性二肽。高肌肽同样为类组氨酸二肽,与肌肽、鹅肌肽具有相似的结构(见图1)和生物学功能[3],主要存在于脑脊液中。研究显示,这类组氨酸二肽物质具有显著的抗氧化、增强免疫力、抗衰老、降尿酸、缓冲生理pH、舒张血管、保护神经及调节酶活性等作用[4-10],是重要的功能因子,在食品、医药、化妆品等领域具有非常广泛的应用。肌肽类化合物在食品工业中常作为添加剂,可以增强食品的风味,使得肉制品味道鲜美,肉质细嫩,同时大大延长食品保质期[11];在医药领域可用以预防光敏性皮炎和治疗白内障等[12,13];在化妆品工业中具有促进细胞新陈代谢、延缓衰老和增白等功能[14]。因此,建立一种高效准确的同时测定肌肽类化合物的方法具有重要意义。
目前,测定肌肽类化合物的分析方法主要是高效液相色谱法(HPLC),采用NH2柱[15]或C18柱[16]进行分离,在波长210 nm下紫外检测,但大多方法仅局限于肌肽或鹅肌肽的测定。由于肌肽类化合物紫外吸收弱,一般检测灵敏度较低,同时肌肽类化合物疏水性较弱,一般采用C18柱进行分离需进行衍生[17,18]。Aristoy等[19]采用阳离子交换色谱-邻苯二甲醛柱后衍生化法测定了饲料及肌肉组织中肌肽和鹅肌肽的含量。黄颖等[20]采用毛细管电泳法同时测定了脑脊液中的肌肽、鹅肌肽和高肌肽,该方法虽然柱效高,分离快速,所需样品量少,但由于毛细管直径小,光路短,采用紫外检测时灵敏度较低,同时缓冲体系的pH值较难控制,易导致方法重现性不理想。Peiretti等[2]采用HPLC-MS测定不同动物肌肉中肌肽、鹅肌肽和高肌肽的含量;Macia等[21]采用UPLC-MS/MS测定了鸡汤中肌肽和鹅肌肽的含量,但以上两种方法所用仪器昂贵,一般实验室难以实现。
离子色谱(IC)-电化学检测作为一种高效分离检测技术,广泛应用于无机阴阳离子、糖类、醛醇类、氨基酸和含硫化合物等的检测。积分脉冲安培检测法(IPAD)是一种新形式的脉冲安培检测法,克服了直流安培和脉冲安培的不足,成为当今各行业检测的重要手段之一[22]。本文建立了一种离子色谱-积分脉冲安培直接检测肉类产品中鹅肌肽、高肌肽及肌肽含量的方法,与高效液相色谱法相比,该方法灵敏度高,且无需衍生化操作;与HPLC-MS等方法相比,该方法操作和维护成本低,结合简单的样品前处理过程,可应用于肉类产品中肌肽类化合物含量的准确测定。
1 实验部分
1.1 仪器与试剂
Dionex ICS-3000离子色谱仪(配有带在线脱气装置的四元梯度泵、电化学检测器(三电极系统:金电极为工作电极,pH-Ag/AgCl为参比电极,不锈钢为对电极)、柱温箱、Rheodyne六通阀(带25 μL定量环)、Chromeleon 6.80色谱工作站)、AminoPac PA10保护柱(50 mm×2 mm)、分离柱(250 mm×2 mm)、Dionex OnGuard II RP前处理小柱(1.0 mL)(美国Thermo Fisher公司); 0.22 μm尼龙滤膜过滤头(天津毫津科技有限公司);JP-080S超声波仪(深圳洁盟清洗设备有限公司); Eppendorf台式高速离心机(德国Eppendorf公司)。
肌肽(纯度98.0%)、鹅肌肽(纯度98.0%)购自上海源叶生物科技股份有限公司;高肌肽(纯度98.0%)购自杭州尚杰化工有限公司;17种氨基酸标准品(精氨酸、赖氨酸、丙氨酸、苏氨酸、甘氨酸、缬氨酸、丝氨酸、脯氨酸、异亮氨酸、亮氨酸、蛋氨酸、组氨酸、苯丙氨酸、谷氨酸、天冬氨酸、半胱氨酸和酪氨酸)购自美国Sigma公司;50%(质量分数)NaOH溶液购自赛默飞世尔科技(中国)有限公司;其他化学试剂均为分析纯,实验室用水均为18.2 MΩ5cm去离子水。
1.2 实验条件
1.2.1标准溶液及淋洗液的配制
分别称取一定量的鹅肌肽、高肌肽及肌肽标准品,置于50 mL容量瓶中,用去离子水定容,分别配制质量浓度为1 000 mg/L的鹅肌肽、高肌肽及肌肽标准储备液,于4 ℃冰箱中保存备用;用去离子水将标准储备液稀释成不同浓度的混合标准工作液。
100 mmol/L NaOH淋洗液:准确移取5.2 mL 50%(质量分数)NaOH溶液,置于1.0 L容量瓶中,加入去离子水定容至刻度,混匀,使用时施加氮气保护,防止淋洗液吸收空气中的CO2。
1.2.2样品前处理
将新鲜鸭、鹅胸肉切成约1 cm3立方体小块,采用高速组织捣碎机破碎匀浆3 min;准确称取2.0 g肉泥,加入一定量去离子水,于30 ℃下超声提取30 min,转移至50 mL容量瓶中并定容,然后以12 000 r/min离心15 min,取上清液,再稀释20倍。
依次用5 mL甲醇和10 mL去离子水活化OnGuard II RP前处理小柱,然后将稀释后的样品上清液依次经过0.22 μm尼龙滤膜和OnGuard II RP前处理小柱,弃去最先流出的3 mL样品流出液,收集随后的2 mL样品流出液,用于离子色谱测定。
1.2.3色谱条件
色谱柱为Thermo Scientific AminoPac PA10保护柱(50 mm×2 mm)和分离柱(250 mm×2 mm);柱温为30 ℃;采用100 mmol/L NaOH溶液等度淋洗;流速为0.2 mL/min;进样体积为25 μL;检测方式为积分脉冲安培检测。检测电位波形见表1。

表 1 积分脉冲安培检测的电位波形
2 结果与讨论
2.1 色谱条件的优化
从图1可以看出,鹅肌肽、高肌肽及肌肽均为组氨酸二肽类化合物,三者均具有相似的两性离子结构,在碱性介质中,以阴离子状态存在,因此可以采用高效阴离子交换色谱柱进行分离,且碱性条件满足积分脉冲安培检测的必需条件。为研究鹅肌肽、高肌肽及肌肽的保留行为,对一系列固定相和流动相进行选择和优化。由于两性离子化合物保留较弱,因此选用两种高交换容量的阴离子交换色谱柱(CarboPac MA1和AminoPac PA10)对化合物进行分离。实验结果表明,调节淋洗液浓度和流速,3种目标化合物依然无法在CarboPac MA1色谱柱上实现完全分离;而采用AminoPac PA10色谱柱时,3种目标化合物在保留时间和分离度方面均优于CarboPac MA1色谱柱。因此,本实验选用Amino-Pac PA10色谱柱分离鹅肌肽、高肌肽及肌肽。

图 2 采用不同(a)流速和(b)浓度的淋洗液时3种目标化合物的色谱图
方法考察了不同流速(0.15、0.20和0.25 mL/min)对3种目标化合物分离效果的影响(见图2a)。结果表明,当淋洗液NaOH的浓度固定为100 mmol/L时,随着流速的增加,3种目标化合物的保留时间相应减少。当流速为0.15 mL/min时,3种目标化合物在18 min内出峰,肌肽出现轻微拖尾现象;当流速为0.20 mL/min时,3种目标化合物在14 min内出峰,可实现完全分离;当流速为0.25 mL/min时,3种目标化合物在12 min内出峰,其中鹅肌肽保留时间接近死时间。综合以上实验结果,选择淋洗液流速0.20 mL/min为最佳优化条件。
另外,实验对不同浓度的NaOH淋洗液进行了考察(见图2b)。当采用80 mmol/L NaOH溶液淋洗时,3种目标化合物在16 min内全部出峰,但3种目标化合物均存在拖尾现象,尤其是鹅肌肽拖尾严重;当采用100 mmol/L NaOH溶液淋洗时,3种目标化合物在14 min内全部出峰,峰形对称;当NaOH淋洗液浓度提高至120 mmol/L时,3种目标化合物的保留时间变化不大,只有高肌肽和肌肽保留时间略有提前。综合以上实验结果,选择淋洗液100 mmol/L NaOH。
为验证最佳淋洗液条件下17种氨基酸对目标化合物是否存在干扰,配制17种氨基酸混合标准溶液,依次对其和目标化合物进行测定。从图3可以看出,在30 min内只有部分氨基酸出峰,其保留时间均不与3种目标化合物的保留时间接近,不对3种目标化合物产生干扰。

图 3 (a)氨基酸混合标准溶液和(b)3种目标化合物的色谱图
2.2 前处理条件的优化
根据文献[21]报道,肉类样品绞碎成肉泥再经后续处理,其肌肽类化合物的提取效率明显高于样品切丁处理,而绞碎后的肉泥样品采用搅拌、超声和高温蒸煮3种提取方式对肌肽类化合物的提取没有显著性差异,但高温蒸煮方式容易造成细胞内肌浆蛋白溶出,使样品提取液基质更为复杂。因此,本文以去离子水为提取溶剂,采用超声方式对肉泥样品中的肌肽类化合物进行提取,提取温度为30 ℃。同时分别考察了不同提取时间(10、20、30、40、50和60 min)对鸭胸肉泥样品中3种目标化合物提取效率的影响(n=2)。从图4可以看出,在10~30 min内,随着提取时间的增加,3种目标化合物的提取效率均有上升趋势,当提取时间为30 min时,3种目标化合物的提取效率达到最高;当提取时间大于30 min,3种目标化合物的含量基本保持不变。因此,本实验选择最优提取时间为30 min。
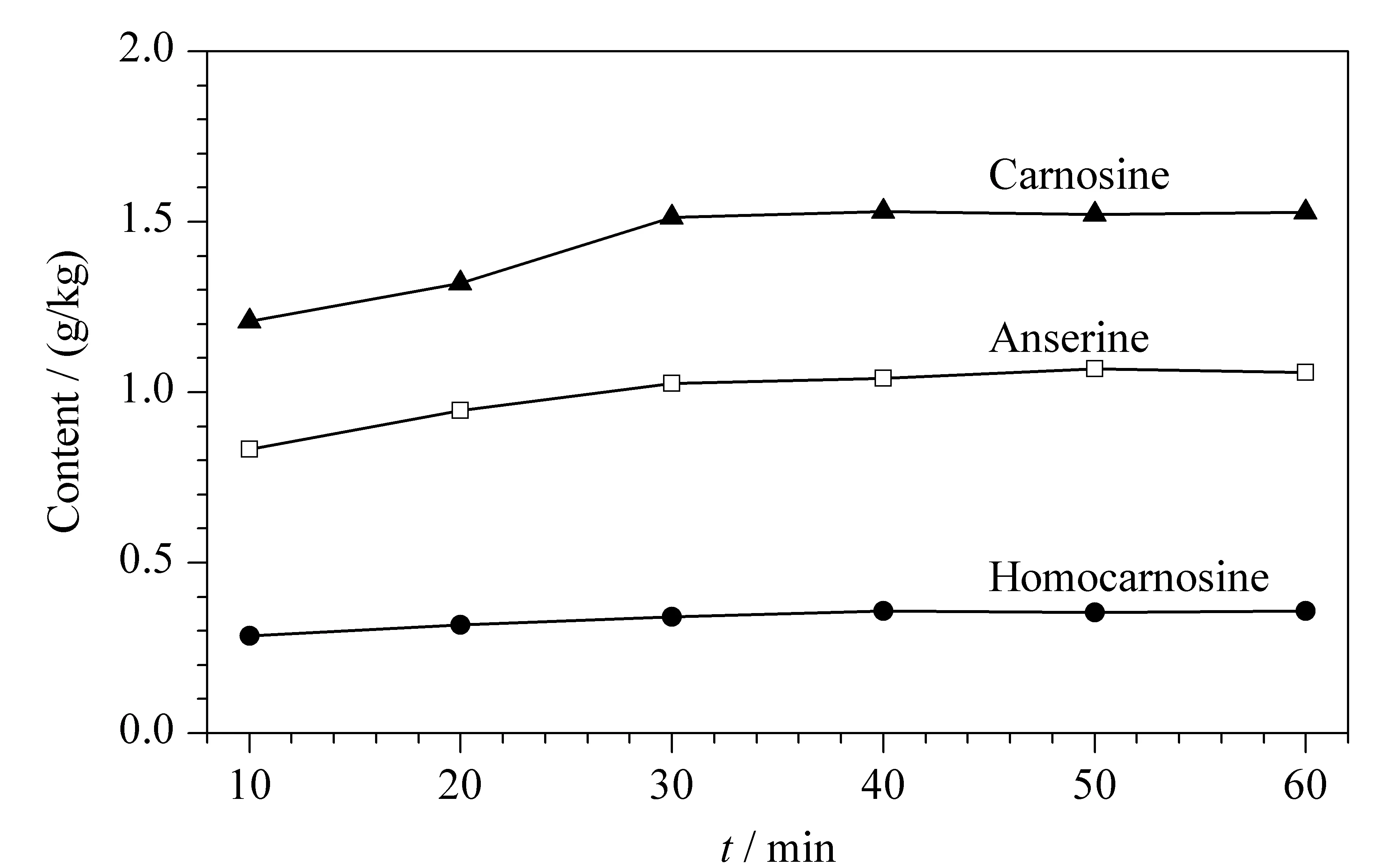
图 4 提取时间对肉类样品中3种目标化合物提取效率的影响
2.3 方法学考察
采用优化后的色谱条件,分别对6个浓度梯度的鹅肌肽、高肌肽及肌肽混合标准工作液进行测定,以相应的色谱峰面积(y)对其质量浓度(x, mg/L)进行线性回归。3种目标化合物在0.05~5.0 mg/L范围内线性关系良好,线性相关系数(r)均大于0.999 2。将质量浓度为1.0 mg/L的混合标准工作液按优化后的色谱条件进行分析,连续进样6次,其保留时间、色谱峰高和色谱峰面积的相对标准偏差(RSD)分别为0.28%~0.33%、0.52%~1.97%和0.66%~1.81%,表明该方法具有较好的重复性。根据信噪比(S/N)为3和10时的结果计算3种目标化合物的检出限(LOD)和定量限(LOQ),分别为8.9~22.1 μg/L和29.6~73.6 μg/L(见表2)。根据文献[15-17]报道,采用常规的高效液相色谱-紫外检测法测定肌肽类化合物,其检出限为160~1 600 μg/L。与常用的液相色谱法相比,本方法在灵敏度方面具有一定优势。
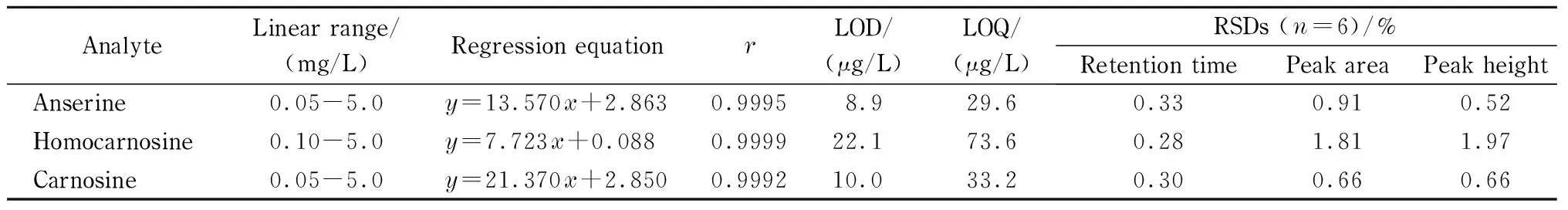
表 2 3种目标化合物的线性范围、回归方程、相关系数、检出限、定量限和相对标准偏差
y: peak area;x: mass concentration, mg/L.
2.4 实际样品检测
根据1.2.2节样品前处理方法和1.2.3节色谱条件,分别对鸭胸肉(见图5a)和鹅胸肉(见图5b)样品进行测定,通过外标法定量。由图5可以看出,鸭胸肉和鹅胸肉样品中均存在鹅肌肽、高肌肽和肌肽。

图 5 (a)鸭胸肉和(b)鹅胸肉样品中3种目标化合物的色谱图
为考察方法的准确性,分别在样品中加入3种目标化合物的混合标准工作液,加标样品经提取、净化后,平行测定3次。
结果表明,3种目标化合物的加标回收率为92.4%~104.5%, 相对标准偏差为0.6%~2.4%(见表3)。
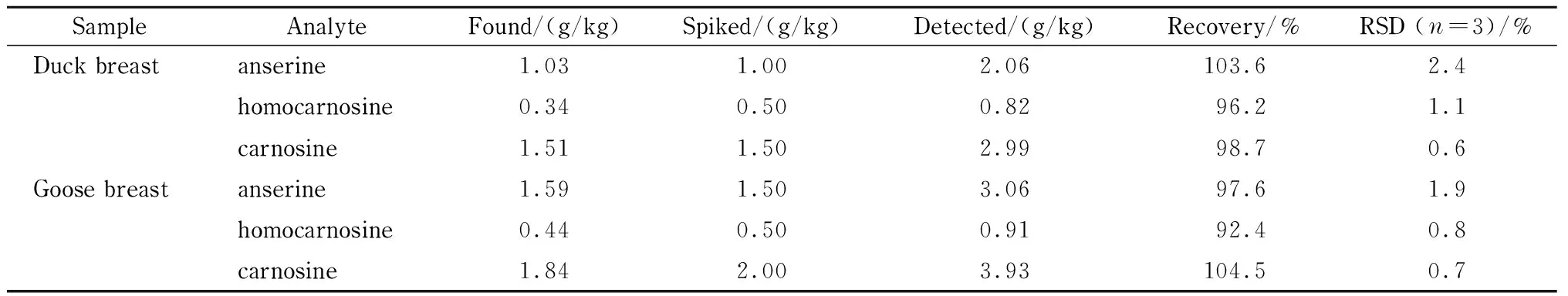
表 3 实际样品的加标回收率和相对标准偏差
3 结论
本文建立了一种简单快速的离子色谱-积分脉冲安培同时测定肉类样品中鹅肌肽、高肌肽及肌肽的分析方法。通过线性、选择性、灵敏度、精密度以及准确度等一系列方法学验证,表明该方法简单高效,线性范围宽,具有较好的重复性和准确度,适用于肉类产品中肌肽、鹅肌肽及高肌肽的测定,为肉类产品品质营养评价提供了一种新型、简便、高效的分析方法。
