基于液相色谱-串联质谱法的肉类特征肽段鉴别及掺假测定
2018-12-06古淑青詹丽娜赵超敏蔡一村邓晓军
古淑青, 詹丽娜, 赵超敏, 郑 江, 蔡一村, 邓晓军*
(1. 上海出入境检验检疫局动植物与食品检验检疫技术中心, 上海 200135; 2. 上海大学生命科学学院食品工程系, 上海 200436)
近年来,随着肉类价格差异不断扩大,不法商家为了追求利益,以次充好、掺杂掺假的现象层出不穷。羊肉作为一种温补食品,深受消费者喜爱。但由于其价格较高,且羊肉串、羊肉卷、羊肉干等加工制品种类较多,不法分子常用价格较为低廉的猪肉、鸡肉或鸭肉来伪造羊肉制品。这不仅侵害了消费者的权益,还涉及宗教信仰问题,容易引发社会的不安定因素。因此,建立准确、可靠、灵敏的羊肉中外源肉的掺假鉴别方法具有重要意义。
目前,肉类的掺假鉴别方法主要有酶联免疫吸附(ELISA)技术、聚合酶链式反应(PCR)技术和新近兴起的质谱确证技术[1,2]。其中,ELISA和PCR是常规检测方法,发展较为成熟。但是ELISA方法一次只能检测一个目标物,效率较低,并且在鉴别相近物种的肉类时,对于结构相似的蛋白质容易出现交叉反应;PCR技术可实现多目标物同时检测,但其检测物DNA在高度加工或者频繁处理的肉类样品中容易降解。质谱技术主要检测蛋白质和/或多肽,稳定性强,灵敏度高,可以实现多物种的同时测定,并且能够对物种的特征蛋白质和多肽进行明确鉴定[3]。
早期基于质谱的肉类鉴别工作主要利用凝胶电泳进行蛋白质分离,用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)进行蛋白质鉴定[4,5],该方法操作繁琐费时,不利于高通量分析。随着靶向蛋白质组学的发展,基于串联质谱技术的物种特异肽段检测已逐渐成为肉类掺假鉴别的主要方法。Kim等[6]采用质谱技术实现了生牛肉、猪肉和家禽肉的鉴别和不同物种间特征肽段的选择。周广运等[7]采用高分辨质谱结合数据库分析鉴定了猪肉中8种潜在的特征肽段。Marbaix等[8]实现了加工肉制品中牛肉、猪肉和羊肉特征肽段的确证。Sarah等[9]利用液相色谱-四极杆飞行时间质谱(LC-QTOF-MS)鉴别出了猪肉、牛肉、山羊肉和鸡肉的潜在特征肽段。但同时确定羊肉、鸭肉、鸡肉和猪肉4种肉类的生物标志性特征肽段并对羊肉中鸭肉、鸡肉和猪肉掺假的定量研究还未见报道。
本文采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UPLC-Q/Exactive-HRMS)和超高效液相色谱-三重四极杆质谱(UPLC-QqQ-MS)相结合,筛选出羊肉、鸭肉、猪肉、鸡肉4种肉类的20个特征肽段,并且建立了以特征肽段为分析对象的羊肉掺假鉴别和定量测定方法,为肉类掺假检测提供了有力的技术支持。
1 实验部分
1.1 仪器、试剂与材料
Dionex UltiMate 3000超高效液相色谱-四极杆-静电场轨道阱高分辨质谱联用仪(Q-Exactive,美国Thermo Fisher公司); Nexera X2液相色谱(日本Shimadzu公司), QTrap 6500三重四极杆-线性离子阱复合质谱系统(美国AB Sciex公司);离心机(美国Beckman Coulter公司);水浴锅(德国Julabo公司);高速振荡机(日本Eyela公司);氮吹仪(美国Jnc公司)。所有实验用水由Milli-Q超纯水系统(美国Millipore公司)制得。
碳酸氢铵(纯度≥99.5%)、尿素(纯度≥99.0%)、硫脲(纯度≥99.0%)、二硫苏糖醇(DDT,纯度≥99.5%)、碘代乙酰胺(IAA,纯度≥99.0%)、二水氯化钙(纯度≥99.0%)(美国Sigma公司);牛胰蛋白酶(sequencing grade,美国Promega公司); Tris-HCl缓冲液、Bradford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司); RapiGest SF Surfactant和Oasis HLB固相萃取小柱(1 mL/30 mg, 30 μm)(美国Waters公司); SPE固相萃取柱(Strata-X 33u,德国Phenomenex公司);甲酸(色谱纯,美国Fluka公司);乙腈(色谱纯,美国Thermo Fisher公司);超滤离心管(1.5 mL)和正己烷(色谱纯)(中国Anpel公司);丙酮(色谱纯,德国CNW公司);低蛋白吸附离心管(1.5 mL,德国Eppendorf公司);低蛋白吸附移液器吸头(0.1 mL/1.0 mL,德国Brand公司)。鸡肉、鸭肉、猪肉、牛肉和羊肉样品均为市售。
1.2 实验条件
1.2.1蛋白质提取
取1 g绞碎后的肉类样品(去除可见的脂肪组织和结缔组织,无特殊部位要求)于50 mL离心管中,加5 mL正己烷,超声3 min,涡旋震荡5 min,以4 500 r/min的速度离心3 min,去除上清液。以上步骤重复两次后,用氮气吹干样品。加入10 mL提取液(尿素6 mol/L,硫脲2 mol/L, Tris-HCl 50 mmol/L, pH=8.0±0.2),振荡5 min,将肉中的结缔组织打散。以4 500 r/min的速度离心3 min后取上清,再以12 000 r/min的速度于4 ℃离心5 min。采用Bradford试剂盒测定上清液蛋白质浓度。
1.2.2蛋白质酶解
蛋白质酶解步骤与文献报道相似[10,11]。取100 μL上清,用水稀释至1 mL后,取200 μL(蛋白质含量约300 μg)放入1.5 mL离心管中,加入终浓度为0.1%(质量分数)的RapiGest SF Surfactant,混匀。随后加入150 μL 500 mmol/L碳酸氢铵,混匀后加入10 μL 500 mmol/L DDT溶液,于75 ℃下恒温反应30 min。冷却至室温后加入30 μL 500 mmol/L的IAA溶液,暗处静置30 min。随后加入10 μL 100 mmol/L氯化钙溶液和50 μL 500 mg/L牛胰蛋白酶溶液,混匀后置于37 ℃恒温水浴中酶解2 h。加入20 μL甲酸终止反应,室温放置15 min,加水定容至1 mL。
1.2.3肽段纯化
首先采用1 mL甲醇、1 mL 1%(体积分数,下同)甲酸-水溶液进行活化及平衡Oasis HLB小柱,然后加入1 mL酶解后的样品,分别采用含5%甲醇和1%甲酸的水溶液进行清洗,最后采用1 mL 1%甲酸-乙腈溶液分两次进行洗脱。洗脱后的溶液用氮气吹干,用500 μL含0.1%甲酸的乙腈-水(3∶97, v/v)溶液溶解后用质谱检测。
1.2.4UPLC-Q/Orbitrap-HRMS条件
色谱条件:采用Kinetex XB-C18反相色谱柱(100 mm×2.1 mm, 1.7 μm,美国Phenomenex),流动相A为0.1%(体积分数)甲酸-水溶液,流动相B为0.1%(体积分数)甲酸-乙腈溶液。液相梯度洗脱程序:0~4 min, 97%A; 4~19 min, 97%A~30%A; 19~20 min, 30%A~10%A; 20~24 min, 10%A; 24~25 min, 10%A~97%A; 25~30 min, 97%A。流速:0.2 mL/min;进样体积:10 μL;柱温:35 ℃。
质谱条件:电喷雾电离(ESI)源,采用正离子模式;保护气压力:206.85 kPa;辅助气压力:68.95 kPa;喷嘴电压:3.5 kV;毛细管温度:320 ℃;辅助气温度:250 ℃;全扫描模式;扫描范围:m/z300~2 000;分辨率:35 000。
1.2.5UPLC-QqQ-MS条件
色谱条件:采用上述相同色谱柱,流动相A为0.1%(体积分数)甲酸-水溶液,流动相B为0.1%(体积分数)甲酸-乙腈溶液。液相梯度洗脱程序:0~3 min, 97%A; 3~10 min, 97%A~70%A; 10~13 min, 70%A~20%A; 13~16 min, 20%A; 16~20 min, 97%A。流速:0.2 mL/min;进样体积:5 μL;柱温:35 ℃。
质谱条件:ESI源,采用正离子模式;气帘气压力:241 kPa;喷嘴电压:5.5 kV;毛细管温度:500 ℃;离子源气体1:379 kPa;离子源气体2:345 kPa;碰撞气压力:medium。
2 结果与讨论
2.1 样品前处理优化
2.1.1酶解条件优化
常规的酶解反应往往需要12 h以上,工作效率低,且易引发副反应[12]。RapiGest SF Surfactant是一种表面活性剂,可使蛋白质变性,低浓度时对胰蛋白酶活性无抑制,且不会对蛋白质造成副反应化学修饰[13,14]。本试验考察了RapiGest SF Surfactant在提高肉类蛋白质酶解效率中的作用。样品中加入终浓度为0.1%(质量分数)的RapiGest SF Surfactant,分别酶解0.5、1、2、3.5、5 h和过夜(约18 h),经质谱检测,记录特征肽段提取离子流色谱图峰面积。结果表明,羊肉的酶解时间为2 h时,各肽段的检测浓度即可达到最高值。与通常需过夜反应相比,使用RapiGest SF Surfactant大大缩短了酶解时间,提高了实验效率,并且操作简单,酶解后只需酸化即可促使其分解,适用于质谱分析。
2.1.2固相萃取条件优化
为提高检测灵敏度并增强系统稳定性,需要在质谱检测前除去样品中多余的酶解试剂、盐类及其他成分。本试验在相同条件下比较了两种固相萃取小柱Strata-X SPE[15,16]和Oasis HLB[17]的除杂效果。依次用1 mL甲醇、1 mL 1%(体积分数,下同)甲酸-水溶液活化及平衡小柱,加入酶解后的样品,优化淋洗和洗脱条件,收集洗脱液,用质谱检测各特征肽段的峰面积。分别考察了甲醇体积分数为0、2.5%、5%、10%、20%、40%和60%的1%甲酸-水溶液的淋洗效果,最终选择含5%甲醇的1%甲酸-水溶液为淋洗液。采用1%甲酸-乙腈溶液进行洗脱,每1 mL洗脱液收集1次,并测定回收率,绘制洗脱曲线,结果表明,采用1 mL 1%甲酸-乙腈溶液分两次洗脱效果最佳。洗脱后的溶液用氮气吹干,用500 μL含0.1%甲酸的乙腈-水(3∶97, v/v)溶液溶解后进质谱检测。结果如表1所示,选用Oasis HLB小柱可以获得更佳的回收率和精密度(RSD),因此选择Oasis HLB小柱纯化酶解后的多肽样品。

表 1 固相萃取纯化后4种肉类的回收率和相对标准偏差(n=3)

图 1 羊肉、鸭肉、猪肉、鸡肉(从上至下)的肌红蛋白氨基酸序列图
2.2 特征肽段的选择
同小分子物质的检测类似,在蛋白质检测领域,MRM方法也被公认为是灵敏度最高的检测方法,在食品靶向蛋白质组学中得到广泛应用。而建立靶向蛋白质组学的第一步也是最重要的一步就是确定合适的特征肽段[10]。特征肽段指某一个蛋白质所特有的能够将其与其他蛋白质特异性区分的肽段序列。特征肽段的选择应遵循以下原则[11]:为一段高保守的氨基酸序列,不易发生修饰影响定量;易被质谱系统检测,且具有响应较强的碎片离子;非常稳定,不含易脱氨的Asp-Gly、易环化的N端Gln等;不会发生错切或漏切,酶解具有较高的重现性;8~25个氨基酸长度的肽为优先选择。
在本工作中,特征肽段的选择主要分为5步:1.利用UPLC-Q/Exactive-HRMS高分辨质谱平台对酶解后的样品进行Full MS/dd-MS2(Data-dependent MS2)扫描,得到包含一级质谱(MS)和串联质谱(MS/MS)的数据。2.利用ProteinPilot(Version 5.0, AB SCIEX)蛋白质搜索软件结合uniprot数据库,对采集的数据进行蛋白质鉴定,包括氨基酸序列的覆盖率(与数据库匹配的氨基酸占总氨基酸的比例)和肽段碎片的匹配度验证,并且将满足上述选择原则的肽段标记为备选特征肽段。3.将备选特征肽段通过BLAST(http://www.uniprot.org/blast/)搜索[18,19],验证其种属的特异性,去掉非特异性肽段,保留特征肽段。4.将选择的特征肽段同时导入Skyline软件(Version 5.0),利用该软件在UPLC-QqQ-MS平台上建立MRM方法,自动优化离子对、碰撞能量和去簇电压信息。5.选择经过不同加工的肉制品样品验证所选的特征肽段,确保特征肽段的稳定性和重现性。
Q-Exactive的Full MS/dd-MS2扫描模式主要包括两个连续和依赖性的扫描事件:一级质谱MS全扫描和响应超过一定阈值的前体离子的二级质谱MS2扫描。使用时设置一级MS分辨率为70 000,二级MS2分辨率为17 500,归一化碰撞能(NCE)为27%。Proteinpilot的参数设置如下:碘乙酸作为半胱氨酸修饰剂,胰蛋白酶作为消化酶,“生物修饰”作为“识别重点”,置信度为95%,错误发现率(FDR,指示确定性的确定性度量)设置为0.01。
由于肉类肌红蛋白(myoglobin)的氨基酸序列具有种类特异性差异,常用于物种鉴别[2,3]。因此,试验中以肌红蛋白为例,证明本方法蛋白质和多肽鉴定的准确性和可靠性。4种肉类的肌红蛋白鉴定结果如图1所示,从上至下分别为羊肉、鸭肉、猪肉、鸡肉的肌红蛋白氨基酸序列,其中彩色部分代表质谱鉴定出来的能够跟数据库中序列匹配的部分,黑色代表未能明确鉴定的部分。在此条件下,获得羊肉、鸭肉、猪肉和鸡肉肌红蛋白的氨基酸覆盖率分别为77.3%、72.1%、71.4%和72.7%。
多肽碎片离子的二级质谱鉴定主要考察备选的特征肽段碎片离子检测结果与理论推测的吻和性,这是数据库搜索打分的重要指标,同时还可以确定该肽段是否存在氨基酸修饰、分子内反应等。多肽在电喷雾电离中,主要产生N端碎片离子(b离子)和C端碎片离子(y离子)。以鸭肉肌红蛋白的特征肽段HGVTVLTQLGK(m/z576.8)为例,如图2所示,图中红色和绿色谱线分别代表理论b离子和y离子的碎片峰,蓝色谱线代表实验获得的离子碎片峰,可以看出实验获得的谱图和预测的碎裂模式之间有良好的对应关系,20个b、y碎片离子均得到鉴定,实验结果与理论预测的碎裂模式高度匹配并显示了很高的置信度,证明该肽段可用于MRM进一步分析。
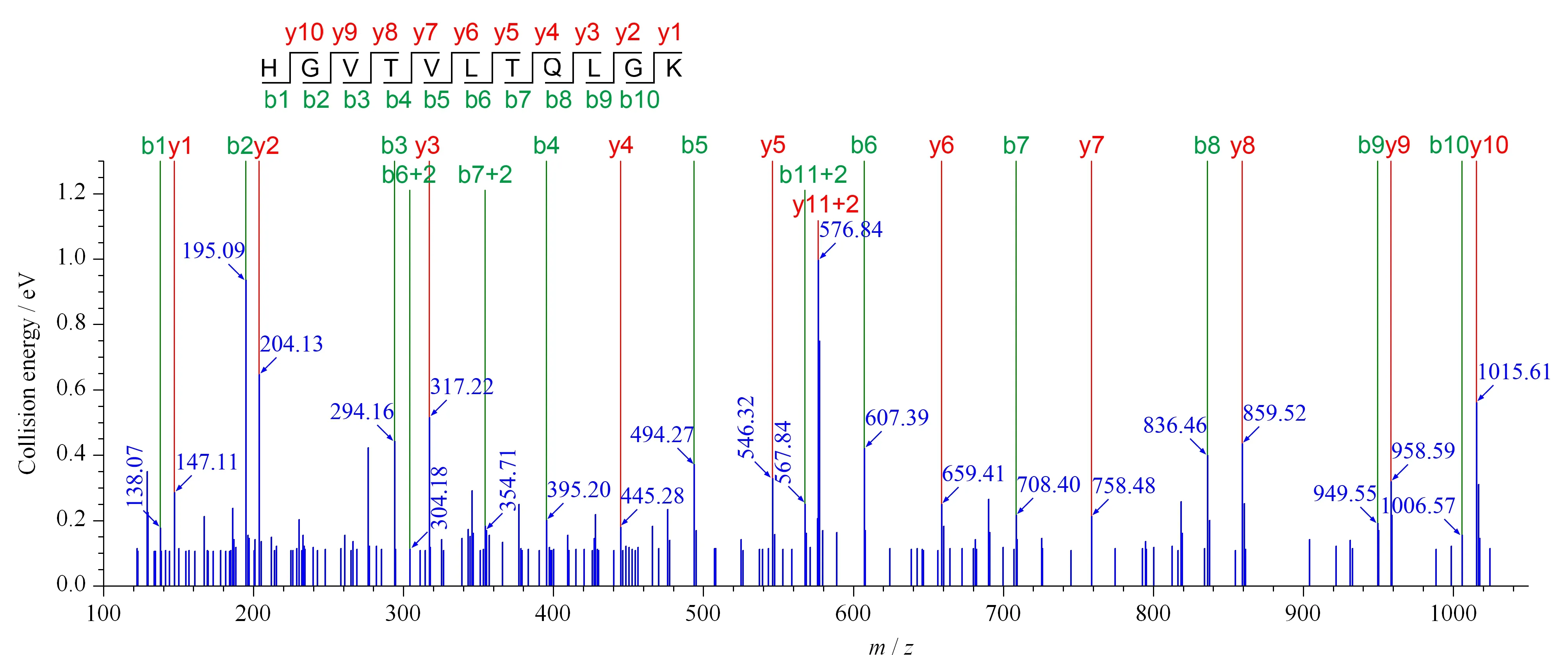
图 2 鸭肉特征肽段HGVTVLTQLGK(m/z 564.8)的碎片离子排布实验结果与理论对比图
利用本方法筛选出羊肉的3个特征肽段,分别属于肌红蛋白和血红蛋白β亚型;鸭肉的7个特征肽段,分别属于肌红蛋白、血红蛋白α亚型-D和载脂蛋白A-I;猪肉的6个特征肽段,分别属于肌红蛋白、3-磷酸甘油醛脱氢酶、肌球蛋白和碳酸酐酶-3;鸡肉的4个特征肽段,分别属于肌红蛋白、肌球蛋白轻链-3和β-烯醇酶(见表2)。针对筛选出的特征肽段,在UPLC-QqQ-MS平台上建立MRM方法,针对每个特征肽段,选择3个干扰最少、响应最高的子离子用于后续的定性和定量检测。
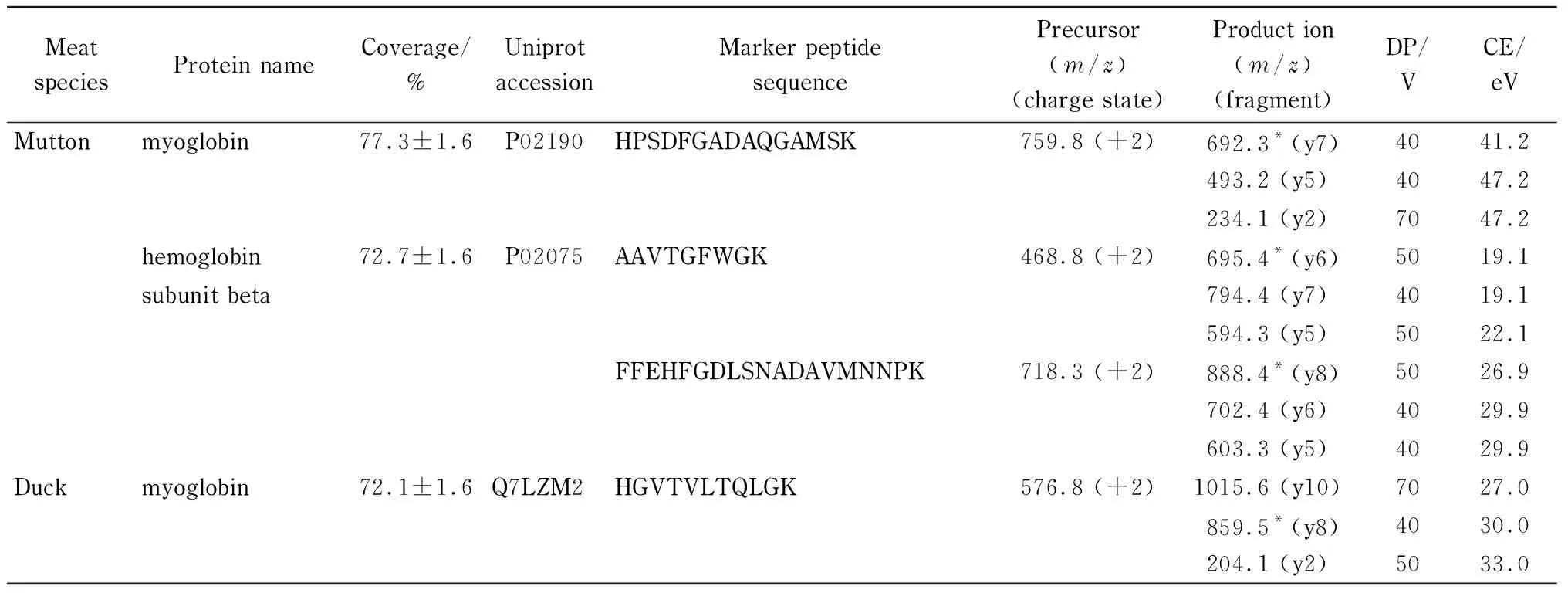
表 2 羊肉、鸭肉、猪肉、鸡肉的特征肽段及MRM参数
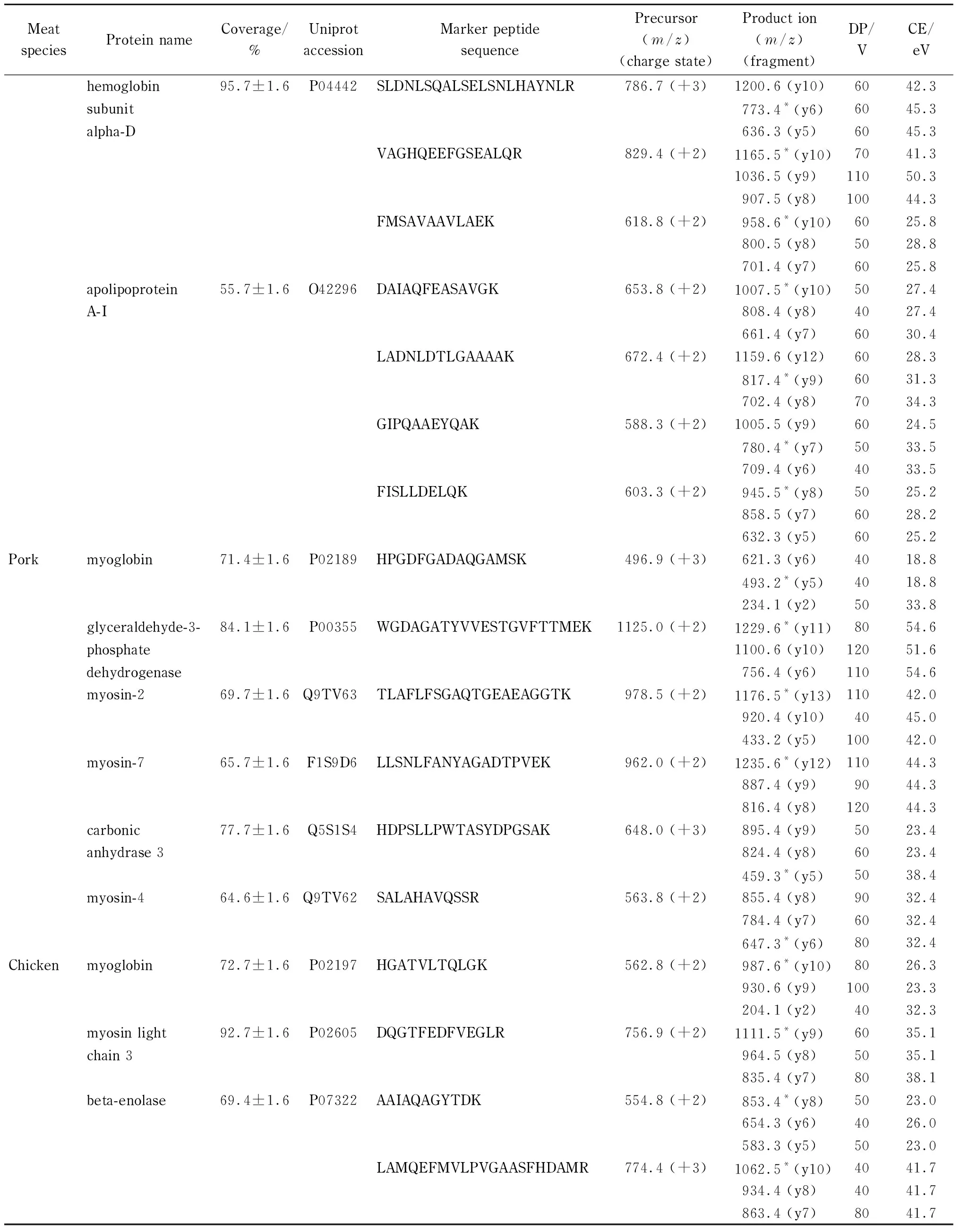
表 2 (续)
* Quantitative ion. DP: declustering potential. CE: collision energy.
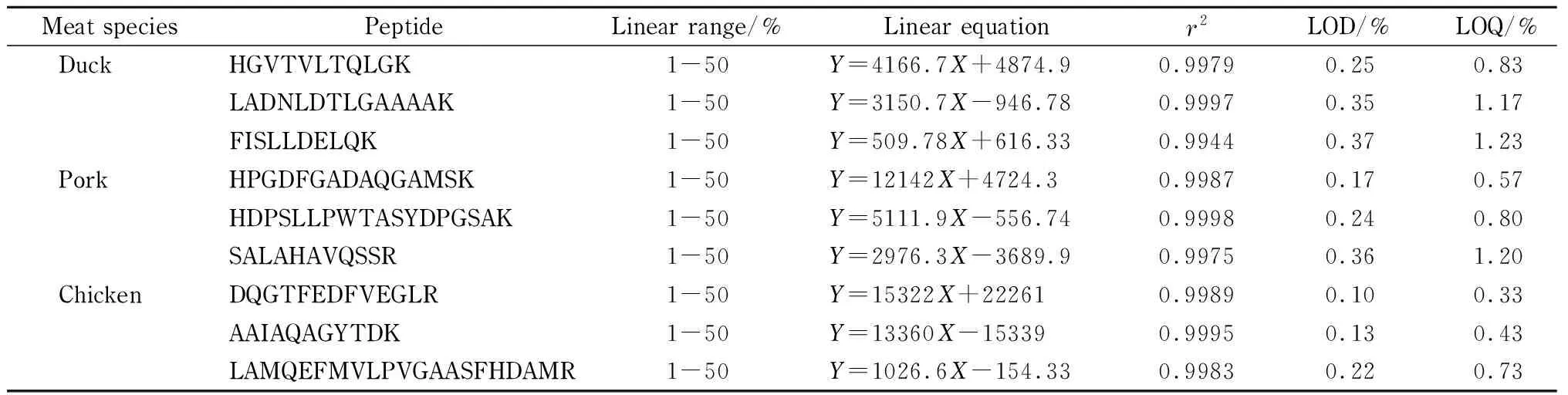
表 3 鸭肉、猪肉和鸡肉的9个特征肽段的线性范围、线性方程、相关系数(r2)、检出限和定量限
Y: peak area;X: mass percentage, %.
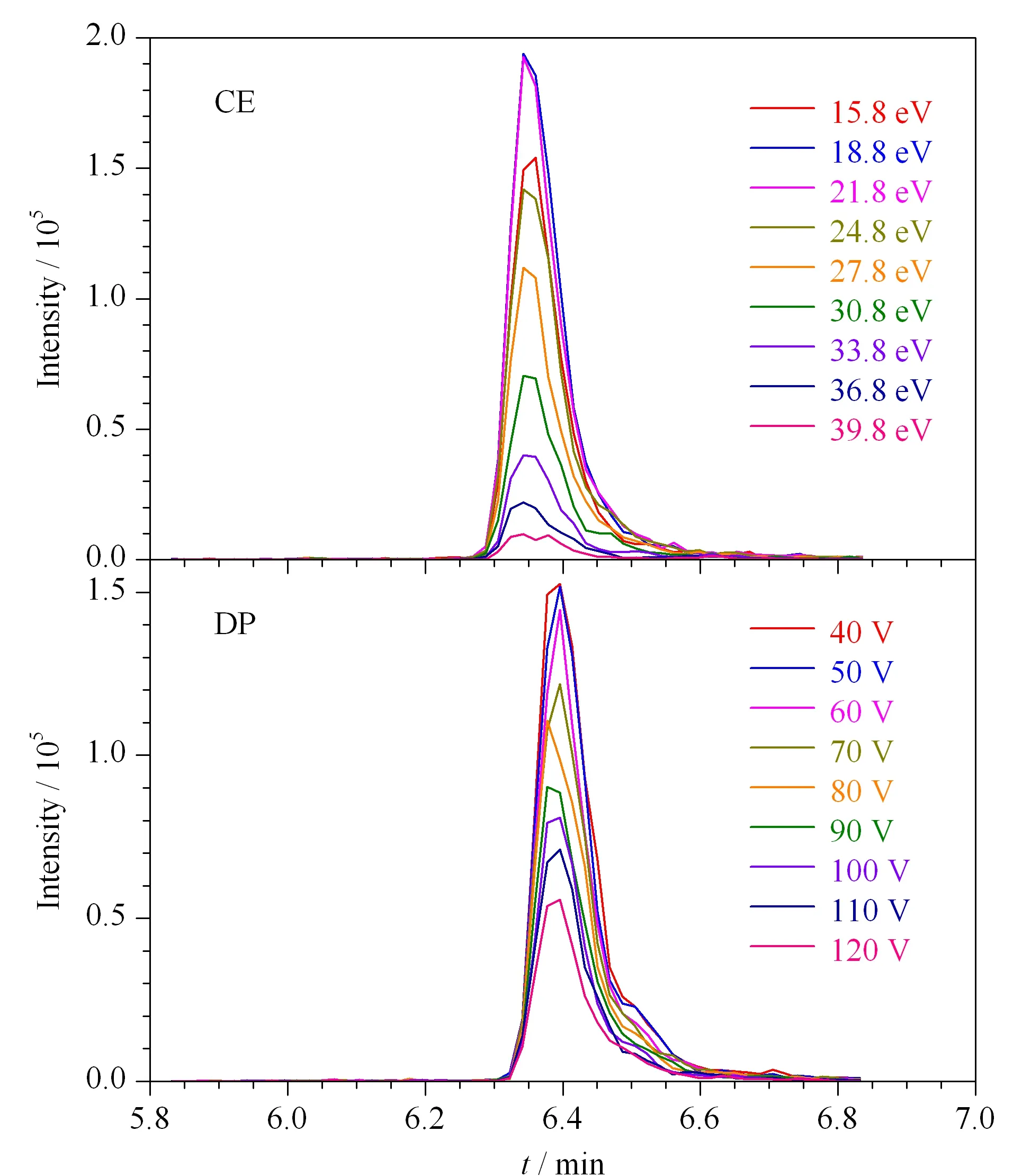
图 3 猪肉特征肽段HPGDFGADAQGAMSK的CE和DP值优化结果
建立MRM方法的一个目的就是为了精确定量,因此需要优化各质谱条件以提高检测的灵敏度。当使用MRM方法检测目标较多时,逐一优化质谱条件往往需要耗费大量的时间。Skyline软件可以用来设计和改善MRM方法,优化碰撞能量(CE)和去簇电压(DP),提高各特征肽段的响应强度。以猪肉特征肽段HPGDFGADAQGAMSK为例,对离子通路496.889 4(2+)→493.243 9(+)施加不同的CE值和DP值,所得出的响应强度结果如图3所示,当CE为18.8 eV, DP为40 V时肽段响应强度最高。如此,针对每个离子对优化出一个最佳的CE值和DP值,生成最终的MRM定量方法。优化后的MRM方法中各物种特征肽段离子对信息见表2,优化后各物种特征肽段的提取离子色谱图见图4。

图 4 羊肉、鸭肉、猪肉、鸡肉特征肽段的提取离子流色谱图
虽然经过BLAST搜索,确定所选肽段为该物种的特征肽段,但是由于某些物种的蛋白质数据库还未完善[20],为避免因数据库中数据的缺失对物种特征肽段确认所造成的影响,需要对所选的特征肽段进行进一步的验证,确保所选肽段的特异性。验证方法采用排除法,以鸡肉为例,将鸭肉、猪肉和羊肉特征肽段的MRM方法合并形成一个新的MRM方法,用该方法检测鸡肉样品,实验结果如图5a所示,鸡肉样品采集到的色谱质谱图中没有出现其他3种肉类的特征肽段峰,其中出现了个别肽段的单个离子对的色谱峰,但保留时间和对应肽段并不相同,为干扰离子峰。采用相同方法检测了鸭肉、猪肉和羊肉样品,结果如图5b~5d所示,未出现保留时间和至少两个离子对符合的情况。说明利用本方法筛选出的羊肉、猪肉、鸡肉、鸭肉特征肽段之间不存在互相干扰,能够确保方法的专一性和可靠性。
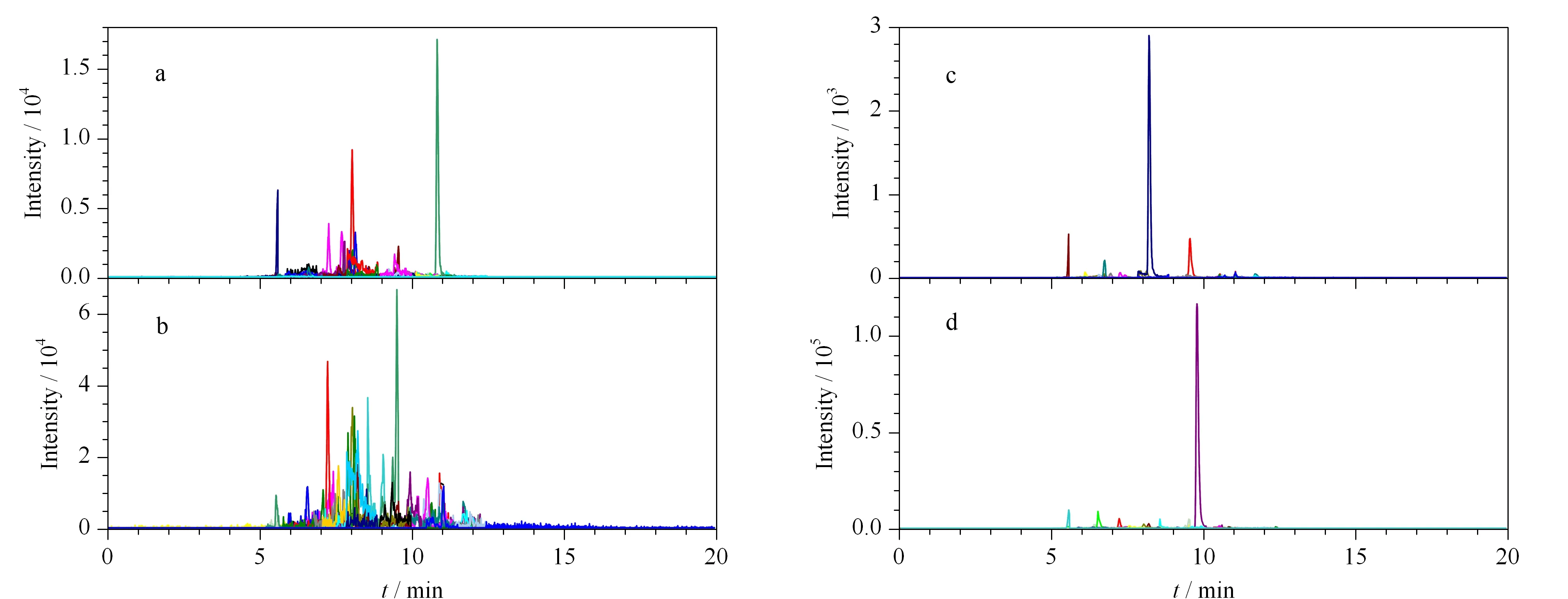
图 5 肽段特异性考察结果
2.3 方法学验证
鸭肉、猪肉、鸡肉为羊肉制品中最常见的掺假成分,采用本方法对羊肉掺假检测进行了定量研究,即考察羊肉中鸭肉、猪肉和鸡肉的检出限、定量限、回收率等性能参数。针对每个物种,分别选择响应强度最高的3个特征肽段进行方法学考察。
2.3.1线性关系、定量限和检出限
将鸭肉、猪肉、鸡肉分别按照质量分数为1%、5%、10%、20%、50%的比例混合在羊肉中,制作标准曲线。如表3所示,分别以混合比例(质量分数)为横坐标(X,%),以所选取的鸭肉、猪肉和鸡肉的特征肽段峰面积(Y)为纵坐标制作标准曲线。各标准曲线相关性系数均大于0.99。以3倍和10倍信噪比(S/N)确定方法的检出限(LOD)和定量限(LOQ),最终确定鸭肉、猪肉和鸡肉的最低掺假检出限分别为0.25%、0.17%和0.10%,最低掺假定量限分别为0.83%、0.57%和0.33%。该结果优于目前大部分文献[15,16,21,22]报道的水平。在后续的工作中可引入同位素内标,用以抵消不同样品的基质效应,进一步提高定量的准确性和重现性。
2.3.2回收率和精密度
在羊肉中分别添加质量分数为1%、5%和20%的鸭肉、猪肉和鸡肉,按1.2.2节步骤酶解后进行质谱检测,采用标准曲线定量计算加标回收。结果见表4,平均加标回收率为71.4%~115.0%,日内精密度(RSD)小于8%,日间RSD小于15%,证明该方法具有较高的准确度和稳定性,使用该方法能够较可靠地测定羊肉样品中3种掺假肉类成分的含量。
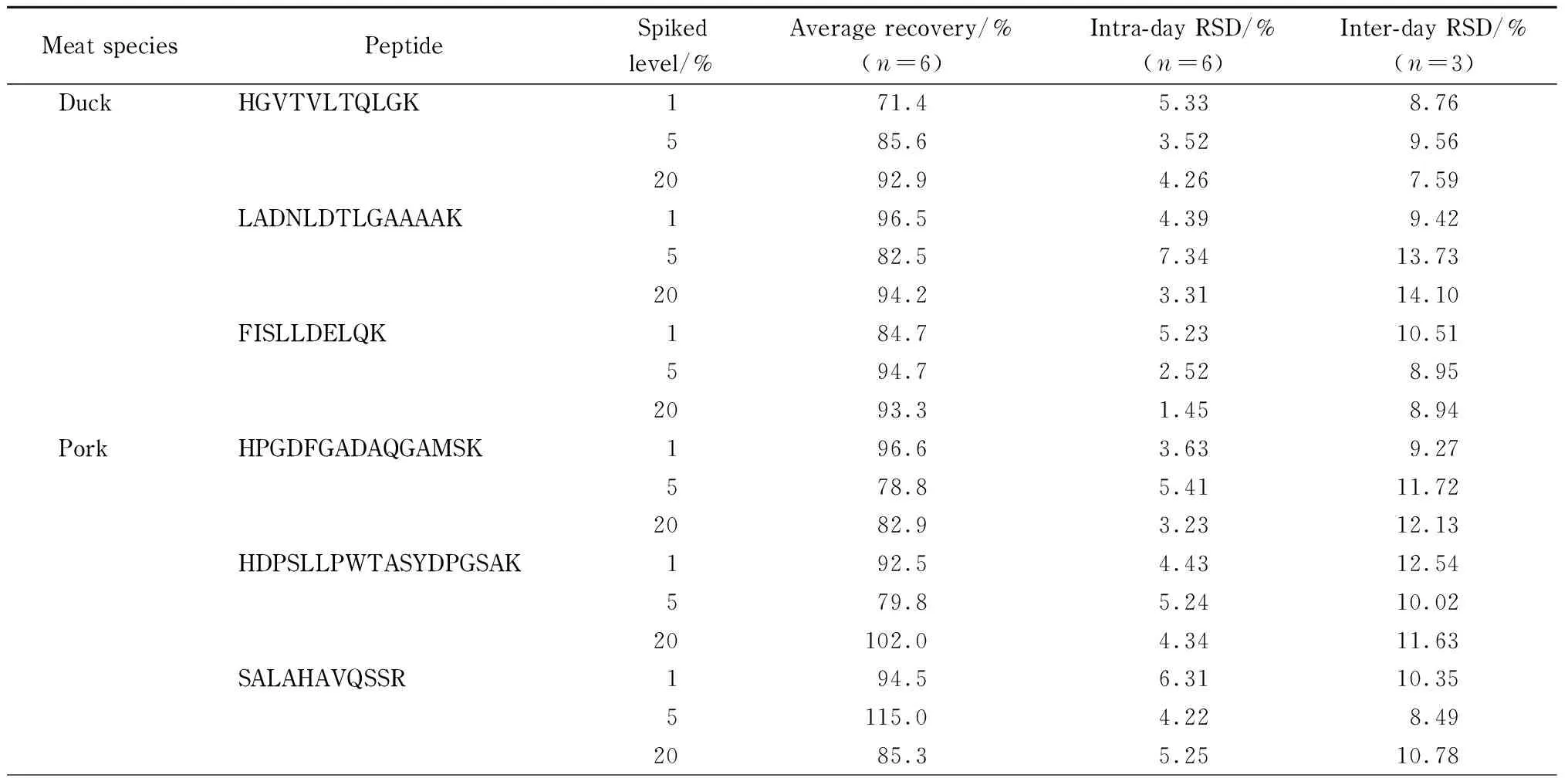
表 4 鸭肉、猪肉和鸡肉的9个特征肽段的平均回收率和日内精密度、日间精密度
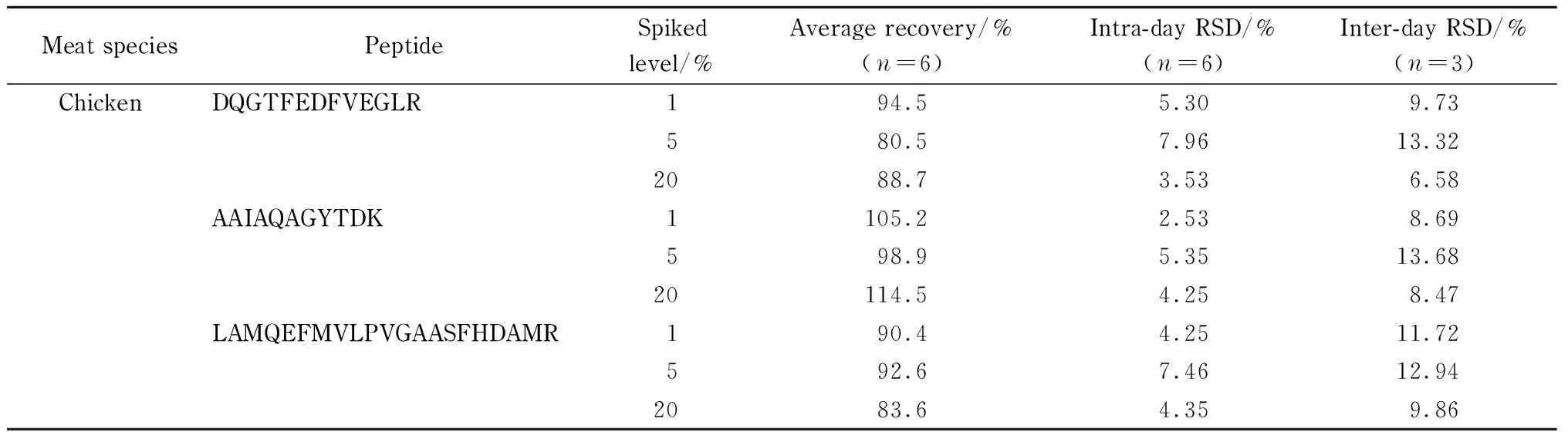
表 4 (续)
2.4 实际样品检测
为了验证所建立分析方法的适用性,对30份在市场上随机抽取的羊肉制品(包括羊肉卷、羊肉串和羊肉干)进行了检测。结果显示,本次抽样筛查结果良好,羊肉制品中只检测到羊肉的特征肽段,鸭肉、猪肉和鸡肉的特征肽段均未检测到。并且采用PCR方法进行比对,结果与本方法吻合,进一步证明了所建方法的适用性。
3 结论
本研究采用UPLC-Q/Exactive-HRMS和UPLC-QqQ-MS相结合,共筛选出4种肉类的20个特征肽段,并且建立了以特征肽段为分析对象的羊肉掺假鉴别和定量测定方法。采用本方法,样品酶解时间短,干扰少,具有较高的灵敏度和回收率。基于此原理可同时进行多种肉类的鉴别,为掺假检测提供了一种有力的研究平台,可以同其他技术相互补充,在食品真伪鉴别领域具有广阔的市场应用前景。
杂志排行
色谱的其它文章
- 获2017年度领跑者5000
--中国精品科技期刊顶尖学术论文入选证书的《色谱》论文名单 - Determination of airborne formaldehyde and ten other carbonyl pollutants using programmed temperature vaporization-large volume injection-gas chromatography
- 重组含糖识别结构域的人源半乳糖凝集素-3在糖蛋白/糖肽富集中的应用
- QuEChERS-液相色谱-串联质谱法测定蔬菜中105种农药残留
- 超高效液相色谱-串联质谱法测定热带水果中杀虫双残留
- 高效液相色谱-串联质谱法分析毛发中甲基苯丙胺和苯丙胺手性对映异构体
