挖掘经典内涵 拓宽知识视角
2018-12-06江苏刘子源陈仕功
江苏 刘子源 陈仕功
欣赏完2018年全国及各省市的高考化学试卷,又对近几年高考试题进行比较,可以发现滴定分析的定量考查已成为高考新常态,它因滴定原理的三重表征使试卷具有学科味,又因解决生产生活实际而具有生活味。试题中经典的滴定分析方法主要有四种,即氧化还原滴定、络合滴定、酸碱滴定、沉淀滴定,现整合如下,仅供参考。
一、经典永恒——酸碱滴定法

例1(2018北京·26,节选)取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是_____________。(已知:H3PO4摩尔质量为98 g·mol-1)
【解析】H3PO4的三级电离常数分别为K1=7.52×10-3,K2=6.31×10-7,K3=4.4×10-13, 每级电离平衡常数之间相差大于104倍,可以保证分步滴定的精确度。


当然,多元酸或多元碱是分步电离的,如果相邻的电离常数相差较大,即大于104,就可以进行分步滴定,只是精确度不高,误差约为1%。很多药品是很弱的有机碱,可以在冰醋酸介质中用高氯酸滴定,特点是非水介质。粮食中蛋白质的含量可用克氏定氮法测定。
二、经典传承——配位滴定法
络合反应滴定法是以络合反应(形成配合物)为基础的滴定分析方法,又称配位滴定法。络合反应广泛地应用于分析化学的各种分离与测定中,如许多显色剂、萃取剂、沉淀剂、掩蔽剂等都是络合剂。
例2(2018江苏·18,节选)通过测定碱式硫酸铝[(1-x)Al2(SO4)3·xAl(OH)3]溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入过量盐酸酸化的BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.330 0 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入 0.100 0 mol·L-1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.080 00 mol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。

乙二胺四乙酸简称EDTA或EDTA酸,常用H4Y表示,含有羧基和氨基的螯合剂,能与许多金属离子形成稳定的螯合物。在化学分析中,它除了用于络合滴定以外,在各种分离、测定方法中,还广泛地用作掩蔽剂。由于EDTA酸在水中的溶解度小,通常将其制成二钠盐,一般也称EDTA或EDTA二钠盐,常以Na2H2Y·2H2O形式表示。

三、经典创新——氧化还原滴定法
氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法。它以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质;或者间接滴定一些本身并没有氧化还原性,但能与某些氧化剂或还原剂起反应的物质。
1.碘量法:利用的I2的氧化性和I-的还原性为基础的一种氧化还原方法。
例3(2018全国Ⅰ·27,节选)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为 ,该样品中Na2S2O5的残留量为 g·L-1(以SO2计)。

2.自身显色滴定法:高锰酸钾、重铬酸钾标准滴定溶液滴定产品草酸时,滴定终点为高锰酸钾、重铬酸钾标准滴定溶液的自身颜色。
例4(2018全国Ⅱ·28,节选)测定三草酸合铁酸钾中铁的含量。①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定终点的现象是_____________。②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为_____________。

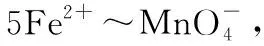
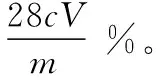
与酸碱滴定法和配位滴定法相比较,氧化还原滴定法应用非常广泛,它不仅可用于无机分析,而且可以广泛用于有机分析,许多具有氧化性或还原性的有机化合物可以用氧化还原滴定法来加以测定。
直接滴定法如高锰酸钾,滴定时无需另加指示剂。高锰酸钾氧化能力强,可直接滴定具有还原性的物质;返滴定法可测定一些不能直接滴定的氧化性和还原性物质;间接滴定法指有些非氧化性或还原性物质不能用直接滴定法或返滴定法测定时,可采用此法。
四、经典塑造——沉淀滴定法
沉淀滴定法是利用沉淀反应进行容量分析的方法。生成沉淀的反应很多,但符合容量分析条件的却很少,实际上应用最多的是银量法。
例5(2017天津·9,节选)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),滴定的主要步骤:取待测NaI溶液 25.00 mL,加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀,加入NH4Fe(SO4)2溶液作指示剂,用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。重复上述操作两次。三次测定数据如下表:
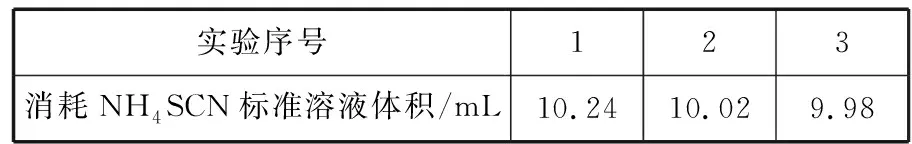
实验序号123消耗NH4SCN标准溶液体积/mL10.2410.029.98
测得c(I-)= mol·L-1。
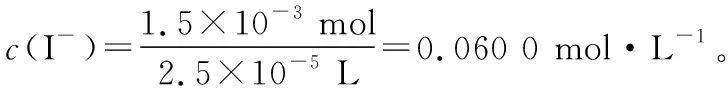
常见的银量法有4种:(1)在中性或弱碱性的含Cl-试液中,加入指示剂铬酸钾,用硝酸银标准溶液滴定,氯化银先沉淀,当砖红色的铬酸银沉淀生成时,表明Cl-已被定量沉淀,指示终点已经到达,此法方便、准确,应用很广。(2)在含Ag+的酸性试液中,加NH4Fe(SO4)2为指示剂,以NH4SCN为滴定剂,先生成AgSCN白色沉淀,当红色的 Fe(SCN)2+出现时,表示Ag+已被定量沉淀,终点已到达,此法主要用于测Ag+。(3)在含卤素离子的酸性溶液中,先加入过量的AgNO3标准溶液,再加指示剂 NH4Fe(SO4)2,以NH4SCN标准溶液滴定过剩的Ag+,直到出现红色为止。两种试剂用量之差即为卤素离子的量,此法的优点是选择性高,不受弱酸根离子的干扰。(4)在中性或弱碱性的含Cl-试液中加入吸附指示剂荧光黄,当用AgNO3滴定时,在等当点以前,溶液中Cl-过剩,AgCl沉淀的表面吸附Cl-而带负电,指示剂不变色。在等当点后,Ag+过剩,沉淀的表面吸附Ag+而带正电,它会吸附带负电荷的荧光黄离子,使沉淀表面显示粉红色,从而指示终点已到达,此法的优点是方便。

