再议平衡移动方向的判断依据及解题方法
2018-12-06河北刘志峰韩雪松
河北 刘志峰 韩雪松
本文阐述了化学平衡移动的实质,提出了对化学平衡移动方向进行判断的两类方法。指出在平衡移动方向判断中存在的错误认识。分析了平衡移动是一过程变量,它与平衡时的状态函数无必然关系。整理化学平衡移动方向和移动结果分析的教学策略,介绍了其在离子平衡中的应用。
1 问题的提出
化学平衡在高中化学反应原理模块中既是重点也是难点内容。由于教材对化学平衡移动方向原理的描述缺失与混乱,不同教师对化学平衡移动原理理解不同,对化学平衡移动方向判断的标准不同,经常会导致同一个试题得出相反的结论与解释。为此,我们有必要分析化学平衡移动的实质,明确判断移动方向的方法及适用范围,指出在化学平衡移动方向判断中的错误认识,梳理该内容的教学策略。
2 化学平衡移动概念界定
化学平衡移动指的是什么?任何一个化学平衡移动过程,都可用图1表示。

图1
化学平衡移动与三个状态有关:“原平衡态1”、改变条件后的“非平衡态”、在新的条件下达到的“新平衡态2”。由“原平衡态1”经过“非平衡态”到达“新平衡态2”的过程,叫作化学平衡的移动。一个反应体系处于平衡状态时,是没有“方向”的,“平衡移动方向”是指由“非平衡态”到达“新平衡态2”的方向。所以分析移动方向时,要看从“非平衡态”到“新平衡态2”的过程中,反应物和生成物是如何转化的,如果在此过程中,反应物减少,生成物增多,则该平衡向正反应方向移动,反之,向逆反应方向移动。
3 化学平衡移动方向的判断依据
3.1 实践经验的定性判断依据
3.1.1 正反应速率和逆反应速率的相对大小
外界因素是通过改变反应速率从而影响化学平衡的,从动力学角度看,在已建立的平衡状态的基础上,条件的改变使单位体积内活化分子数目及有效碰撞几率发生改变,使正反应速率与逆反应速率发生变化至不相等,打破原来的平衡状态而使化学平衡发生移动。化学平衡移动方向取决于条件改变后“非平衡态”的正反应速率与逆反应速率的竞争。
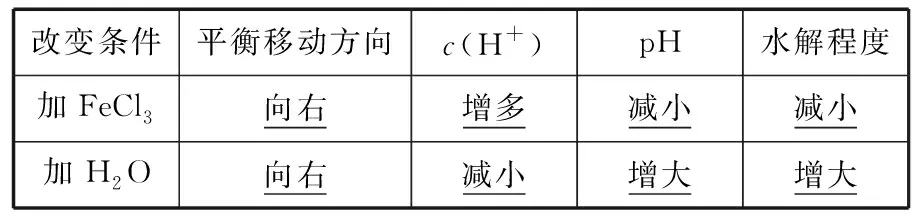
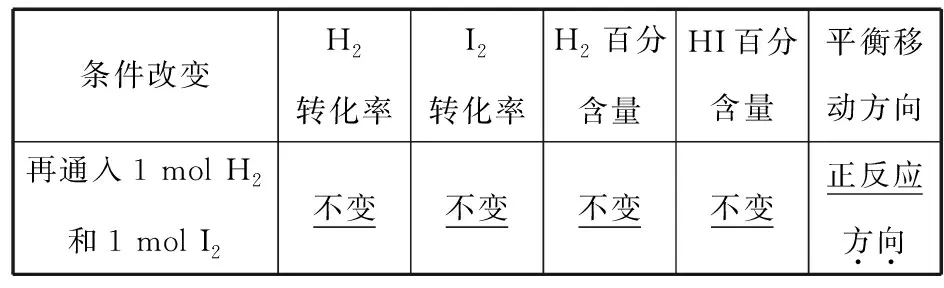
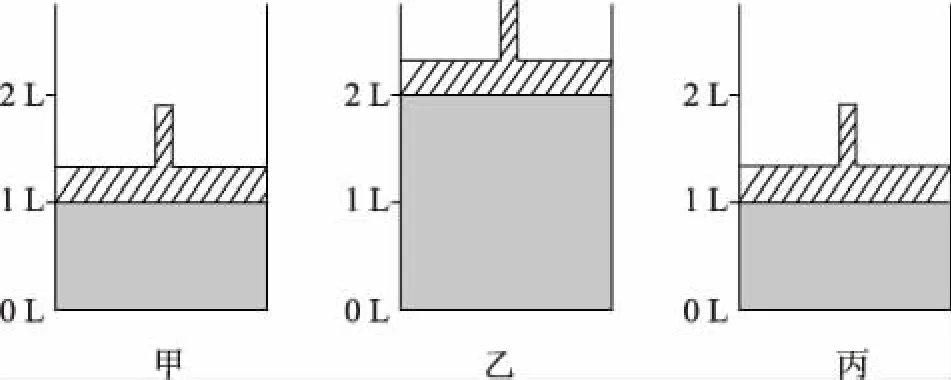
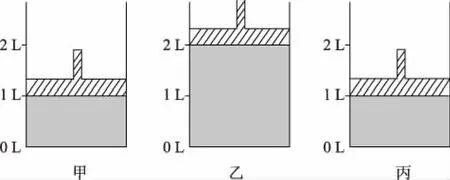
即“非平衡态”时:当v(正)>v(逆)时,化学平衡正向移动;当v(正) 3.1.2 勒夏特列原理 高中教材中,主要介绍运用勒夏特列原理来判断化学平衡的移动方向。该原理具体表述如下:如果改变影响平衡的条件之一(如温度、压强以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。 在运用勒夏特列原理判断移动方向时,需要注意以下两点: (1)“改变的条件”为“一个” 改变的条件应该为“一个”,若同时改变“多个”条件,则运用勒夏特列原理未必能做出准确的判断。 在通入N2后,c(N2)的浓度会增大,但容器体积也会增大,所以c(H2)和c(NH3)均会减少。此题变化的条件不是“一个”而是“多个”,此时利用勒夏特列原理不一定能做出正确的判断,上述平衡可能正向移动、逆向移动或不移动。 (2)正确认识“改变的条件” 对该题有两种解释:①“再加入1 mol PCl5(g)”增大了反应物浓度,平衡正向移动。②“再加入1 mol PCl5(g)”增大了反应体系压强,平衡逆向移动。 造成错误解释的原因,就是没有正确认识“改变的条件”。各组分的分压同时增大或减小相同的倍数而引起体系总压的改变才能认为是“改变压强”。在本题中,“再加入1 mol PCl5(g)”只是改变了反应物的浓度,所以①解释正确。 3.2.1 浓度商与平衡常数的相对大小 对于某可逆反应,设该反应在一定温度下的平衡常数为K,在“非平衡态”时的浓度商为Q。若K>Q,平衡将朝正方向移动;若K 3.2.2 ΔrGm与0的相对大小 在3套高中化学教材中,都设置了有关化学反应方向的教学内容,在该部分内容中,介绍了利用ΔG判断化学反应的方向。 当某可逆反应处于平衡状态时(ΔrGm=0),改变影响平衡的一个条件到“非平衡态”(此时ΔrGm≠0),若ΔrGm<0,则化学平衡向正反应方向移动。若ΔrGm>0,则化学平衡向逆反应方向移动。若ΔrGm=0,则化学平衡不移动。 由此可知,所有平衡移动问题,实际上都是“非平衡态”时的ΔrGm的计算问题。因为高中阶段不涉及ΔrGm的计算,所以该方法不会实际应用在解题中。 3.2.3 两者的统一 若Kθ=Q,则ΔrGm=0,体系处于平衡状态,改变条件对平衡没有影响。 若Kθ 若Kθ>Q,则ΔrGm<0,化学平衡将向正反应方向移动。 由此可知,依据Q与Kθ的相对大小判断化学平衡和依据ΔrGm与0的相对大小判断化学平衡移动方向两者是相互联系的,也是统一的。 误区1:利用转化率作为平衡移动的判断依据 误区2:利用百分含量作为平衡移动的判断依据 误区3:利用等效平衡原理作为平衡移动的判断依据 表1 如图2所示,再向1 L的容器甲中通入1 mol H2和 1 mol I2,相当于向恒压密闭容器乙中再通入1 mol的 H2(g) 和1 mol I2(g),然后再将容器容积由2 L压缩为 1 L,即容器丙。因该反应气体体积不变,所以压缩过程中平衡不移动。由此可知,建立的“新平衡(容器丙)”与“原平衡(容器甲)”等效。所以,反应物的转化率不变,各物质的百分含量不变。 图2 但不能因此就说平衡没有发生移动,不管从v(正)和v(逆)的相对大小、勒夏特列原理,还是从Qc和K的相对大小分析,该平衡都会向正反应方向移动。 表2 如图3所示,再向1 L的容器甲中通入1 mol PCl5(g),相当于向恒压密闭容器乙中再通入1 mol的PCl5(g),然后再将容器容积由2 L压缩为1 L,即容器丙。因该反应正方向为气体物质的量增大的方向,所以压缩过程中平衡逆向移动。由此可知,建立的“新平衡(容器丙)”与“原平衡(容器甲)”相比,相当于增大压强。PCl5的转化率减小,PCl5百分含量增大,Cl2和PCl3百分含量减小。 图3 由以上例题可以看出:等效平衡说的是“原平衡态1”与“新平衡态2”是“等效”的。在比较物质的转化率、百分含量时也是用“原平衡态1”与“新平衡态2”进行比较。而化学平衡移动方向是看从“非平衡态”到“新平衡态2”的过程中物质发生了什么样的转化。两者研究的对象是不同的,所以也没有必然的关系(如图1)。 所以,以上错误解释忽略了平衡移动是一个过程,错误地用新、旧平衡状态的参数(物质的转化率或百分含量)作为平衡移动判断依据,等效平衡讨论的也只是平衡状态的参数,不涉及反应的过程,而化学平衡移动恰好就是描述化学反应过程的概念。分析本身没有抓住平衡移动的本质。因此,用物质的转化率、百分含量的变化等作为平衡移动方向的判断依据是不合理的,经常不能得到正确答案。 化学平衡的移动:我们把可逆反应中旧化学平衡的破坏、新化学平衡建立的过程,叫作化学平衡的移动,也就是由“原平衡态1”经过“非平衡态”到达“新平衡态2”的过程,叫作化学平衡的移动。化学平衡的移动指的是从旧平衡被破坏到新平衡的建立这一过程,而不是“新”“旧”两平衡态之间的关系。 化学平衡移动的结果:在对比“原平衡态1”与“新平衡态2”时,如对比两个平衡状态的各物质体积分数如何变化、反应物的转化率如何变化等,这些比较都是比较平衡移动的结果,与平衡移动方向无关,与新平衡建立的过程和途径无关。等效平衡是描述两个平衡状态函数的关系,属于化学平衡移动的结果范畴,不能说明平衡移动的方向。 综合以上内容,我们可以将其判断方法归纳如下: (1)改变多种反应物中的某一种物质的浓度或改变多种生成物中某一种物质的浓度才是改变浓度,无论分析移动的方向还是结果,都按改变浓度分析。 (2)同等比例改变所有反应物和生成物的浓度,才是改变压强,无论分析移动的方向还是结果,都按改变压强分析。 (3)同等比例改变所有反应物浓度或同等比例改变所有生成物浓度,分析平衡移动方向时按改变浓度分析,分析平衡移动结果时按改变压强分析。 解释:达到平衡后,再通入2 mol NH3,同等比例地增大了生成物的浓度,当分析平衡移动方向时,按照浓度来考虑,增大了生成物浓度,平衡向逆反应方向移动。当分析体积分数时,按增大压强分析,增大压强,平衡正向移动,NH3的体积分数增大,即:a 表3 加水稀释时,同等比例地减少了所有微粒的浓度,它就像气体反应中的减小压强,所以平衡会向着微粒数目增多的方向移动,即向正反应方向移动,所以电离度增大,但反应式中所有微粒的浓度减小,导电率减弱。 加少量冰醋酸时,增大了反应物的浓度,平衡正向移动。从结果上看相当于减小溶液体积,即增大所有物质的浓度,平衡会向着微粒数目减小的方向移动,所以电离度减小,但c(H+)增大,导电能力增强。 表4 加水稀释时,同等比例地减少了所有微粒的浓度,它就像气体反应中的减小压强,所以平衡会向着微粒数目增多的方向移动,即向右移动(H2O作为纯液体不会出现在平衡常数中,所以正反应可以看作微粒个数增多的反应),水解程度增大。但反应式中所有微粒的浓度减小,pH增大。

3.2 化学热力学方面的定律判断依据
3.3 化学平衡移动方向判断的错误方法



4 化学平衡移动的过程与结果辨析
5 教学策略归纳

6 拓展应用
6.1 分析弱电解质电离平衡的移动


6.2 分析盐类水解的平衡的移动