透析经典试题 提高复习效率
2018-12-06印志林
陈 颖 印志林
江苏
比较中和反应(特别是强酸与弱碱或弱酸与强碱的反应)后溶液中离子浓度的相对大小,涉及电解质溶液理论的很多重点知识,一直是高考中出现频率非常高的一类题目。在复习教学中,如果我们能对有关的经典试题进行深入分析,则可以触类旁通,提高复习效率。
【例题】用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
( )
一、应试方法分析

二、试题发散分析
如果是作为一道平常的练习题,我们就不应该只满足于求得了一个正确答案,引导学生多角度地思考一些问题,对于巩固所学知识,提高学生的思维能力都是大有裨益的。
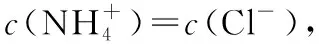


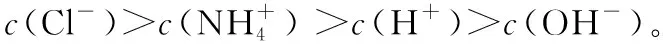
(3)当溶质由NH4Cl和HCl组成时,根据NH4Cl和HCl浓度的相对大小,溶液中离子浓度的大小关系又有三种可能:



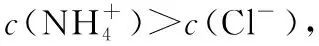


三、解题规律分析
对中和反应后溶液的性质分析,既有定性分析,也有定量分析,可以总结以下重要规律。
1.酸碱恰好中和时,溶液的性质是谁强显谁性
酸和碱恰好中和时,溶液的性质取决于反应生成的盐的性质:强酸和强碱反应生成的盐不水解,溶液显中性;弱酸和强碱反应生成的盐水解,溶液显碱性;强酸和弱碱反应生成的盐水解,溶液显酸性。
2.pH之和为14的酸碱等体积混合时,溶液的性质是谁弱显谁性
设酸溶液的pH=a,则c(H+)酸=10-amol/L;碱溶液的pH=14-a,pOH=a,c(OH-)碱=10-amol/L。当酸为强酸、碱为强碱且等体积混合时,酸碱恰好中和,溶液显中性;当酸为强酸、碱为弱碱,等体积混合时,碱过量,溶液显碱性;当酸为弱酸、碱为强碱,等体积混合时,酸过量,溶液显酸性。
3.强酸与强碱中和反应中pH与体积的关系
在强酸与强碱的中和反应中,设反应前强酸溶液的 pH=a,体积为Va(L);强碱溶液的pH=b,体积为Vb(L)。则n(H+)=10-a·Vamol,n(OH-)=10b-14·Vbmol。

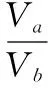
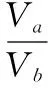
四、重要题型分析
1.中和反应后溶液的性质分析
例1.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
( )
A.0.1 mol·L-1的盐酸和0.1 mol·L-1的氢氧化钠溶液
B.0.1 mol·L-1的硫酸和0.1 mol·L-1的氢氧化钾溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
解析:A项中盐酸和NaOH溶液恰好反应,所得溶液呈中性;B项反应中硫酸过量,溶液呈酸性;醋酸是弱酸,C项反应中醋酸过量,溶液呈酸性;氨水是弱碱,D项反应中氨水过量,溶液呈碱性。
答案:D
2.中和反应后溶液中离子浓度的大小比较
例2.室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是
( )

A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.b点时:c(Na+) =c(CH3COO-)>c(H+)=c(OH-)
C.c点时:c(OH-)=c(CH3COOH) +c(H+)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
解析:a点时,溶液中含有等物质的量的CH3COOH和CH3COONa,溶液显酸性,CH3COOH的电离程度大于CH3COONa的水解程度,溶液中的浓度关系应为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),A错。b点时,溶液显中性,根据电荷守恒关系可知B正确。c点时,CH3COOH和NaOH恰好完全反应,根据质子守恒关系可知C正确。d点时,溶质为NaOH和CH3COONa,溶液显碱性,D正确。
答案:A
3.有关中和反应的计算
例3.室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
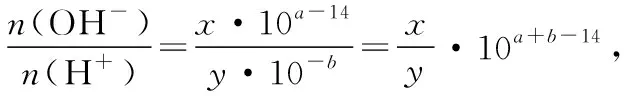



答案:D
例4.在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=__________。
(2)在此温度下,将pH=a的NaOH溶液VaL与 pH=b的硫酸VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=__________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=__________。
解析:(1)由题意知,NaOH溶液中的c(H+)=10-11mol·L-1,c(OH-)=0.01 mol·L-1,故Kw=c(H+)·c(OH-)=10-13。



答案:(1)10-13(2)①1∶10 ②10∶1

