例析电解质溶液中非逻辑思维导致的错误结论
2018-12-06王开山
王开山
宁夏
一、问题提出
“水溶液中的离子平衡”是高中化学重要的基础理论,也是学习的重点、难点和高考考查的热点。由于本部分内容针对的是微粒在水溶液中的平衡行为,其抽象、模糊、艰涩难懂。对部分知识理解浅层、模棱两可、似懂非懂是不少学生的普遍感受。通过归纳法得出结论,然后运用结论进行问题解答是这部分内容常见的试题解答方法,但由于理解的浅层导致出现了一些“乍看天衣无缝,细究破绽百出”的错误推理。
二、例析常见的错误结论
结论1.由于“越弱越水解,对应溶液的酸性或碱性越强”。一定温度下,等浓度Na2A溶液的pH大于Na2B溶液的pH,所以H2A的酸性弱于H2B。
结论2.由于“越弱越水解,对应溶液的酸性或碱性越强”。常温下,测得饱和NaA溶液的pH大于饱和NaB溶液的pH,所以A-水解程度强于B-水解程度。
分析:“越弱越水解,溶液的酸性或碱性越强”,是判断酸或碱强弱的经验规律之一。具体指的是酸或碱越弱,对应的弱酸阴离子或弱碱阳离子越容易水解,同温度同浓度时,溶液的碱性或酸性就越强。其要点有两个:(1)对应的弱酸阴离子或弱碱阳离子指的是酸或碱发生相应一级电离后的离子;(2)由于温度会影响水解程度,浓度会影响水解后溶液的pH大小,所以比较的前提是盐溶液必须保持同温度、同浓度。
例1.一定温度下,等浓度Na2A溶液的pH大于Na2B溶液的pH,能够说明的是A2-的水解程度强于B2-的水解程度。即对应的HA-酸性弱于HB-的酸性,而不是H2A酸性弱于H2B的酸性。能用来说明H2A和H2B的酸性强弱的是HA-和HB-的水解程度。所以,判断的前提是对应关系的正确。
例2.盐溶液pH大小与其离子水解程度的强弱并无必然关联,正如汽车行驶得远并不代表一定行驶得快。一定温度下,决定Na2A和Na2B溶液pH大小的因素除了A-和B-的水解程度外,还与溶液中A-和B-的浓度有关。常温下,由于不知道Na2A和Na2B的溶解度,所以就不知道饱和Na2A溶液与饱和Na2B溶液的浓度。当饱和Na2A溶液浓度远大于饱和Na2B溶液的浓度,即使水解程度A-弱于B-,也有可能饱和Na2A溶液的pH大于饱和Na2B溶液的pH。 所以,结果(pH)的对比不仅是本性(水解程度)的比拼,更要有量(浓度)的助推。
结论3.由于“强酸可以制弱酸”,H3PO4的酸性强于H2CO3的酸性,所以向Na2CO3溶液中滴加H3PO4,会生成Na3PO4、CO2和H2O。
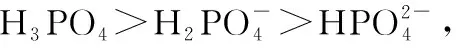
几种多元弱酸的电离常数(25℃)

弱酸电离常数弱酸电离常数H2CO3K1=4.4×10-7K2=4.7×10-11H3PO4K1=7.1×10-3K2=6.3×10-8K3=4.2×10-12
所以,对于多元酸的酸性强弱要比较的是各酸性微粒的电离常数大小,以便确定最终的产物种类。
结论4.由于“谁强显谁性”,0.001 mol/L的CH3COOH溶液和0.001 mol/L的NaOH溶液等体积混合,溶液呈碱性。所以,常温下pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合,溶液也呈碱性。
分析:“谁强显谁性”主要用来判断单一盐溶液的酸碱性。0.001 mol/L的CH3COOH溶液和0.001 mol/L的NaOH溶液等体积混合恰好反应生成CH3COONa,CH3COONa水解使溶液呈碱性。由于CH3COOH是弱电解质,电离程度很小,pH=3说明CH3COOH溶液中c(H+)=10-3mol/L,大量的H+还“隐藏”在CH3COOH分子中。所以pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积反应后是CH3COONa和CH3COOH的混合溶液,且c(CH3COOH)≫c(CH3COONa),即溶液呈酸性。所以从浓度到pH改变的不仅是表达方式,更有量的巨大差别。


结论6.在难溶电解质溶液体系中,当Qc>Ksp时,就会有沉淀产生。25℃,由于AgCl的Ksp=1.8×10-10,则10 mL 2.0×10-4mol/L的AgNO3溶液和10 mL 2.0×10-6mol/L的NaCl溶液混合后会有AgCl沉淀产生。
分析:离子浓度会随着溶液体积的变化而发生变化。上述10 mL AgNO3溶液和10 mL NaCl溶液混合的瞬间,Ag+和Cl-的浓度都会变为原来的一半(混合前后溶液体积变化忽略不计),此时Qc=c(Ag+)×c(Cl-)=1.0×10-10<1.8×10-10,所以不会产生沉淀。所以基于数据的定量计算不仅要关注原有的数据还要关注数据的变化。
结论7.由于离子之间生成难溶物时不能大量共存,且Fe3+易与碱溶液中的OH-反应生成Fe(OH)3,所以在中性溶液中Fe3+可以大量存在。

结论8.由于Ksp和溶解度的大小都可以反映电解质的溶解性强弱,所以一定温度下,难溶电解质的Ksp越小,其溶解度也会越小。
分析:25℃,Ag2CrO4和AgCl的溶度积分别为1.12×10-12和1.77×10-10。经计算得知,25℃,Ag2CrO4的溶解度为0.004 g,AgCl的溶解度为0.000 19 g。所以电解质的Ksp越小,其溶解度不一定也越小,其原因还在于电解质的类型和摩尔质量不同。虽然不同的物理量可以反映物质的同一性质,但两者之间不一定有必然联系。


结论10.由于“同离子效应”的存在,所以AgCl在盐酸中的溶解性弱于在水中的溶解性,且盐酸的浓度越大溶解性越差。
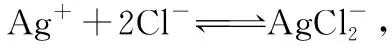
三、产生错误结论的原因分析
以上结论乍看是天衣无缝,细究却漏洞百出。究其原因,主要是基于直觉或直观联想等非逻辑思维主导对问题的分析,缺乏深度、理性的思考和严谨的逻辑推导,具体表现如下:
1.直觉思维导致了理解的肤浅
直觉思维是相对逻辑思维而言的,是指对一个问题未经逐步分析,仅依据内因的感知迅速地对问题答案做出判断,猜想等,直觉思维往往具有不可靠性。
基于大量事实的经验规律:“越弱越水解”“强酸制弱酸”等本身没有错,但在使用时如不能深刻把握规律使用的前提条件和内在逻辑关系,就会导致错误连出。从pH判断离子的水解程度强弱的前提是同温度、同浓度及正确的对应关系,如例1和例2。
2.重定性分析,轻定量推理,量化意识欠缺
任何事物都是质和量相互制约,相互联系的统一体。当我们认识事物、解决问题的时候,如果只做定性分析,不做定量推理,这种认识事物的方式是不全面、不科学的。
结论3未能从电离常数的角度认识多元弱酸中不同微粒酸性强弱的关系;结论4对于0.001 mol/L的CH3COOH溶液和pH=3的CH3COOH溶液之间c(H+)的反差认识不到位;结论5只是运用了多数离子水解比较微弱这样一个判断依据,没有基于定量计算S2-的水解程度;结论6对于溶液混合后离子浓度发生改变关注不够;结论7只是主观臆断Fe3+的存在环境,而没经过数据的定量计算。
3.不能辨析相似物理量之间的区别
对物质同一属性的描述和表达可以有不同的物理量,虽然不同的物理量反映的是物质的同一属性,但两者之间不一定有必然联系。
结论8涉及表示物质溶解性的两个物理量:Ksp和溶解度。Ksp是基于浓度,溶解度是基于质量,两者之间要建立联系,还要考虑溶质的摩尔质量、溶液的密度、电解质的类型等。所以一定温度下,难溶电解质的Ksp越小,其溶解度不一定也会越小。
4.主因意识不明确,没能抓住根本
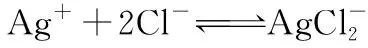
四、总结与反思

