大理某屠宰场猪弓形虫的分离及基因型鉴定
2018-12-05夏彬彬李海龙
罗 潇,夏彬彬,张 莉,3*,李海龙,3*
(1.大理大学基础医学院,云南大理 671000;2.保定市竞秀区妇幼保健院检验科,河北保定 071052;3.云南省自然疫源性疾病防控技术重点实验室,云南大理 671000)
弓形虫病是由寄生于有核细胞的刚地弓形虫(Toxoplasmagondii)引起的一种危害十分严重的人兽共患寄生虫病,严重危及食品安全与人类健康[1]。人类感染的主要方式之一为误食含有弓形虫的肉类及其副产品。云南省大理市位于云南省大理白族自治州,白族特色菜“生皮”是以生猪肉或生猪肝为主料拌蘸水而成,有报道显示弓形虫感染与食入“生皮”密切相关[2],云南省动物的弓形虫基因型研究有部分报道[3],但大理猪性虫株的基因型及其生物学特性的相关研究尚未见报道,且弓形虫基因型多样,不同基因型之间毒力差异较大。因此,本研究拟在大理地区分离弓形虫虫株,并进一步鉴定其基因型,为进一步研究其生物学特性奠定基础。
1 材料与方法
1.1 材料
1.1.1 标本和实验动物 新鲜猪肝147份采自大理屠宰场。4月龄雌猫1只购自大理宠物市场,血清弓形虫抗体检测阴性。
1.1.2 虫株和标准参照DNA RH株基因组DNA由华中农业大学兽医学院寄生虫教研室惠赠;弓形虫标准参照DNA为中国农业科学院兰州兽医研究所惠赠。
1.1.3 主要试剂 MgCl2(25 mmol/L)、dNTPs(2.5 mmol/L)、10×PCR buffer、rTaqDNA聚合酶(5 U/μL)、6×Loading buffer、DNA Marker DL 500和DNA Marker DL 2 000,购自TaKaRa公司;限制性内切酶MseⅠ、MboⅡ、BsmA Ⅰ、Hinf Ⅰ、RsaⅠ、Sau96 Ⅰ、HaeⅡ、MboⅠ、HhaⅠ、TaqⅠ、NciⅠ、BsiE Ⅰ、HaeⅢ、HpyCH4 Ⅳ、NlaⅢ、AvaⅠ、DdeⅠ、AflⅡ、10×NEB buffer 1-4和BSA,购自北京百灵科生物公司;细胞/组织DNA提取试剂盒,购自北京天根公司。
1.2 方法
1.2.1 弓形虫卵囊的分离 采集屠宰场新鲜猪肝147份,每份取约2 g直接喂猫,每天取粪便镜检,直到猫排出卵囊。采用丁健祖等[4]蔗糖漂浮法并稍加改进分离弓形虫卵囊: 取猫粪与450 g/L蔗糖液搅拌混匀、过滤、离心沉淀,吸顶层上清液于载玻片上,覆盖片后,镜检。吸取各管中上清液,1 mL~2 mL生理盐水稀释、离心,若粪便含有卵囊,则聚集在沉渣中,4℃冰箱中保存备用。
1.2.2 弓形虫卵囊DNA的提取 严格按照北京天根动物组织DNA提取试剂盒操作说明完成。
1.2.3 弓形虫DNA的鉴定 用套式PCR扩增B1基因部分序列对所分离虫株进行鉴定。套式PCR引物序列、反应体系和循环参数参考Alfonso Y等[5]的报道进行。引物序列F1:5′-TGTTCTGTCCTATCGCAACG-3′;R1:5′-ACGGATGCAGTTCCTTTCTG-3′;F2:5′-TCTTCCCAGACGTGGATTTC-3′;R2:5′-CTCGACAATACGCTGCTTGA-3′,其中F1和R1为外引物,F2和R2为内引物,套式PCR预期扩增片段的大小为530 bp。套式PCR经两轮反应,第一轮反应体系(25 μL)如下:12.5 μL 2×TaqPCR MasterMix,1.0 μL引物B1外1,1.0 μL引物B1外2,5.0 μL基因组提取液,5.5 μL双蒸水;第二轮反应体系(50 μL)如下:25.0 μL 2×TaqPCR MasterMix,引物B1内1、引物B1内2各1.0 μL,第1次扩增产物4.0 μL,19.0 μL双蒸水。两轮PCR反应的循环参数均为:94℃ 5 min;94℃ 30 s,52℃ 1 min,72℃ 90 s,35个循环;72℃延伸7 min。反应结束后将阳性PCR产物送到生物公司进行测序,以进一步确认样品中弓形虫的B1基因片段。
1.2.4 弓形虫的基因分型 采用Huang S Y等[6]报道的多基因位点PCR-RFLP方法对弓形虫阳性DNA进行基因型鉴定。以弓形虫阳性DNA为模板进行多重PCR扩增,再以扩增产物为模板采用套式PCR的方式扩增9个国际标准弓形虫株的12个位点(SAG1,5′+3′ SAG2,Alternative SAG2,SAG3,BTUB,GRA6,c22-8,c29-2,L358,PK1,Apico)的DNA,将终产物进行酶切后进行琼脂糖凝胶电泳,通过比较分析样本与国际标准虫株的酶切带型得到分离株弓形虫样本的基因型。套式PCR反应体系、引物序列和RFLP酶切体系参照Huang S Y等[6]的报道。
2 结果
2.1 大理猪弓形虫卵囊的分离
通过粪便镜检,于第6天在显微镜下可见弓形虫卵囊(命名为TgPDL1),第7天出现下痢,第7天~第8天镜下卵囊数量增多,第9天试验猫死亡。成功分离大理猪弓形虫卵囊(图1)。
2.2 弓形虫的DNA鉴定
卵囊组织DNA能扩增出目的片段,大小约530 bp的条带(图2)。将该基因测序结果通过NCBI网站的BLAST分析,与GenBank登录号为AF179871的弓形虫B1基因完全一致。
2.3 弓形虫基因分型
将样本基因酶切图谱与9个标准株的带型图进行分析比较,其中5′-SAG2基因位点和3′-SAG2基因位点的酶切图谱需结合判定。本研究的基因分型试验中能跑全12个位点的DNA样品,将样品酶切图谱与弓形虫标准株的带型比较分析后,最终得到卵囊弓形虫DNA的完整带型资料(表1)。对比分析表可得,从卵囊阳性样品中分出完整位点的样品,即ToxoDB #9型。
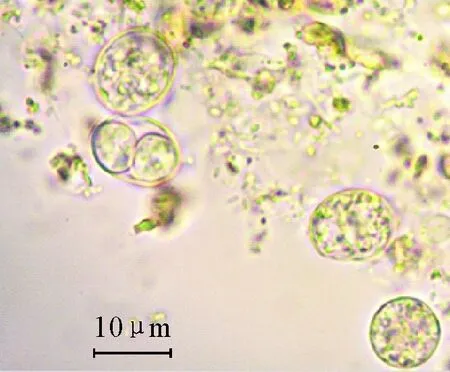
图1 大理猪弓形虫卵囊

M.DNA标准DL 2 000;1.弓形虫RH株;2.卵囊
M.DNA Marker DL 2 000;1.T.gondiiRH strain;2.oocysts
图2弓形虫卵囊的B1基因PCR检测
Fig.2 PCR amplification of B1 gene ofT.gondiioocysts
3 讨论
弓形虫虫株分离方法包括腹腔接种传代法[7]、直接分离法[8]、体外细胞培养法[9]等。在弓形虫的生活史中,弓形虫包囊被猫吞食后3 d~10 d就能够排出卵囊,本研究直接给猫喂新鲜肝脏,获得弓形虫卵囊,此种方法国内鲜见报道,该方法简化了弓形虫虫株分离所需的腹腔注射和传代培养等步骤,具有操作方便、快捷等优点。该方法的不足之处包括多份样品存在多种不同基因型虫株,难以区分,但是对于单一动物因弓形虫发病死亡,可采用该法分离病原并鉴定其基因型。
弓形虫基因分型起源于某个特定位点基因为检测弓形虫基因型的标记基因,如Howe D K[10]采用PCR-RFLP技术SAG2位点,Fazaeli A[11]等用GRA6基因,Grigg M E等[12]发现Bl基因应用于弓形虫株基因型的判定,但是只能检测传统的优势的基因型。随着弓形虫基因型鉴定的深入研究,同时利用多位点基因进行PCR-RFLP分析逐渐成为主要方法,Su C等[13]、Huang S Y等[6]利用多位点基因进行PCR-RFLP分析,都可以区分出一些少见的或罕见的基因型,明显提高了对传统和非传统优势基因型的辨别。
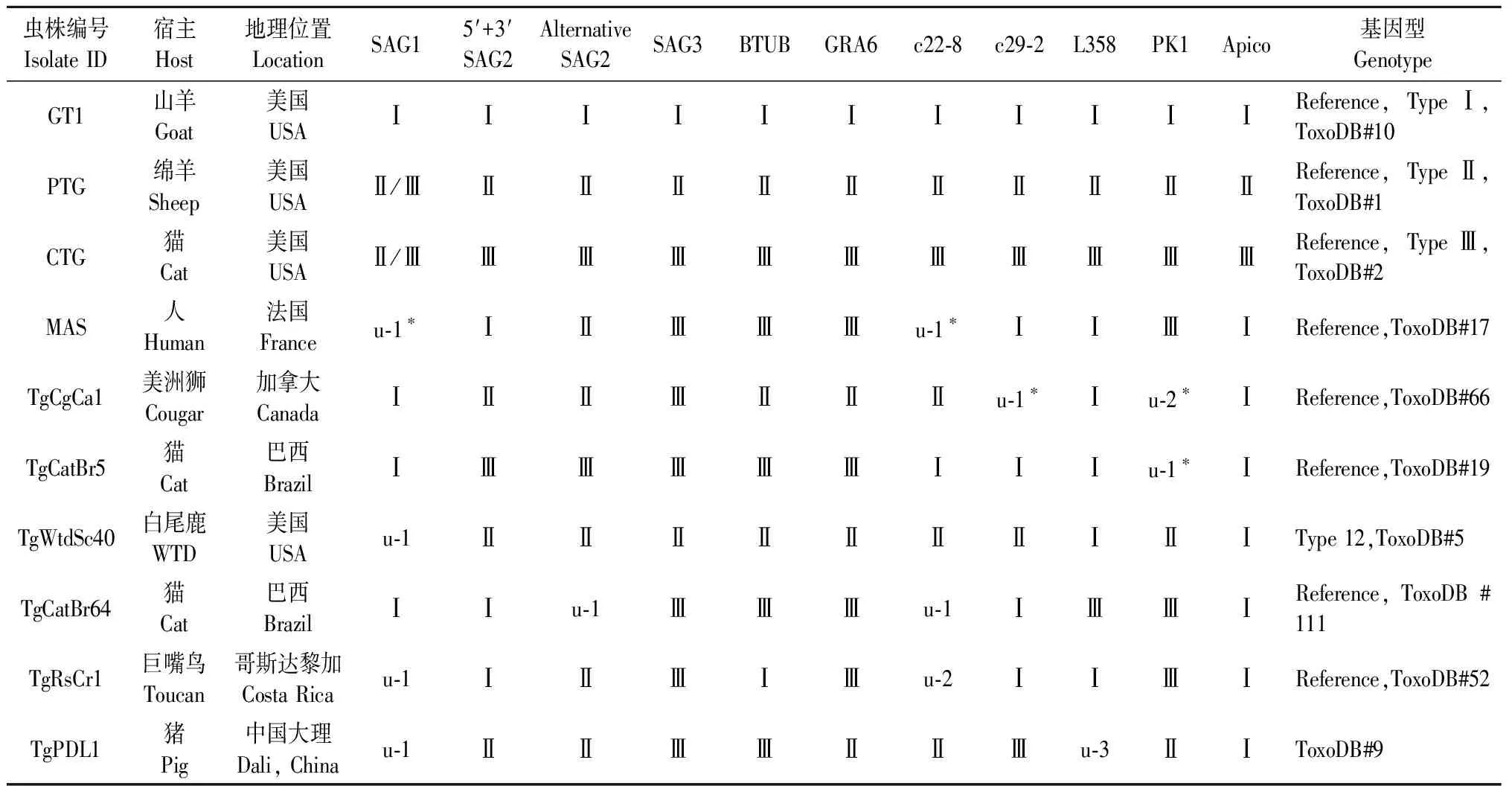
表1 大理猪弓形虫卵囊(TgPDL1)基因型的鉴定
注:* u-1,u-2和u-3分别代表独特的RFLP基因型,WTD.白尾鹿。
Note:*u-1,u-2 and u-3 represent unique RFLP genotypes,respectively,WTD.White-tailed deer.
目前,国内关于弓形虫虫株报道的基因型有ToxoDB#1、ToxoDB#2、ToxoDB#3、ToxoDB#9、ToxoDB#10、ToxoDB#20、ToxoDB#204、 ToxoDB#205、ToxoDB#225[14-15],本文从云南大理猪中分离到的弓形虫虫株为ToxoDB#9。
在我国云南省临沧、普洱、昭通和文山地区有关于猪弓形虫的基因研究[16],大理部分人群存在吃生猪肉的习俗,但是关于云南大理猪源弓形虫分离及基因型研究尚未见报道。本试验成功对大理猪源虫株的分离和分型,丰富了我国已有的弓形虫基因型的数据,为进一步研究其生物学特性奠定了基础。
