猪伪狂犬病病毒PCR-LFD检测方法的建立及应用
2018-12-05任卫科李秀丽王利丽池晶晶田向学鄢明华
张 莉,任卫科,李秀丽,路 超,王利丽,郑 丽,池晶晶,田向学,韩 伟,鄢明华
(1.农业部兽用药物与诊断技术天津科学观测实验站,天津 300381;2.天津市畜牧兽医研究所,天津 300381)
猪伪狂犬病(Pseudorabies,PR)是由疱疹病毒科、α-疱疹病毒亚科的伪狂犬病病毒(Pseudorabies viurse,PRV)引起的多种动物的一种高度接触性传染病[1]。猪是自然宿主。该病可导致怀孕母猪的流产、死胎、木乃伊胎和种猪不育等症状;哺乳仔猪常出现神经症状和死亡;成年猪一般呈亚临床或隐性感染,成为病毒的贮存宿主,长期排毒,但是自2011年后,我国多地区猪场中出现伪狂犬病病毒变异毒株,一些成年猪也出现神经症状和高病死率等情况[2-3]。猪伪狂犬病流行状况的变化给养猪业带来了巨大损失,因此,特异、敏感、快速的诊断方法对该病的防控至关重要。
目前,伪狂犬病的诊断方法有很多种,其中gE-ELISA方法和gB-ELISA常用于猪群的免疫抗体监测和预警,PCR方法和荧光定量PCR则是病原学诊断的主要方法[4]。PCR-LFD技术是将PCR技术、核酸探针杂交技术与横向流动试纸条(lateral flow dipstick,LFD)三项技术相结合,应用试纸条直接检测PCR扩增产物的技术。此项技术已在结核分支杆菌[5]、甲型H1N1病毒[6]、乙型肝炎病毒[7]、转基因黑曲霉[8]、口蹄疫病毒[9]等方面有了成功应用的报道。本研究根据猪伪狂犬病病毒的gE基因设计一套引物和探针,建立了猪伪狂犬病病毒的PCR-LFD特异性检测方法,为伪狂犬病的诊断提供了一种更为便捷的病原检测方法。
1 材料与方法
1.1 材料
1.1.1 供试病毒株和菌株 猪伪狂犬病病毒(PRV)SC株,由中国农业科学院哈尔滨兽医研究所猪烈性传染病创新团队赠送;猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪流感病毒(SIV)、猪伪狂犬病病毒(PRV)R13028株、猪伪狂犬病病毒(PRV)R13139株、猪肺炎支原体(MP)、副猪嗜血杆菌(Hps)均由天津市畜牧兽医研究所实验室保存;猪链球菌2型(SS2)、猪伪狂犬病病毒(PRV)MinA株购自国家兽医微生物菌种保藏管理中心;猪伪狂犬病病毒Bartha-K61株(PRV gE基因缺失株)、日本脑炎病毒(JEV)、猪瘟病毒(CSFV)疫苗株为市售疫苗。
1.1.2 主要试剂 rTaqDNA聚合酶、dNTP、2XGCbuffer I、DNA Marker DL 2 000,宝生物工程(大连)有限公司产品;核酸提取试剂盒,金瑞鸿捷生物科技有限公司产品;横向流动试纸条,杭州忧思达生物技术有限公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank数据库中猪伪狂犬病病毒gE基因(GenBank:AY173124)中的一段保守核苷酸序列,采用Primer Preimer5.0软件设计特异性PCR引物和探针,由宝生物工程(大连)有限公司合成(表1)。
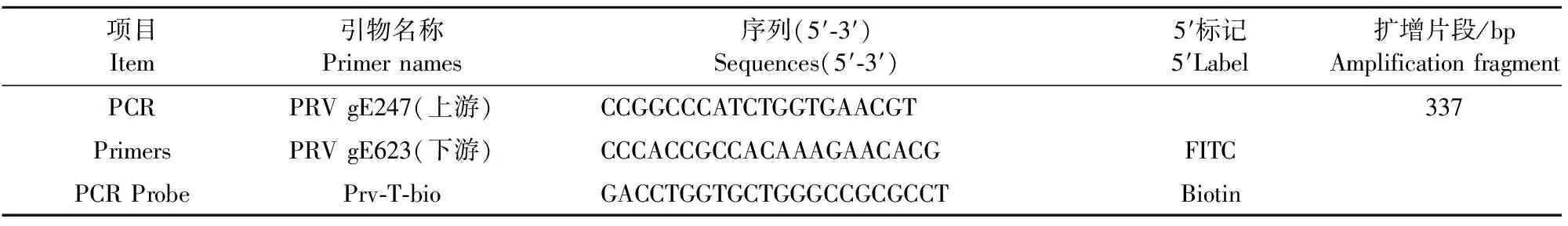
表1 引物序列
1.2.2 PCR-LFD方法的建立
1.2.2.1 PCR反应条件优化 PCR反应体系为20 μL:10 μL 2×GC buffer I,0.5 μL rTaqDNA聚合酶(8 U/μL),2 μL dNTPs(2.5 mmol/L),1 μL PRV gE247(10 μmol/L),1 μL PRV gE623(10 μmol/L),5.0 μL模板DNA,0.5 μL超纯水。PCR反应程序为:95℃ 5 min;94℃ 30 s,53℃至60℃ 30 s,72℃ 30 s,进行30个循环;72℃延伸5 min,4℃ 5 min。
1.2.2.2 退火温度的优化 固定其他条件不变,设定53、54、55、56、57、58、59、60℃共8个温度梯度,分别进行扩增,同时设立空白水对照。PCR反应结束,取8 μL PCR扩增产物进行琼脂糖凝胶电泳,在凝胶成像仪上观察并记录结果。
1.2.2.3 引物浓度的优化 经上述筛选出最佳退火温度后,固定反应体系其他试剂的添加量,对引物浓度用量设定为0.5 μL、1 μL、1.5 μL、2 μL,并设立空白水对照。反应结束,用琼脂糖凝胶电泳检测结果。
1.2.2.4 探针杂交反应条件优化 PCR反应结束后,开盖加入1 μL Prv-T-bio(10 μmol/L),增加一步杂交反应,94℃ 30 s,54℃至60℃ 30 s,4℃ 5 min。复性温度选择54、55、56、57、58、59、60℃分别进行杂交,摸索最佳反应条件。
1.2.2.5 LFD试纸条检测PCR产物 杂交反应结束后,取PCR产物10 μL加入到100 μL缓冲液,混合均匀;将LFD试纸条插入缓冲液3 min;取出将试纸条水平放置,5 min~10 min内读取结果。判定标准:质控线和检测线显现棕红色条带,为阳性;只有质控线显现棕红色条带,为阴性;只出现检测线为无效。
1.2.3 特异性试验 用已优化的PCR反应体系检测伪狂犬病病毒(PRV)SC株、伪狂犬病病毒(PRV)R13028株、伪狂犬病病毒(PRV)R13193株、伪狂犬病病毒(PRV)MinA株、猪伪狂犬病病毒Bartha-K61 株( PRV gE基因缺失株)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV-2)、猪猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、日本脑炎病毒(JEV)、猪流感病毒(SIV)、猪肺炎支原体(MP)、副猪嗜血杆菌(Hps)、猪链球菌2型(SS2)。探针杂交后,用琼脂糖凝胶电泳法和LFD分别检测扩增产物,确定所建立方法的特异性。
1.2.4 敏感性试验 将已知TCID50的伪狂犬病病毒稀释为105~101个TCID50,按常规方法提取DNA,分别取5 μL作为模板,其他反应条件不变进行PCR扩增。探针杂交后,用琼脂糖凝胶电泳法和LFD分别检测扩增产物,确定所建立方法的敏感性。
1.2.5 琼脂糖凝胶电泳法和LFD试纸条灵敏度比较 以伪狂犬病病毒SC株DNA为模板,按照优化后的PCR条件进行扩增,反应结束后,测定PCR扩增产物的核酸含量,并用纯水做10倍、100倍、1 000倍稀释。分别取出20 μL稀释产物,加入1 μL核酸探针,探针杂交反应后,用琼脂糖凝胶电泳法和LFD试纸条分别检测扩增产物,比较两种方法的差异。
1.2.6 重复性试验 采用同一批次和不同批次提取的猪伪狂犬病病毒DNA作为模板分别进行5次PCR扩增,用琼脂糖凝胶电泳法和LFD法检测扩增产物,确定所建立PCR-LFD方法的重复性。
1.3 临床样品的检测
从养殖场采集50份病料样品,用病毒分离培养法和PCR-LFD方法同时进行检测,比较两种方法的符合率。
2 结果
2.1 退火温度的优化
选择53℃~60℃ 8个复性温度进行扩增,结果显示56℃和55℃均能扩增出特异的目的条带,而且56℃亮度最强,因此,最终确定56℃为最适反应温度(图1)。

1~8.60℃、59℃、58℃、57℃、56℃、55℃、54℃、53℃;9.阴性对照;M.DNA 标准DL 2 000
1-8.60℃,59℃,58℃,57℃,56℃,55℃,54℃,53℃;9.Negative control;M.DNA Marker DL 2 000
图1复性温度优化
Fig.1 Optimization of the annealing temperature
2.2 引物浓度的优化
固定PCR体系中其他试剂的添加量,将引物浓度用量设定为0.5、1、1.5、2 μL分别进行PCR扩增,结果显示,加入0.5 μL引物时,扩增条带稍浅;加入1、1.5、2 μL引物时,扩增条带均清晰,无明显引物二聚体,因此,1 μL为最佳引物添加量(图2)。

1.2 μL引物(阳性对照);2.2 μL引物(阴性对照);3.1.5 μL引物(阳性对照);4.1.5 μL引物(阴性对照);5.1 μL引物(阳性对照);6.1 μL引物(阴性对照);7.0.5 μL引物(阳性对照);8.0.5 μL引物(阴性对照);M.DNA 标准DL 2 000
1.2 μL primer(postive control);2.2 μL primer(negnative control);3.1.5 μL primer(postive control);4.1.5 μL (negnative control);5.1 μL primer(postive control);6.1 μL (negnative control);7.0.5 μL primer(postive control);8.0.5 μL (negnative contro);M.DNA Marker DL 2 000
图2引物浓度优化
Fig.2 Optimization of the primer concentration
2.3 探针杂交反应条件优化
PCR反应液中加入标记Biotin的探针,复性温度选择54、55、56、57、58、59、60℃分别进行杂交,然后用LFD试纸条检测,结果54、59、60℃试纸条检测线未出现阳性条带,55、56、57℃时检测线有明显阳性带,但55℃和56℃的检测线较浅,57℃检测线最为明显,因此认为94℃ 30 s,57℃ 30 s,4℃ 5 min为最佳的探针杂交反应程序(图3)。

1~7.54℃、55℃、56℃、57℃、58℃、59℃、60℃;8.阴性对照
1-7.54℃,55℃,56℃,57℃,58℃,59℃,60℃;8.Negnative control
图3探针杂交温度筛选试验结果
Fig.3 Temperature screening test results of
probe hybridization reaction
2.4 特异性试验
本试验建立的猪伪狂犬病病毒PCR-LFD检测方法检测伪狂犬病病毒(PRV)SC株、伪狂犬病病毒(PRV)R13028株、伪狂犬病病毒(PRV)R13193株、伪狂犬病病毒(PRV)MinA株、猪伪狂犬病病毒Bartha-K61株(PRV gE基因缺失株)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRS)、猪细小病毒(PPV)、日本乙型脑炎病毒(JEV)、猪流感病毒(SIV)、猪肺炎支原体(MP)、副猪嗜血杆菌(Hps)、猪链球菌2型(SS2)。从图4可见所建立的PCR-LFD方法只能检测到伪狂犬病病毒SC株、R13028株、R13139株、MinA株,伪狂犬病病毒Bartha-K61株和其他对照菌毒株均为阴性,采用琼脂糖凝胶电泳和试纸条方法观察的检测结果完全一致。
2.5 敏感性试验
从图5可见,所建立的PCR方法的最低检测病毒滴度为102TCID50/100 μL,且采用琼脂糖凝胶电泳和试纸条方法的检测结果完全一致。
2.6 琼脂糖凝胶电泳法和LFD试纸条灵敏度比较
用核酸蛋白测定仪测定伪狂犬病病毒PCR扩增产物的核酸含量为482.5 ng/μL,将其稀释10倍、100倍、1000倍后,用琼脂糖凝胶电泳和LFD试纸条分别检测,结果见图6。从图中可看出当PCR产物稀释100倍后,已很难通过琼脂糖凝胶电泳观察到阳性结果,但是LFD试纸条仍可见较为清晰的红色检测线。说明LFD试纸条的灵敏度是琼脂糖凝胶电泳的10倍。

A.琼脂糖凝胶电泳检测;B.LFD试纸条检测;1.伪狂犬病病毒SC株;2.伪狂犬病病毒MinA株;3.伪狂犬病病毒R13028株;4.伪狂犬病病毒R13139株;5.伪狂犬病病毒Bartha-K61 株(gE);6.猪圆环病毒2型;7.猪瘟病毒;8.日本乙型脑炎病毒;9.细小病毒;10.猪繁殖与呼吸综合征病毒;11.猪流感病毒;12.猪肺炎支原体;13.副猪嗜血杆菌;14.猪链球菌2型;15.空白对照;M.DNA 标准DL 2 000
A.Agarose gel electrophoresis; B.LFD strips; 1.PRV SC strain;2.PRV MinA strain;3.PRV R13028 strain;4.PRV R13139;5.PRV Bartha-K61 strain(gE-);6.PCV-2;7.CSFV;8.JEV;9.PPV;10.PRRSV;11.SIV;12.MP;13.Hps;14.SS2;15.Negnative control;M.DNA Marker DL 2 000
图4 PCR特异性试验
Fig.4 Specificity test of PCR

A.琼脂糖凝胶电泳检测;B.LFD试纸条检测;1.阴性对照;2~6.101 TCID50~105 TCID50;M. DNA 标准DL 2 000A.Agarose gel electrophoresis; B.LFD strips; 1.Negnative control;2-6.101 TCID50-105 TCID50;M.DNA Marker DL 2 000
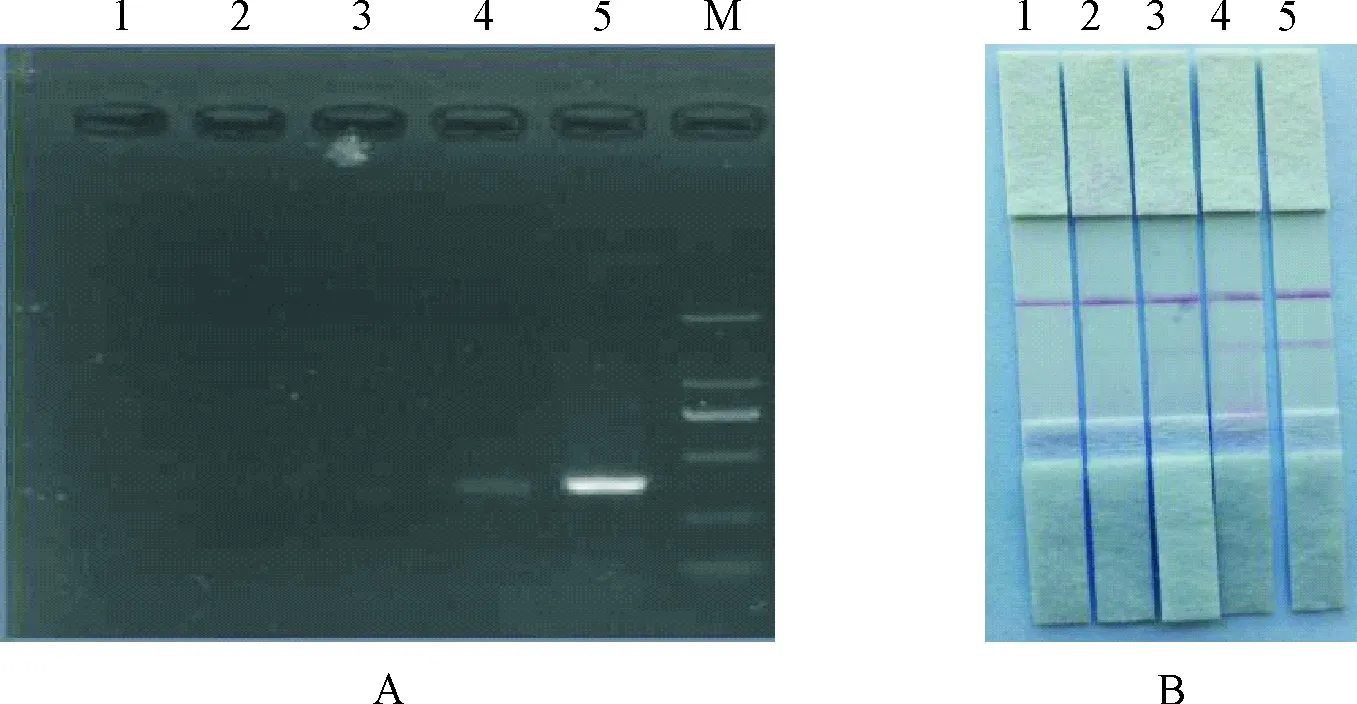
A.琼脂糖凝胶电泳检测;B.LFD试纸条检测;1.阴性对照;2~4.103,102,10稀释的PCR产物;5.原倍PCR产物;M.DNA 标准DL 2 000
A.Agarose gel electrophoresis; B.LFD strips; 1.Negnative control; 2-4.PCR products diluted 103,102,10 times; 5.The original time PCR procucts; M.DL 2 000 DNA Marker
图6琼脂糖凝胶电泳法与LFD试纸条法灵敏度比较试验
Fig.6 The sensitivity comparison of agar gel electrophoresis and LFD strips analysis
2.7 重复性试验
取同一次和不同时间提取的猪伪狂犬病病毒DNA各5份,将其作为模板进行5次PCR扩增,用LFD试纸条和琼脂糖凝胶电泳法检测扩增产物,两种方法结果完全一致,说明所建立的PCR-LFD方法具有良好的重复性。
2.8 临床样品的检测
对养殖场送检的50份病料样品用PCR、病毒分离培养法和PCR-LFD方法同时进行检测,结果PCR检测到14份阳性,而病毒分离培养法和PCR-LFD方法为16份,PCR-LFD方法的敏感性要高于常规PCR方法。从表2可见PCR-LFD方法与病毒分离培养法的符合率为100%,与常规PCR方法的阳性符合率为100%,阴性符合率为94.4%。用SPSS17.0软件对结果进行评估,PCR-LFD方法与PCR的χ2为0.1904,P>0.05,两种方法无显著差别。
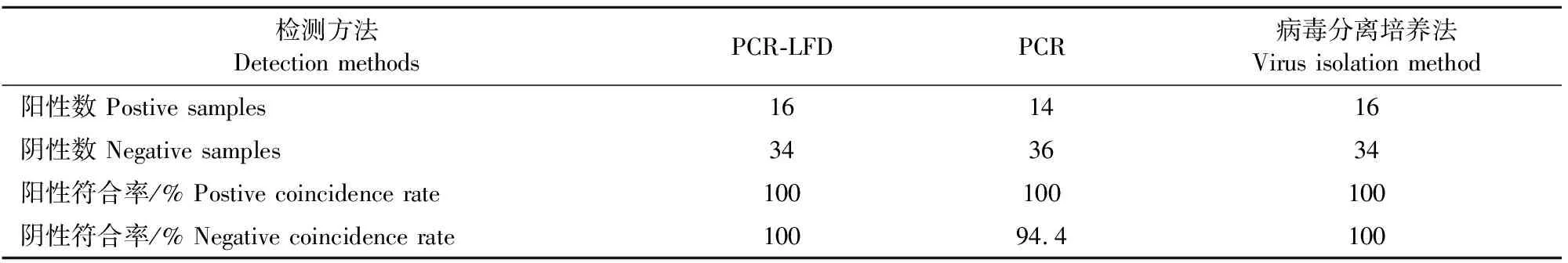
表2 两种方法检测结果比较
3 讨论
猪伪狂犬病是危害养猪业发展的重要传染病之一。对猪伪狂犬病病毒进行快速、及时、准确的诊断,是有效防控该病的重要前提。伪狂犬病病毒gE基因是其主要毒力决定因子,为病毒复制的非必需基因,也是世界动物卫生组织(OIE)所规定基因缺失疫苗的缺失基因。以gE序列作为靶序列建立的诊断技术,能够区分基因缺失疫苗接种与野毒感染[3]。王香玲等[10]根据猪伪狂犬病病毒gE基因序列保守区段,设计一对特异性引物,通过优化反应条件,建立了可区分猪伪狂犬病病毒野毒株与基因缺失疫苗株的PCR检测方法,该方法的敏感性为1.1 pg,有较高的特异性。张志等[11]建立了能够特异性检测PRV野毒株的套式PCR方法,该方法检测极限可达10个病毒拷贝/μL。田云等[12]建立检测伪狂犬病病毒野毒的荧光定量PCR方法,该方法的灵敏度可达4拷贝。常规PCR方法检测成本低,但需要琼脂糖凝胶电泳观察结果,且有时会出现假阳性结果。荧光定量PCR虽然敏感性高于PCR,可实时观看检测结果,但是需要昂贵的设备和试剂成本,不适用于基层实验室和规模化猪场使用。
本研究建立了一种基于猪伪狂犬病病毒gE基因的PCR-LFD检测方法,该方法是将PCR技术与LFD试纸相结合的一种可视化检测方法,在引物设计时将一条引物标记了异硫氰酸荧光素(FITC),在PCR反应后,体系中加入了一条标记生物素(Biotin)的探针,只有目的基因的PCR扩增产物才能与探针结合。采用试纸条对PCR扩增产物进行检测,杂交形成的复合体带有Biotin和FITC两种标记,用试纸条检测时检测线和质控线均出现棕红色条带。阴性PCR产物、假阳性PCR和引物二聚体不具有双重标记,不能与检测线结合,检测线不显色。该方法在PCR扩增后15 min内即可目测判定结果,与传统凝胶电泳法相比更快速,且避免使用溴化乙锭(EB)等核酸染料造成的环境污染[8]。
为了避免PCR结果出现假阳性,本研究在PCR扩增完成以后,增加了特异性探针杂交反应,进一步提高了该方法的特异性。试验结果表明,该方法可特异性检测猪伪狂犬病病毒野毒株,与缺失gE基因的Bartha-K61株和其他9种猪病病原无交叉反应。此外,对比LFD试纸条法和琼脂糖凝胶电泳法对PCR扩增产物检测结果的灵敏度发现,PCR-LFD方法的最低检测限度为100TCID50/100 μL,其敏感性比应用琼脂糖凝胶电泳方法高10倍。
针对2011年以来流行的猪伪狂犬病病毒变异株分子特征发生变化的特点,在试验中分别对伪狂犬病病毒经典强毒双城株(SC株)和闽A株(MinA株),新分离的猪伪狂犬病变异强毒R13139和R13028株,以及猪伪狂犬病病毒缺失gE基因的疫苗株Bartha-K61进行了检测,结果仅Bartha-K61株检测结果为阴性,其他4株PRV检测结果均为阳性,表明建立的方法适用于PRV经典强毒和变异的强毒株的检测。
以上结果表明,本研究建立的伪狂犬病病毒PCR-LFD检测方法具有敏感、快速、特异等特点,且操作简便、无需电泳可直接观察结果,可用于实验室、养殖场和基层兽医部门对伪狂犬病的诊断和监测预警,具有广阔的应用前景。
